
واکنش اکسیداسیون به واکنشی گفته می شود که طی آن اتم یا ترکیبی یک یا چند الکترون را از دست می دهد. واکنش اکسیداسیون با افزایش اکسیژن همراه بوده و واکنش کاهش با از دست دادن اکسیژن همراه است. لازم به ذکر است که واکنش اکسیداسیون به تنهایی رخ نداده و همزمان با واکنش کاهش رخ می دهد. بنابراین نمی توان آن ها را واکنش های مستقلی دانست. واکنش اکسیداسیون و واکنش کاهش را می توان به عنوان دو نیم واکنش در کنار یکدیگر قرار داد تا واکنش کامل شود. برای انجام واکنش اکسیداسیون به یک عامل اکسنده نیاز است. درواقع عامل اکسنده در واکنش اکسیداسیون یک پذیرنده الکترون است.
در ادامه این مطلب به بررسی تفاوت واکنش اکسیداسیون و احیا، تعریف اکسایش شیمی دهم، چند واکنش اکسایش کاهش و… می پردازیم. با ما همراه باشید تا بیشتر با واکنش های اکسیداسیون و انواع آن آشنا شوید.
واکنش اکسیداسیون چیست
واکنش اکسیداسیون و احیا به واکنش هایی گفته می شود که در آن ها حالت اکسید شدن اتمها در طی واکنش تغییر می یابد. در واکنش اکسیداسیون و کاهش تبادلی از الکترونها در بین واکنش دهندهها صورت می پذیرد. توجه شود که واکنش اکسیداسیون و اکسیداسیون و احیا با هم صورت گرفته و از هم جدا نیستند. اما می توان اکسیداسیون را به تنهایی و کاهش را به تنهایی به عنوان یک نیم واکنش در نظر گرفت. درواقع این دو نیم واکنش با هم اتفاق افتاده و یک واکنش کامل را تشکیل خواهند داد.
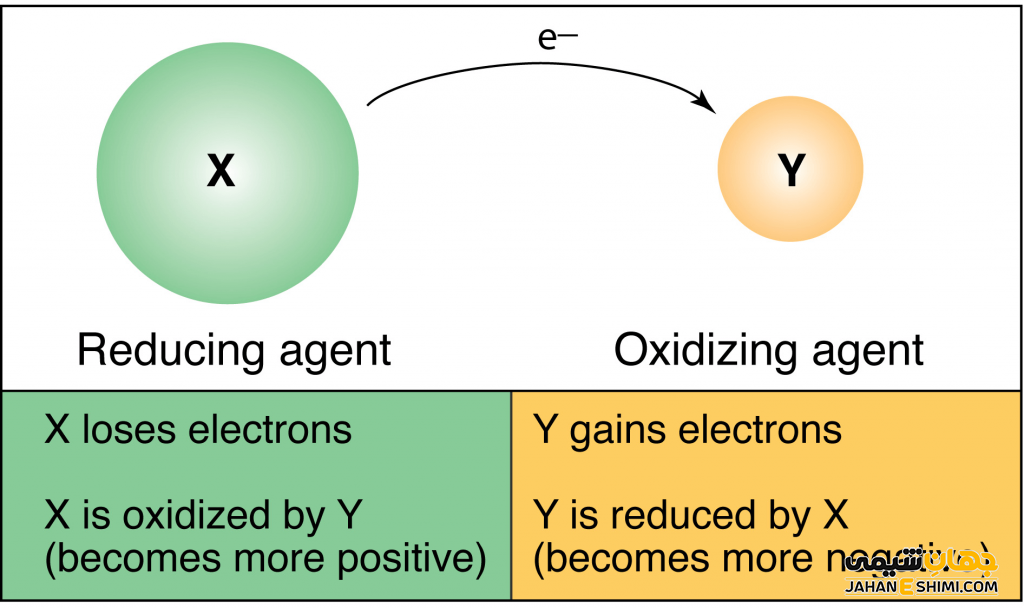
تعریف واکنش اکسایش و کاهش
تعریف های متفاوتی برای واکنش اکسیداسیون (اکسایش) و کاهش وجود دارد. درواقع این واکنش ها را می توان از نقاط مختلفی بررسی و مورد مطالعه قرار داد. در ادامه این مطلب از جهان شیمی فیزیک به بررسی واکنش اکسیداسیون احیا از جهات مختلف می پردارزیم. با ما همراه باشید تا بیشتر با این واکنش های مهم در شیمی آشنا شوید.
معرفی واکنش اکسیداسیون کاهش بر مبنای مبادله اکسیژن
تعریف این واکنش ها بر مبنای مبادله اکسیژن از قدیمی ترین و ابتدایی ترین تعاریف برای این واکنش ها محسوب می شود. بر مبنای این تعریف چنانچه ماده ای در يک واكنش شیمیایی اكسيژن بگيرد، اکسایش یافته و اكسيد شده است. این فرآیند طی نیم واکنش اکسیداسیون رخ می دهد. چنانچه ماده ای اكسيژن از دست بدهد، کاهش یافته یا احیا شده است. برای فهم بهتر مطلب واکنش زیر را در نظر بگیرید. مولکول V۲O۵ در واکنش زیر، اكسيژن از دست داده و احیا شده است. این درحالیست که مونوكسيد كربن با گرفتن اكسيژن اکسایش یافته و اكسيد شده است.
V۲O۵ +۲CO → V۲O۳ + ۲CO۲
واکنش اکسیداسیون احیا بر مبنای مبادله هیدروژن
بر طبق اين تعريف چنانچه عنصری هیدروژن از دست بدهد، اکسایش می یابد. درمقابل عنصری که هیدروژن بگیرد کاهش یافته و احیا شده است. واکنش زیر را در نظر بگیرید. در واکنش زیر سدیم هیدروژن گرفته، بنابراین احیا شده است. این در حالی است که مولکول آب در این واکنش با از دست دادن هیدروژن اکسایش یافته، پس اكسيد شده است.
Na + H۲O → NaOH + H۲
معرفی واکنش اکسیداسیون احیا بر اساس مبادله الکترون
بر طبق تعريف فوق عنصری که الکترون از دست بدهد، اکسایش یافته و عنصری که الکترون بگیرد کاهش یافته یا احیا شده است. در واکنش زیر مس را در نظر بگیرید. مس الکترون گرفته، بنابراین احیا شده است. درمقابل روی الکترون از دست داده و اکسایش یافته است.
Zn (s) + Cu۲+ (aq) ⟶ Zn۲+ (aq) + Cu (s)
تعریف واکنش ردوکس براساس عدد اکسایش
این تعریف اینطور توضیح می دهد که اگر در واکنش عدد اکسایش عنصری افزایش یابد، آن عنصر اکسایش یافته است. درمقابل اگر درواکنش عدد اکسایش عنصری کاهش یابد، آن عنصر کاهش یافته یا احیا شده است. این تعریف نسبت به سایر تعاریف جامع تر و کامل تر است. به واکنش زیر توجه نمایید. در این واکنش عدد اکسایش گوگرد از صفر به ۴+ افزایش یافته و گوگرد اکسید شده است. این در حالیست که عدد اکسایش اکسیژن از صفر به ۲- رسیده است. بنابراین می توان گفت احیا شده است.
S (s) + O۲ (g) → SO۲ (g)
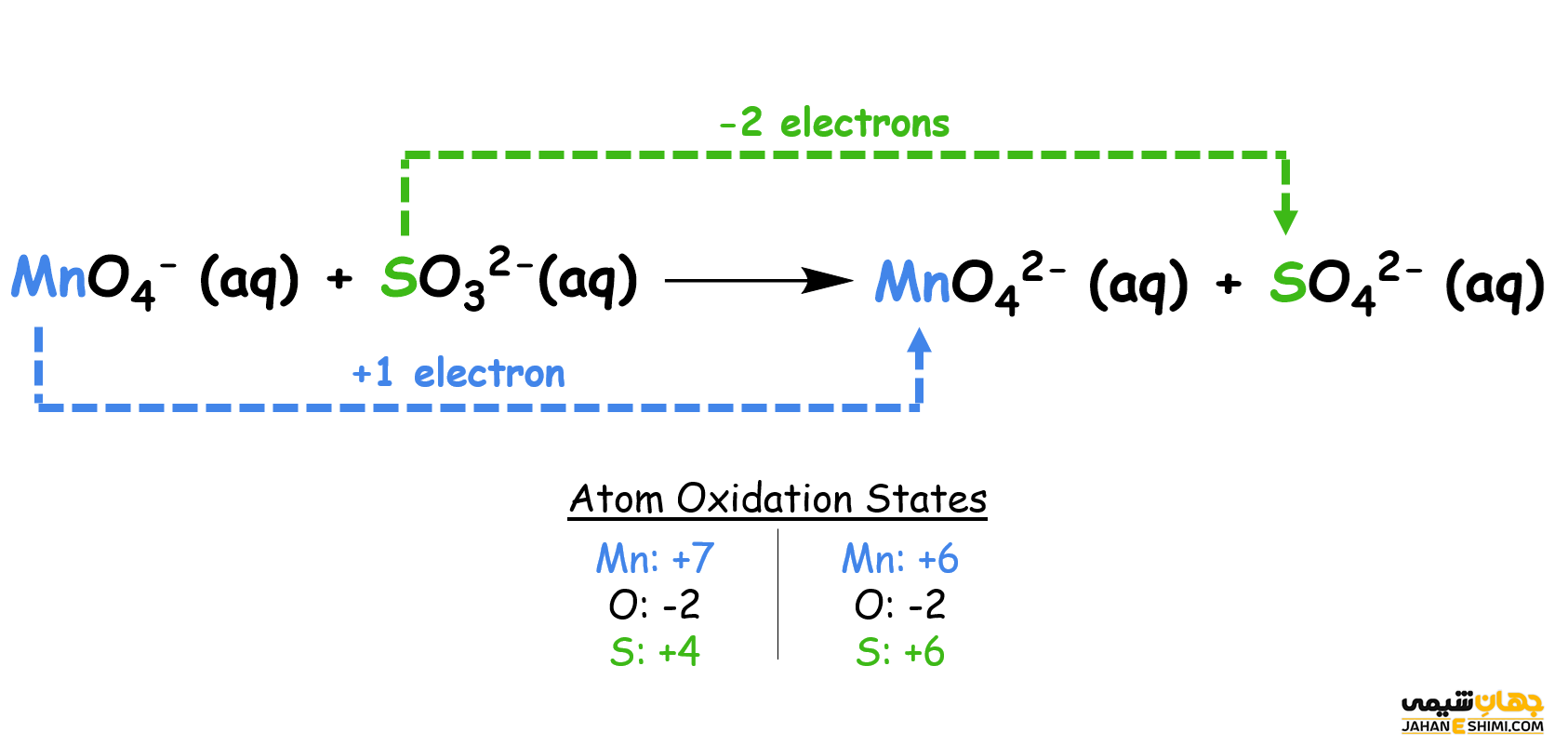
تشخیص واکنش اکسایش کاهش
از دست دادن يا گرفتن الكترون به تنهايی رخ نخواهد داد. به واكنش فرضی كه در آن عنصری الكترون گرفته و يا از دست بدهد، يک نيم واكنش گفته می شود. بنابراین در نیم واکنش ها الکترون های آزاد توسط مواد گرفته یا آزاد می گردند. به طور کلی یک نیم واکنش بخشی از یک واکنش کلی اکسیداسیون احیا محسوب می شود.
تعریف فوق از نیم واکنش را به شکل دیگری هم می توان بیان نمود. نیم واکنش به نیمی از یک واکنش اکسایش احیا گفته می شود که در چپ یا راست آن الکترون وجود دارد. البته مواد شرکت کننده در نیم واکنش ها، به صورت یون هایی با بار مثبت یا منفی به نمایش گذاشته می شوند.
نیم واکنش اکسیداسیون (اکسایش)
کشف الکترون موجب درک بهتر مفهوم اکسایش و تعریف دقیق تری از آن شد. به واکنش هایی که طی آن ماده با از دست دادن الکترون، عدد اکسایشش افزایش می یابد، اکسیداسیون (اکسایش) گفته می شود. لازم به ذکر است که اتم اکسیژن ممکن است در چنین واکنشی شرکت داشته یا نداشته باشد. الکترون ها در نیم واکنش اکسایش در سمت راست نیم واکنش نوشته شده و نیمه واکنش اکسیداسیون گرمازاست. برای درک بهتر مطلب به نیم واکنش سوختن منیزیم که در ادامه اشاره شده است، توجه نمایید.
–۲Mg (s) ⟶ ۲Mg ۲+ (s) + 4e
اتم منیزیم دو الکترون از دست داده و اکسایش یافته است. در طی این واکنش منیزیم دارای بار مثبت گردیده و عدد اکسایش آن از صفر به ۲+ تغییر یافته است.
نیم واکنش احیا (کاهش)
واکنش هایی که در آن ها ماده ای الکترون گرفته و عدد اکسایشش کاهش می یابد، واکنش احیا گفته می شود. الکترون ها در نیم واکنش های کاهش در سمت چپ نیم واکنش نوشته می شوند. این نیم واکنش گرماگیر است. برای درک بهتر مطلب به نیمه واکنش زیر در سوختن منیزیم توجه شود.
O۲ (g) + 4e– → ۲O۲– (s)
طی این واکنش، اتم اکسیژن الکترون های اتم منیزیم را به سمت خود کشیده و دارای بار منفی می شود. عدد اکسایش اکسیژن از صفر به ۲- کاهش خواهد یافت. توجه شود که دو نیم واکنش به طور همزمان انجام می شوند. این بدان معناست که الکترون به طور کاملا همزمان از منیزیم به اکسیژن انتقال می یابد. درنهایت اتم منیزیم الکترون از دست داده، پس اکسایش پیدا کرده و اتم اکسیژن را احیا می کند.
معرفی مواد اکسید کننده در واکنش اکسیداسیون کاهش
ترکیبات اکسنده به موادی گفته می شود که از سایر مواد الکترون گرفته و آن ها را اکسید کرده و خود احیا می شوند. به ترکیباتی که یکی از اجزای آن ها به بالاترین درجه اکسایش خود برسد، اکسید کننده قوی گفته می شود. درواقع هر چه توانایی قبول الکترون بالاتر باشد، آن ماده از نظر شیمیایی اکسنده قوی تری خواهد بود. در ادامه به مثال هایی از اکسنده های قوی اشاره شده است.
- اسید نیتریک (HNO۳)
- پتاسیم دی کرومات (K۲Cr۲O۷)
- پتاسیم پرمنگنات (KMnO۴)
- ید
- کلرید آهن (III)
- پروکسید هیدروژن
- یدات پتاسیم
- کلر
- برم
بر اساس تعریف اکسایش و احیا که در بالا اشاره شد، ماده اکسنده ماده ای است که دارای یکی از چهار خواص زیر باشد.
- اکسیژن از دست بدهد
- هیدروژن بگیرد.
- الکترون بگیرد.
- عدد اکسایش آن کوچک شود.
واکنش اکسیداسیون با پراکسید هیدروژن و ازن
نام دیگر این فرآیند پروکسون است. در فرایند پراکسید هیدروژن/ ازن، H2O2 موجب تجزیه ازن به رادیکال های هیدروکسیل خواهد شد. کاربرد این واکنش در حذف آلاینده های مقاوم به تجزیه توسط ازن بسیار مفید است. توجه شود که نسبت غلظت ازن و پراکسید هیدروژن بر راندمان فرایند اکسیداسیون تاثیر بالایی دارد.
بهترین نسبت مولی ازن به پراکسید هیدروژن در فرایند پروکسون در محدوده ۰.۵ تا ۱ بوده و به تسریع کننده های واکنش و دام اندازهای رادیکال بستگی دارد. در این واکنش ها H2O2 هم به عنوان آغازگر واکنش و هم دام انداز رادیکال عمل خواهد نمود. در این واکنش نسبت مطلوب ازن به پراکسید هیدروژن امری ضروری بوده و برای بهینه سازی واکنش امری مطلوب است. H2O2 با از دست دادن پروتون به –HO۲ تبدیل شده و با ازن واکنش می دهد. این واکنش موجب تجزیه ازن و تولید رادیکال هیدروکسیل خواهد شد.
واکنش اکسیداسیون تحت پرتوهای ماورای بنفش و ازن
استفاده تجاری از این واکنش برای اولین بار در سال ۱۹۷۵ در صنعت تصفيه آب به کار گرفته شد. در ادامه کاربرد از فواید آن در تصفیه آلاینده هایی همچون سیانیدها، حلال کلرینه و انواع حشره کش نیز استفاده شد. در این فرآیند اکسیداسیون آلاينده ها توسط ازن، تجزیه نوری و رادیکال های هیدروکسیل با فرایند اکسیداسیون مستقیم صورت می پذیرد. البته شرایط واکنش، میزان کیفیت آب، مقدار پرتو UV جذب شده توسط آلاینده و واکنش پذیری آلاینده ها با پرتوهای UV بر فرآیند اکسیداسیون موثر هستند.
از مزایا این انواع واکنش اکسیداسیون این است که کاربرد صنعتی یا آزمایشگاهی آن ها موجب حذف سریع تر ترکیبات هالوژنه آروماتیک نسبت به ازن زنی معمولی می گردد. در این واکنش ها بسته به آب و پارامترهای آن نسبت بهینه ازن به UV تعیین می گردد. پرتوهای UV با فتولیز ازن محلول در آب سبب تولید پراکسید هیدروژن و تجزیه بیشتر ازن می شود. این واکنش نیز مکانیسمی مشابه با سیستم H۲O۲ ،O۳ دارد.
اکسیداسیون پيشرفته فوتوشیمیایی
فرآيندهای اکسيداسيون پيشرفته فوتوشيميايی ترکيبی از اشعه ماورا بنفش و اکسنده ای قوی همچون پراکسيد هيدروژن، ازون و… هستند. این فرآیندها موجب توليد راديکال های هيدروکسيل گشته و استفاده از این رادیکال ها به دلیل واکنش اکسيداسيون در تخريب ريزآلاينده ها در فرآيندهای تصفيه پساب صورت می پذیرد.

راديکال های هيدروکسيل در واکنش با مواد آلی دارای انتخاب پذيری جزئی هستند. اين نکته برای مواد اکسنده به عنوان يک امتياز محسوب می شود. مواد مختلف آلی با ساختارهای طولانی و مولکول های حاوي پيوندهای غير اشباع همچون آلکان های کلردار، برای اکسايش با اين راديکال بسيار مستعد هستند. اما مولکول های ساده مانند استيک، مالئيک و اگزاليک اسيد نمی توانند با این OH وارد اکنش دهند. مکانيسم اکسايش مواد با OH به نوع ماده آلی وابسته بوده و به دو صورت می تواند رخ دهد.
- روش اول این است که راديکال OH از مولکول های آلی هيدروژن گرفته و به مولکول آب تبدیل گردد، همانند آلکان ها يا آلکين ها.
- روش دوم افزودن اين راديکال به ساختمان مولکولی مواد و درادامه شکستن پيوندهای میان آنهاست. این روش در رابطه با الفين ها و آروماتيک ها رخ می دهد.
تعریف اکسایش شیمی دهم
واکنش اکسایش و کاهش یا (Redox) واکنشی شیمیایی است که در طی انجام آن، حداقل یک عنصر در عدد اکسایش تغییر خواهد یافت. درواقع واکنشی که در آن یک یا چند اتم الکترون از دست داده و یک یا چند اتم دیگر الکترون به دست می آورند را واکنش ردوکس گویند. بسیاری از واکنش های اکسایش و احیا در محلول های آبی یا سوسپانسیونی صورت می پذیرند.
سخن آخر
در این مطلب از جهان شیمی به بررسی واکنش اکسیداسیون احیا پرداختیم. انواع واکنش اکسیداسیون وجود داشته و در فرایند های مختلفی رخ می دهند. این واکنش ها از اهمیت بالایی در صنعت برخوردارند و در زمینه های مختلفی مورد استفاده قرار می گیرند.




















یک دیدگاه