
سوختن یا احتراق یک واکنش شیمیایی اکسایش گرمازا بین سوخت (کاهنده) و اکسیدانی است که معمولاً اکسیژن موجود در اتمسفر است و طی آن مخلوطی با عنوان دود ، محصولات اکسید شده و اغلب گازی تولید می شود.

احتراق همیشه منجر به آتش سوزی نمی شود ، زیرا یک شعله فقط زمانی قابل مشاهده است که موادی تحت احتراق قابلیت بخار شدن داشته باشند اما وقتی این اتفاق می افتد ، شعله یک شاخص مشخصه واکنش است. در مبحث سوختن چیست علوم هشتم این موارد شرح داده شده است.
در حالی که برای شروع احتراق باید بر انرژی فعال سازی غلبه کرد ولی گرمای حاصل از شعله ممکن است انرژی کافی را برای ادامه واکنش فراهم کند. سوختن یا احتراق یک اصطلاح فنی برای بیان یک فرآیند شیمیایی است که هنگام ترکیب سوخت با یک اکسیدان ایجاد می شود. برخی از نمونه های متداول سوختن عبارتند از: سوزاندن چوب برای گرم کردن خانه ، واکنش سوختن بنزین برای راه اندازی ماشین و سوختن گاز طبیعی برای پختن غذا روی اجاق گاز. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا ما را همراهی کنید.
سوختن را تعریف کنید
سوختن یک واکنش گرمازا است به این معنا است که گرما از خود آزاد می کند ، اما گاهی اوقات واکنش آنقدر آهسته پیش می رود که تغییر دما در آن قابل احساس کردن نیست. احتراق همیشه منجر به آتش سوزی نمی شود ، اما هنگامی که اتفاق می افتد ، شعله نمایانگر انجام واکنش است.
احتراق را می توان قدیمی ترین فناوری بشر و یکی از مهمترین اکتشافات یا اختراعات ما دانست. سوختن سابقه بسیار طولانی دارد. از دوران باستان تا قرون وسطی ، آتش به همراه زمین ، آب و هوا یکی از چهار عنصر اساسی جهان شمرده می شد. احتراق ، انفجار و شعله از همان دوران اولیه مورد توجه بشر بوده است.
آتش از مدتها قبل توسط انسان برای اهداف مختلفی مانند پخت و پز ، تولید فلز و جنگ استفاده می شده است. با این حال ، از آنجا که پدیده های احتراق پیچیده است ، پیشرفت چشمگیر در درک نظریه احتراق تنها در دهه های گذشته با همکاری نزدیک آزمایش و نظریه پردازان حاصل شد.
نمونه هایی از سوختن
هنگامی که مواد به طور خود به خود با اکسیژن واکنش نشان می دهند گرما و نور تولید می شود و گرمای آزاد شده به روند کار دامن می زند و واکنش را تسریع می کند. اگر برای کنترل این روند کاری انجام نشود ، شکل آتش به خود می گیرد. همین طبیعت خود به خودی است که احتراق را از سایر فرآیندهای مشابهی که در حضور اکسیژن اتفاق می افتد متمایز می کند . نمونه های متداول واکنش های سوختن که در زندگی روزمره انسان ها بسیار رایج است ، در زیر آورده شده است.
سوخت LPG در اجاق های گاز برای پخت غذا شامل یک واکنش احتراق بین اکسیژن موجود در جو و گاز مایع است. موتورهای اتومبیل و سایر وسایل مبتنی بر سوخت فسیلی نیروی خود را از واکنش احتراق بین بنزین (یا گازوئیل) با اکسیژن به دست می آورند. روشنایی چوب کبریت نیز بر اساس واکنش سوختن است. فسفر قرمز در نوک چوب کبریت با زدن آن به یک سطح خشن گرم می شود و باعث واکنش بین فسفر و اکسیژن موجود جو می شود.

به غیر از این واکنش های احتراق اساسی ، بسیاری از این واکنش ها در طیف گسترده ای از صنایع به کار گرفته می شوند. به عنوان مثال سفینه های فضایی از واکنش احتراق بین هیدروژن و اکسیژن برای تولید انرژی استفاده می کنند. سوزاندن متان ، ماده اصلی تشکیل دهنده گاز طبیعی ، نمونه ای از واکنش طبیعی در برابر سوختن است. اجاق ها و کوره هایی که با گاز طبیعی کار می کنند دارای یک شعله آماده یا یک جرقه هستند تا انرژی اولیه مورد نیاز برای تحریک واکنش احتراق را تأمین کنند.
سوزاندن منیزیم ، دی اکسید کربن یا بخار آب منتشر نمی کند اما یک فرآیند احتراقی است زیرا یک واکنش گرمازای حاصل از یک ماده سوختی با اکسیژن است. قرار دادن منیزیم در معرض هوا برای شروع سوزاندن کافی نیست ، اما جرقه یا شعله پیوندهای بین مولکول های اکسیژن موجود در هوا را می شکافد تا واکنش ادامه یابد.
نمونه هایی از واکنش های سوختن
باید مد نظر داشته باشیم که واکنش های احتراق به راحتی قابل مشاهده هستند زیرا بیشتر مواقع آب و دی اکسید کربن تولید می کنند. در اینجا چندین نمونه از معادلات برای واکنش های احتراق آورده شده است. توجه داشته باشید که در حالی که گاز اکسیژن همیشه به عنوان واکنش دهنده وجود دارد ، در نمونه های پیچیده تر ، اکسیژن از واکنش دهنده دیگری حاصل می شود.
احتراق متان
CH۴(g) + 2 O۲(g) → CO۲(g) + 2 H۲O(g)
سوزاندن نفتالین
C۱۰H۸ + ۱۲ O۲ → ۱۰ CO۲ + ۴ H۲O
احتراق اتان
۲ C۲H۶ + ۷ O۲ → ۴ CO۲ + ۶ H۲O
احتراق بوتان (که در فندک ها دیده می شود)
۲C۴H۱۰(g) +13O۲(g) → ۸CO۲(g) +10H۲O(g)
احتراق متانول ( به عنوان الکل چوب نیز شناخته می شود)
۲CH۳OH(g) + 3O۲(g) → ۲CO۲(g) + 4H۲O(g)
احتراق پروپان (در شومینه و برخی از اجاق های آشپزی استفاده می شود)
۲C۳H۸(g) + 7O۲(g) → ۶CO۲(g) + 8H۲O(g)

انواع سوختن
روند سوختن را می توان بر اساس انرژی مورد نیاز برای رخ دادن و محصولات جانبی واکنش به انواع مختلف تقسیم می شوند. در اینجا نگاهی دقیق به پنج نوع آن می اندازیم:
سوختن کامل
احتراق کامل به ترکیبی متناسب از سوخت و اکسیژن نیاز دارد. در طی فرآیند احتراق ، واکنش دهنده کاملاً در اکسیژن سوزانده می شود و مقدار محدودی از محصول جانبی باقی می گذارد. وقتی هیدروکربن در اکسیژن سوزانده می شود ، واکنش معمولاً منجر به تولید دی اکسید کربن و آب می شود.
وقتی سایر عناصر سوزانده می شوند ، آنها معمولاً اکسیدهای شناخته شده را به عنوان فراورده های سوختن تولید می کنند. به عنوان مثال ، کربن، دی اکسید کربن تولید می کند ، سوختن نیتروژن منجر به دی اکسید نیتروژن می شود و گوگرد ، دی اکسید گوگرد تولید می کند.
سوختن ناقص
احتراق ناقص زمانی اتفاق می افتد که اکسیژن کافی برای واکنش کامل سوختن وجود نداشته باشد. در این حالت ، محصولات جانبی فقط دی اکسید کربن و آب نیستند. در عوض این واکنش ها باعث تولید مونوکسیدکربن ، گاز سمی و آلاینده محیط زیست و دوده خواهد شد مانند واکنش سوختن ناقص هیدروکربن ها. سوختن ناقص نسبت به سوختن کامل انرژی کمتری تولید می کند و باعث می شود در کل کارآیی کمتری داشته باشد. بسیاری از سوخت های فسیلی از جمله ذغال سنگ به طور ناقص می سوزند و مواد آلاینده را در محیط زیست آزاد می کنند.
سوختن سریع
وقتی عناصر اولیه برای ایجاد واکنش به انرژی گرمایی خارجی نیاز دارد ، آن را به عنوان احتراق سریع طبقه بندی می کنیم. این واکنش همچنان ادامه خواهد داشت تا زمانی که تمام سوخت سوزانده شود. محصول جانبی این شکل از احتراق مقدار زیادی گرما و انرژی نورانی است.
یکی از نمونه های متداول این نوع احتراق هنگامی رخ می دهد که شمع روشن می کنید. واکنش احتراق زمانی اتفاق می افتد که شعله فتیله را مشتعل می کند و یک نور ثابت تولید می کند که تا سوزاندن تمام موم متوقف نمی شود.
سوختن خود به خودی
احتراق خود به خود همانطور که از نامش پیداست برای شروع واکنش به انرژی خارجی نیاز ندارد و خود به خود اتفاق می افتد. طی این فرآیند افزایش دما به دلیل واکنش داخلی رخ داده و وجود اکسیژن کافی فرآیند را شروع می کند. وقتی سوخت به دمایی رسید که به اندازه کافی انرژی داشته باشد ، به خودی خود مشتعل می شود. به عنوان مثال ، فسفر بدون استفاده از گرما در دمای اتاق خود به خود شعله ور می شود.
سوختن انفجاری
احتراق انفجاری دقیقاً همان چیزی است که انتظار دارید. انفجار با سرعتی بسیار سریع اتفاق می افتد. هنگامی که از نیرویی برای اشتعال سوخت استفاده می شود ، بلافاصله انرژی گرما ، نور و صدا تولید می شود. یکی از نمونه های متداول این سوختن را می توان در وسایل آتش بازی مشاهده کرد. وقتی جرقه فیوز را روشن می کند وسیله آتش بازی منفجر می شود و باعث تولید گرما ، نور و صدا می شود.
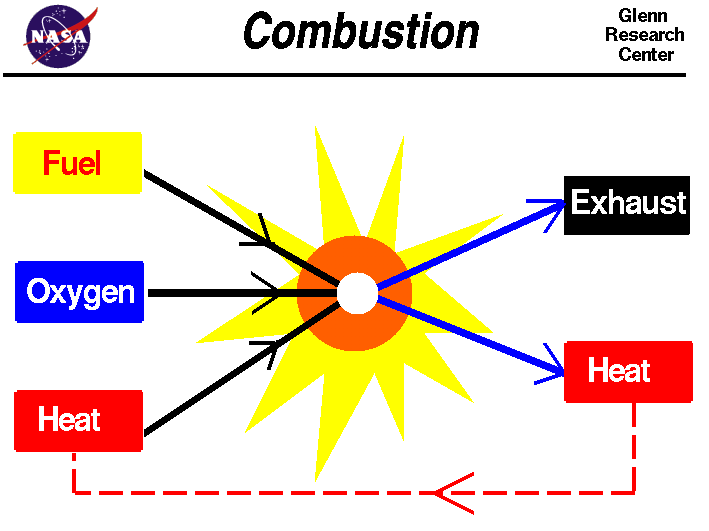
ویژگی واکنش های احتراقی
شعله های آتش بدون شک اولین وسیله ای است که در آن فرآیندهای برخورد اتمی نقش مهمی دارند. دانش اولیه در مورد واکنش های سوختن همچنان برای توسعه روش های اقتصادی تر برای استفاده از منابع سوخت فسیلی ضروری است. اصطلاح “شعله” به مفهوم وسیع آن شامل هرگونه واکنش لومینسانس و احتراق هرگونه واکنش فاز گاز نسبتاً سریع است.
مثلا سوختن هیدروژن باعث ایجاد واکنش های پیچیده زنجیره ای شامل برخورد اتم های نیتروژن و اکسیژن با مولکول های اکسیژن و هیدروژن می شود و باعث ایجاد رادیکال های هیدروکسیل می شود. محصول نهایی این واکنش گاز است که توسط مخلوطی از مولکول های هیدروکسیل و هیدروژن تشکیل می شود. برای ادامه واکنش باید مواد سوختی و اکسیژن و همچنین یک منبع خارجی انرژی برای شروع چرخه احتراق وجود داشته باشد.
اگرچه بعضی از مواد در اثر مخلوط شدن با گاز اکسیژن به طور خود به خود شعله ور می شوند ، اما بیشتر مواد برای شروع سوختن به جرقه یا شکل دیگری از انرژی نیاز دارند. اگر واکنش احتراق شروع شود ، گرمای تولید شده توسط واکنش برای ادامه کافی است.
نقطه اشتعال چیست
روش ها و اصطلاحات مختلفی برای اندازه گیری قابلیت اشتعال و احتراق یک ماده استفاده می شود. دو مورد از این اصطلاحات نقطه اشتعال و دمای اشتعال هستند. اگرچه آنها شباهت هایی دارند، اما اصطلاحات بسیار متفاوتی هستند. نقطه اشتعال پایین ترین دمایی است که در آن یک ماده بخار می شود و به گاز تبدیل می شود که می تواند با وارد کردن یک منبع خارجی آتش مشتعل شود. دو روش اصلی برای اندازه گیری نقطه اشتعال وجود دارد: فنجان باز و بسته.
آزمایش نقطه اشتعال فنجان باز زمانی اتفاق می افتد که ماده در ظرفی قرار می گیرد که به اتمسفر بیرون باز است. سپس دمای آن به تدریج افزایش می یابد و در فواصل زمانی یک منبع اشتعال از بالای آن عبور می کند. هنگامی که ماده “چشمک می زند” یا مشتعل می شود، به نقطه اشتعال خود رسیده است.
آزمایش نقطه اشتعال فنجان بسته در داخل یک ظرف مهر و موم شده انجام می شود و منبع احتراق به داخل ظرف وارد می شود. در نتیجه، این ماده در معرض عناصر خارج از ظرف قرار نمی گیرد، که می تواند تأثیر تداخلی بر نتایج آزمایش داشته باشد. این نیز به نوبه خود منجر به کاهش نقاط اشتعال می شود، زیرا گرما در داخل به دام می افتد. از آنجا که نقطه اشتعال پایین تر است، همچنین برای استفاده گسترده ایمن تر است و به این ترتیب عموماً پذیرفته شده است.
برخلاف نقاط اشتعال، دمای احتراق نیازی به منبع احتراق ندارد. به عبارت دیگر، دمای اشتعال کمترین دمایی است که در آن یک ماده فرار تبدیل به گازی می شود که بدون کمک شعله یا منبع اشتعال خارجی مشتعل می شود. در نتیجه دمای احتراق البته بالاتر از نقطه اشتعال است. با این حال، باید تأکید کرد که هر دوی این اصطلاحات، ویژگی های اساسی و غیرمتغیر متعلق به مواد نیستند. بلکه نتایج تجربی هستند که از طریق آزمایش به دست آمده اند، که می توانند بر اساس تجهیزات مورد استفاده، روش انتخاب شده و محیطی که در آن انجام می شود متفاوت باشد.



















