معرفی جدول تناوبی کامل عناصر
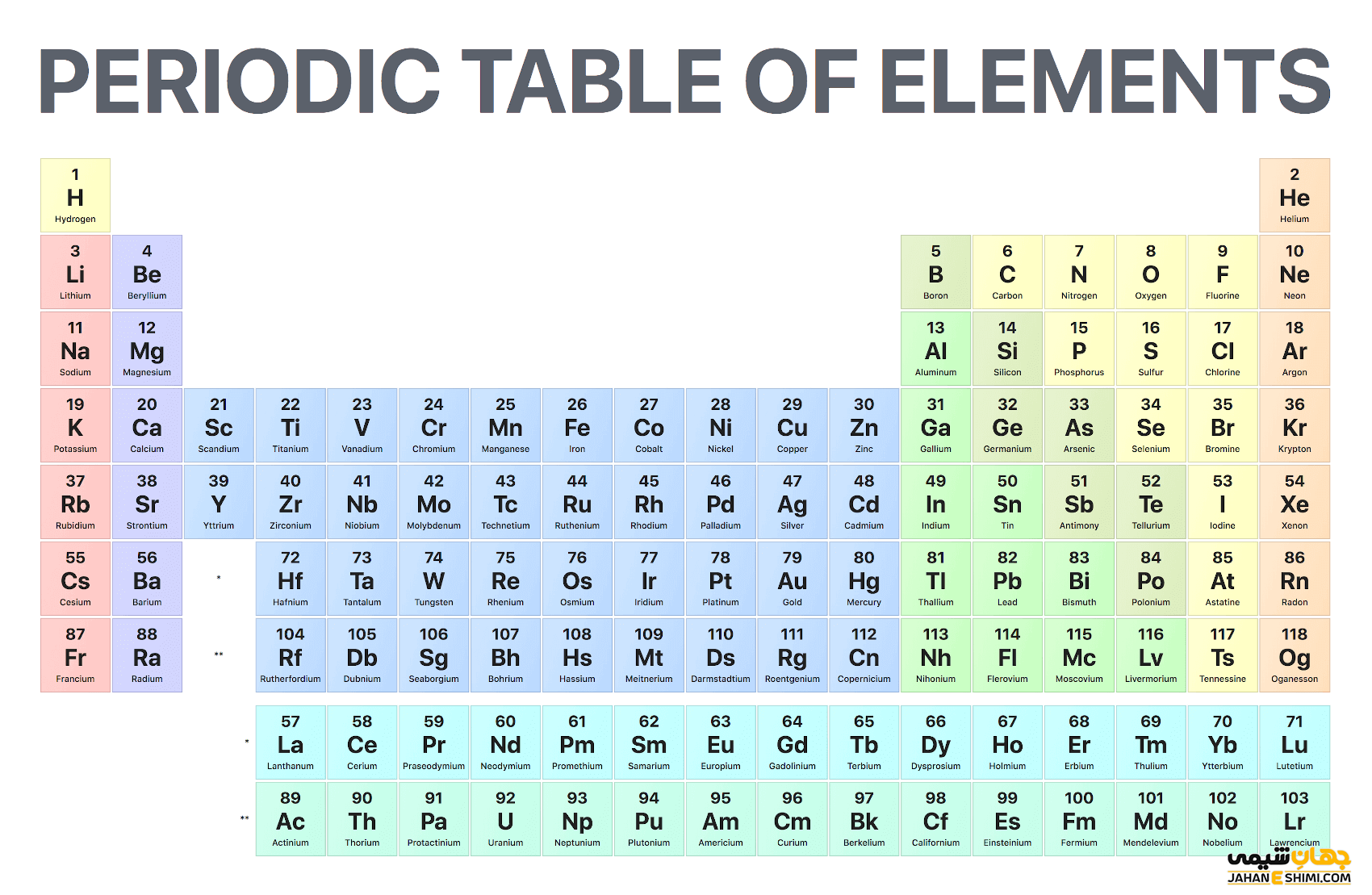
جدول تناوبی کامل عناصر یا جدول مندلیف جدولی است که در آن عناصر بر طبق عدد اتمی چیده شدهاند. جدول تناوبی کامل مهم ترین جدول در علم شیمی است. با استفاده از جدول تناوبی کامل عناصر دانشمندان موفق به حدس خواص عناصر هم گروه شدند. جدول تناوبی کامل از گروه ها و ردیف هایی تشکیل شده است. همچنین جدول تناوبی کامل عناصر شامل دسته بندی های مختلفی است. کشف اولیه جدول تناوبی کامل مربوط به قرن ۱۹ میلادی و مندلیف است. البته جدول تناوبی امروزی دستخوش تغییرات زیادی شده و درواقع کامل شده است. در ادامه این مطلب به بررسی کامل جدول تناوبی و نحوه استفاده از آن میپردازیم. با ما همراه باشید تا بیشتر با این جدول شگفت انگیز مندلیف آشنا شوید.
جدول تناوبی کامل چیست
در اواخر قرن نوزدهم شیمیدانی روسی به نام مندلیف تلاشهای خود را برای گروهبندی عناصر شیمیایی بر اساس جرم اتمی آغاز نمود. او نتایج دستاورد های خود را در مقالهای به چاپ رسانید. در زمان مندلیف تنها ۶۰ عنصر کشف شده بود. مندلیف متوجه شد، زمانی که عناصر بر اساس جرم مرتب شوند، عناصر در دورههای منظمی در کنار هم قرار خواهند گرفت. اکنون پس از گذشت ۱۵۰ سال، دانشمندان ۱۱۸ عنصر را کشف نمودند. حتی ۴ عنصر جدید تا سال ۲۰۱۶ کشف شد. این جدول یکی از مهمترین دستاورد های علم شیمی محسوب می شود.
ردیف یا دوره یا تناوب جدول تناوبی کامل عناصر
هر ردیف یا سطر از جدول بیانگر یک دوره یا تناوب است. عدد تناوب عناصر بیان میکنند که چه تعداد از سطوح انرژی دارای الکترون هستند. با حرکت از بالا به پایین جدول تناوبی کامل عناصر طول دورهها بیشتر میشوند. زیرا این عناصر الکترون بیشتری را برای پر کردن سطوح خارجی دریافت خواهند نمود.
عناصر در یک تناوب نسبت به عنصر قبلی خود یک پروتون و یک الکترون بیشتر دارند و این نشان میدهد که جدول مندلیف بر اساس افزایش عدد اتمی تنظیم گشته است. در این جدول عناصر در مقایسه با عنصر قبلی خود از خاصیت فلزی کمتر و الکترونگاتیوی بیشتری برخوردارند. جدول تناوبی کامل ۷ ردیف یا تناوب را شامل میشود. از چپ به راست در هر تناوب شعاع اتمی افزایش مییابد. این افزایش شعاع در هر تناوب موجب افزایش انرژی یونش و الکترونگاتیوی از چپ به راست می گردد.
ستون یا گروه جدول تناوبی کامل
ستون های جدول بیانگر گروهها هستند. عناصر موجود در یک گروه از جدول تناوبی کامل عناصر رفتاری مشابه به هم دارند. درواقع تعداد الکترون های یکسانی در بیرونی ترین لایه آن ها قرار دارد. گروه ۱۸ جدول تناوبی لایههای خارجی پرشده و کاملی از الکترون را شامل می شود. درست به همین دلیل عناصر آن گروه خیلی کم در واکنشهای شیمیایی شرکت خواهند نمود.
در هر گروه از بالا به پایین مقدار عدد اتمی عناصر افزایش می یابد. الکترونگاتیوی نیز در هر گروه از بالا به پایین کاهش خواهد یافت.
دسته های جدول تناوبی کامل
جدول تناوبی کامل به بلوک ها یا دسته هایی تقسیم شده است. هر بلوک بر اساس اوربیتال فرعی الکترون لایه آخر نامگذاری شده است. دو گروه اول جدول به همراه هیدروژن و هلیوم دسته s قرار دارند. گروههای ۱۳ تا ۱۸ در دسته p نامگذاری شده و دسته d نیز مربوط به گروههای ۳ تا ۱۲ می شود. درنهایت بلوک f حاوی لانتانیدها و اکتینیدهاست.
گاز های نجیب در جدول تناوبی کامل عناصر
گازهای نجیب در جدول تناوبی در آخرین گروه قرار دارند. گازهای نجیب بی رنگ، بی بو و بی اثر یا غیر واکنشپذیر هستند. عناصر این گروه از نظر آرایش الکترونی حالت پایدار هشت تایی دارند. بنابراین از لحاظ شیمیایی غیر فعال بوده و میل ترکیبی با عناصر دیگر ندارند. بنابراین به آنها گازهای بی اثر گفته می شود. این عناصر از نظر الکترونگاتیوی قدرت کمی داشته؛ اما در هر دوره بیشترین انرژی یونش را به خود اختصاص داده اند. این ترکیبات همگی به شکل گاز بوده و نقطه ذوب کمی هم دارند.
عناصر اصلی جدول تناوبی کدامند
عناصر خالص ترین شکل ماده هستند که فقط یک نوع اتم دارند. در مجموع ۱۱۸ عنصر تا به امروز یافت شده است. این عناصر به صورت جدولی و به ترتیب افزایش تعداد اتمی مرتب شده اند به طوری که عناصر با ویژگی های مشترک در کنار هم قرار گرفته اند. به این ترتیب جدولی عناصر، جدول تناوبی عناصر می گویند. در این مقاله ابتدا بیست عنصر با عدد اتمی ۱ تا ۲۰ را به همراه خواص آنها می آموزیم.
بیست عنصر اول جدول تناوبی به شرح زیر است: هیدروژن (H)، هلیم (He)، لیتیوم (Li)، بریلیم (Be)، بور (B)، کربن (C)، نیتروژن (N)، اکسیژن (O). فلوئور (F)، نئون (Ne)، سدیم (Na)، منیزیم (Mg)، آلومینیوم (Al)، سیلیکون (Si)، فسفر (P)، گوگرد (S)، کلر (Cl)، آرگون (Ar)، پتاسیم (K)، کلسیم (Ca).
عدد اتمی یک عنصر به ما در مورد تعداد پروتون در هسته اتم می گوید. پروتون گونه ای با بار مثبت است که در هسته عنصر یافت می شود. عدد اتمی عنصر برای هر عنصر منحصر به فرد است. این بدان معناست که تعداد پروتون ها در عناصر مختلف متفاوت است. ما اغلب گیج می شویم که عدد اتمی تعداد الکترون ها است اما اشتباه است. عدد اتمی یک عنصر برابر است با تعداد الکترون های یک عنصر فقط در حالت پایه. این به این دلیل است که عناصر می توانند برای پایداری خود الکترون از دست بدهند، به دست آورند یا به اشتراک بگذارند، اما نمی توانند پروتون را به اشتراک بگذارند. از این رو، عدد اتمی یک عنصر به ما در مورد تعداد پروتون های عنصر می گوید که در نهایت ویژگی منحصر به فرد هر عنصر را نشان می دهد.