گوگرد تری اکسید چیست؟ چه کاربردی دارد؟

تری اکسید گوگرد (SO3) یکی از مهمترین اکسیدهای گوگرد است، زیرا در ساخت اسید سولفوریک استفاده می شود. اغلب به آن “مهمترین اکسید گوگرد از نظر اقتصادی” می گویند.
تری اکسید گوگرد به عنوان یک معرف ضروری در واکنش های سولفوناسیون تعریف می شود. این فرآیندها رنگها، مواد دارویی و مواد شوینده را فراهم میکنند. تری اکسید گوگرد را می توان در محل از اسید سولفوریک تولید کرد یا می توان از آن به عنوان محلول در اسید استفاده کرد.
در ادامه با نشریه علمی جهان شیمی فیزیک همراه باشید تا با این اکسید پرکاربرد و مهم آشنا شوید.
اکسید های گوگرد
اکسیدهای گوگرد گروهی از مولکول های ساخته شده از اتم های گوگرد و اکسیژن هستند، مانند دی اکسید گوگرد (SO2) و تری اکسید گوگرد (SO3). اکسیدهای گوگرد آلاینده هایی هستند که به تشکیل باران اسیدی و همچنین آلودگی ذرات کمک می کنند. برخی از آنها توسط منابع طبیعی وارد جو زمین می شوند، اما بیشتر آنها نتیجه فعالیت های انسانی هستند.
برخی از اکسیدهای گوگرد گاز و برخی مایع یا ذرات جامد هستند. دی اکسید گوگرد خطرناک ترین اکسید گوگرد است. گازی بی رنگ است که بوی کبریت سوخته می دهد. تری اکسید گوگرد اغلب یک جامد بی رنگ یا سفید است که بخارهای سفید رنگی در هوا ایجاد می کند و واکنش های شدیدی با آب دارد.
دی اکسید گوگرد و تری اکسید گوگرد هر دو واکنش نشان می دهند و اسید سولفوریک را تشکیل می دهند که برای بافت زنده سمی است و جزء اصلی باران اسیدی است.
منابع اکسید گوگرد
آتشفشان ها منبع طبیعی اکسیدهای گوگرد در جو هستند، اما ۹۹ درصد از دی اکسید گوگرد موجود در جو از فعالیت های انسانی مانند سوزاندن زغال سنگ، نفت و گاز برای تولید برق و گرما به دست می آید.
هنگامی که زغال سنگ و نفت می سوزند، گوگرد موجود در آنها با اکسیژن موجود در هوا ترکیب می شود و اکسید گوگرد می سازد. فرآوری سنگ معدنی حاوی گوگرد و سوزاندن صنعتی سوخت های فسیلی نیز از منابع اکسید گوگرد در جو هستند.
اکسیدهای گوگرد به عنوان آلاینده
اکسیدهای گوگرد هوا را آلوده می کند. آنها برای ریه های شما مضر هستند و تنفس را دشوار می کنند. دی اکسید گوگرد ذرات گوگردی را تشکیل می دهد که اگر به طور منظم استنشاق شود می تواند باعث آسم و برونشیت شود.
بخارات تری اکسید گوگرد در صورت استنشاق سمی بوده و باعث سوختگی پوست و اندام ها می شود. اکسیدهای گوگرد همچنین با قطرات آب موجود در هوا ترکیب می شود و اسید سولفوریک را که بخشی از باران اسیدی است، می سازد.
باران اسیدی برای گیاهان و ماهی ها و سایر موجودات زنده مضر است. اکسیدهای گوگرد با مولکول های دیگر ترکیب می شوند و ذراتی را تشکیل می دهند که به آلودگی ذرات کمک می کنند و آسمانی مه آلود با کاهش دید ایجاد می کنند.
چهار نمایشی که شیمیدانان برای تری اکسید گوگرد استفاده می کنند. در مدل ها یک رنگ گوگردی و رنگ دیگر اکسیژن است.
استفاده از اکسیدهای گوگرد
سوخت ها حاوی اکسید گوگرد هستند، اما کاهش اخیر در میزان مجاز گوگرد در سوخت معمولی و گازوئیل، همراه با کنترل های شدیدتر بر آلایندگی خودروها، منجر به کاهش آلودگی اکسید گوگرد شده است.
دی اکسید گوگرد به عنوان نگهدارنده مواد غذایی به ویژه برای میوه های خشک استفاده می شود. همچنین به عنوان مبرد، ضد عفونی کننده و به عنوان یک عامل سفید کننده استفاده می شود. تری اکسید گوگرد برای تولید مواد شیمیایی و مواد منفجره استفاده می شود.
گوگرد تری اکسید چیست
تری اکسید گوگرد به عنوان یک ترکیب شیمیایی توصیف می شود. فرمول تری اکسید گوگرد به صورت SO3 ارائه می شود. تری اکسید گوگرد در تعدادی تغییرات موجود است که به شکل گونه های مولکولی و کریستالی متفاوت است. بی رنگ است و در شرایط محیطی بخارهای مایع در هوا ایجاد می کند.
همچنین یک عامل اکسید کننده قوی و یک ماده بسیار واکنش پذیر است و به عنوان یک خطر آتش سوزی عمل می کند. از نظر ترمودینامیکی، این یک ترکیب ناپایدار نسبت به دی اکسید سلنیوم است.
نام های دیگر تری اکسید گوگرد را می توان انیدرید سولفوریک نامید.

تهیه تری اکسید گوگرد
بیایید به تهیه تری اکسید گوگرد با استفاده از روش های مختلف به شرح زیر نگاه کنیم:
در جو
- اکسیداسیون مستقیم دی اکسید گوگرد SO2 برای تولید تری اکسید گوگرد SO3 امکان پذیر است و حتی در طبیعت نیز اتفاق می افتد، اما این یک فرآیند بسیار کند است که آن را از نظر تجاری کمتر امکان پذیر می کند.
SO2 + 1⁄۲O2 = SO3 ΔH=-198.4
واکنش فوق اتفاق می افتد، اما این بسیار کند پیش می رود.
در آزمایشگاه
- تری اکسید گوگرد در آزمایشگاه شیمیایی با استفاده از تجزیه در اثر حرارت دو مرحله ای ترکیب بی سولفات سدیم تهیه می شود. پیرسولفات سدیم به عنوان یک محصول میانی داده می شود:
- در کم آبی ۳۱۵ درجه سانتیگراد، واکنش شیمیایی به شرح زیر است:
۲ NaHSO4 → Na2S2O7 + H2O
- ترک خوردگی در دمای ۴۶۰ درجه سانتیگراد، واکنش را می توان به صورت زیر نشان داد:
Na2S2O7 → Na2SO4 + SO3
در مقابل، ترکیبات KHSO4 تحت واکنش مشابهی قرار نمی گیرند.
همچنین می توان آن را با افزودن اسید سولفوریک غلیظ به پنتوکسید فسفر تهیه کرد.
در صنعت
SO3 را می توان به صورت صنعتی با فرآیند تماس تهیه کرد. دی اکسید گوگرد، که به نوبه خود می تواند با سوزاندن پیریت آهن (یک سنگ معدن سولفید آهن) یا گوگرد تولید شود. پس از خالص شدن توسط رسوب الکترواستاتیک، ترکیب SO2 توسط اکسیژن اتمسفر در دمای بین ۴۰۰ تا ۶۰۰ درجه سانتیگراد روی یک کاتالیزور اکسید می شود.
یک کاتالیزور معمولی حاوی پنتوکسید وانادیم (V2O5) است که با اکسید پتاسیم K2O بر روی سیلیس یا پایه کیزلگور فعال می شود. همچنین، پلاتین بسیار خوب عمل می کند، اما بسیار گران تر است و به راحتی توسط ناخالصی ها مسموم می شود (که بی اثر می شود).
اکثر ترکیب تری اکسید گوگرد که به این ترتیب ساخته می شود به اسید سولفوریک تبدیل می شود، اما نه با افزودن مستقیم آب، که در آن غبار ریز تشکیل می دهد، بلکه با جذب در اسید سولفوریک غلیظ و رقیق شدن با آب اولئوم تشکیل شده. .
زمانی با حرارت دادن سولفات کلسیم با سیلیس به صورت صنعتی تولید می شد.

خواص شیمیایی تری اکسید گوگرد
هیدراتاسیون: این یکی از واکنش های مهم تری اکسید گوگرد است. ترکیب تری اکسید گوگرد با آب واکنش می دهد و اسید سولفوریک تولید می کند. معادله شیمیایی را می توان در زیر ارائه کرد.
SO3+H2O→H2SO4
به دلیل بخار شدید تری اکسید گوگرد گازی، اسید سولفوریک تازه تشکیل شده به صورت غبار است.
هیدروفلوراسیون: این همان هیدراتاسیون است، اما به جای آب HF به SO3 اضافه می شود که اسید فلوروسولفوریک را تشکیل می دهد.
SO3+HF→FSO3H3.
اکسیژن زدایی: SO3 با N2O5 واکنش داده و پیروسولفات نمک نیترونیوم را تشکیل می دهد.۲
SO3+N2O5→(NO2)2S2O74.
اکسیداسیون: اکسید کننده قوی است و ترکیباتی مانند کلرید گوگرد را به تیونیل کلرید اکسید می کند. SO3+SCl2→SOCl2+SO25.
تری اکسید گوگرد با هیدروکسید سدیم واکنش داده و هیدروژن سولفات سدیم را تشکیل می دهد.
SO3+NaOH→NaHSO46
اسید لوئیس: به دلیل ماهیت الکتروفیل SO3، همچنین یک اسید لوئیس قوی است و به آسانی با بازهای لوئیس واکنش می دهد، مانند پیریدین که با آن کمپلکس تشکیل می دهد، در مورد دی اکسان و تری متیل آمین نیز همین اتفاق می افتد.
موارد استفاده از تری اکسید گوگرد
این می تواند به عنوان یک عامل سفید کننده برای حذف پراکسید هیدروژن باقی مانده یا به عنوان یک عامل هضم کننده برای جداسازی خمیر از لیگنین استفاده شود.
ما می توانیم آن را به عنوان یک کاتالیزور در واکنش اکسیداسیون دی اکسید گوگرد به تری اکسید گوگرد استفاده کنیم.
مه های اسید معدنی قوی که حاوی اسید سولفوریک هستند، چه در صنعت و چه در تولید محصول تجاری استفاده می شود.
همچنین به عنوان یک معرف مهم در واکنش های سولفوناسیون استفاده می شود.
می توان از آن در ساخت دستگاه های انرژی خورشیدی و سلول های فوتوالکتریک استفاده کرد.
ساختار مولکولی و پیوند
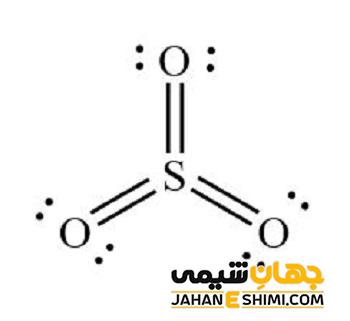
SO3، در شکل گازی خود، یک مولکول مسطح مثلثی با تقارن D3h است که به طور مشابه توسط نظریه VSEPR پیشبینی شده است. بنابراین، گفته می شود که SO3 متعلق به گروه نقطه D3h است.
در جنبه فرمالیسم شمارش الکترون، اتم گوگرد دارای حالت اکسیداسیون ۶+ و با بار رسمی ۰ است. ساختار لوئیس یک پیوند دوگانه S=O و دو پیوند داتیو S-O را بدون استفاده از اوربیتالهای d نگه میدارد. .
ممان دوقطبی الکتریکی تری اکسید گوگرد گازی صفر داده می شود. این نتیجه زاویه ۱۲۰ درجه بین پیوندهای S-O است.
هشدار های استفاده از گوگرد تری اکسید
تری اکسید گوگرد، در کنار اینکه یک عامل اکسید کننده قوی است، هم در هنگام بلع و هم در استنشاق سوختگی های جدی ایجاد می کند، زیرا ماهیت بسیار مرطوب و خورنده دارد.
ترکیبات SO3 باید با احتیاط زیاد مورد استفاده قرار گیرند زیرا به شدت با آب واکنش می دهد و همچنین اسید سولفوریک بسیار خورنده را تشکیل می دهد. همچنین، به دلیل ماهیت کم آبی قوی و توانایی آن در واکنش شدید با این گونه مواد، باید از مواد آلی دور نگه داشته شود.
این ماده شیمیایی دارای خطرات و عوارض است که در ادامه به آنها می پردازیم:
هشدارهای واکنشی
- عامل اکسید کننده قوی
- فعالیت کاتالیزوری شناخته شده
- واکنش دهنده به آب
واکنش های هوا و آب
با آب با نیروی انفجار ترکیب می شود و اسید سولفوریک را تشکیل می دهد. تری اکسید گوگرد بیشتر مواد آلی را جذب می کند. با قرار گرفتن در معرض هوا، رطوبت را به سرعت جذب می کند، بخارهای اسیدی سفید متراکم منتشر می کند.
خطر آتش سوزی
خطر آتش سوزی در تماس با مواد آلی. افزایش انفجاری در فشار بخار زمانی رخ می دهد که شکل آلفا ذوب شود. با آب با خشونت انفجاری ترکیب می شود و اسید سولفوریک را تشکیل می دهد. ممکن است سایر مواد قابل احتراق (چوب، کاغذ، روغن و غیره) را مشتعل کند.
گازهای سمی قابل اشتعال ممکن است در مخازن و ماشین های قیف جمع شوند. رواناب به فاضلاب ممکن است خطر آتش سوزی یا انفجار ایجاد کند. در تماس با آب اسید سولفوریک تشکیل می دهد. از آب و مواد آلی اجتناب کنید. در قرار گرفتن در معرض هوا، رطوبت را جذب کرده و بخارهای سفید متراکمی از خود ساطع می کند.
خطر سلامت
این ماده بسیار سمی است. این ماده تحریک کننده و خورنده غشاهای مخاطی است. در صورت استنشاق یا بلعیدن سمی است. تماس باعث سوختگی شدید پوست و چشم می شود.
کمک های اولیه
هشدار: تری اکسید گوگرد بسیار خورنده است. احتیاط توصیه می شود.
علائم و نشانه های قرار گرفتن در معرض تری اکسید گوگرد:
علائم و نشانه های مصرف حاد تری اکسید گوگرد ممکن است شدید باشد و شامل ترشح بزاق، تشنگی شدید، مشکل در بلع، لرز، درد و شوک باشد. سوختگی دهان، مری و معده شایع است. استفراغ عموماً ظاهری به شکل آسیاب قهوه دارد.
پتانسیل فروپاشی گردش خون پس از مصرف تری اکسید گوگرد زیاد است. قرار گرفتن حاد در معرض تری اکسید گوگرد استنشاقی ممکن است منجر به عطسه، گرفتگی صدا، سرفه، خفگی، لارنژیت و تحریک دستگاه تنفسی شود. خونریزی بینی و لثه، زخم مخاط بینی و دهان، برونشیت، ذات الریه، تنگی نفس، درد قفسه سینه و ادم ریوی و نارسایی تنفسی نیز ممکن است رخ دهد.
قرار گرفتن چشم در معرض این ماده شیمیایی ممکن است باعث تحریک، درد، تورم، فرسایش قرنیه و کوری شود. قرار گرفتن در معرض پوست ممکن است منجر به درماتیت (پوست قرمز، ملتهب)، سوختگی شدید و درد شود.

روش های اضطراری حمایت از زندگی
مواجهه حاد با تری اکسید گوگرد ممکن است نیاز به ضد عفونی و حمایت زندگی برای قربانیان داشته باشد. پرسنل اورژانس باید لباس محافظ متناسب با نوع و درجه آلودگی بپوشند. همچنین در صورت لزوم باید از تجهیزات تنفسی تصفیه کننده هوا یا هوای عرضه شده استفاده شود.
وسایل نقلیه نجات باید لوازمی مانند ورقه های پلاستیکی و کیسه های پلاستیکی یکبار مصرف را برای کمک به جلوگیری از گسترش آلودگی حمل کنند.
قرار گرفتن در معرض استنشاق
- قربانیان را به هوای تازه منتقل کنید. پرسنل اورژانس باید از قرار گرفتن در معرض تری اکسید گوگرد خودداری کنند.
- علائم حیاتی از جمله نبض و تعداد تنفس را ارزیابی کنید و هرگونه ضربه را یادداشت کنید. اگر نبض تشخیص داده نشد، CPR را انجام دهید. در صورت مشاهده عدم تنفس، نفس منصنوعی بدهید. در برخی موارد مشاهئه شده که تنفس مشکل دارد، در این صورت از اکسیژن یا سایر حمایت های تنفسی استفاده کنید.
- مجوز و/یا دستورالعمل های بیشتر را از بیمارستان محلی برای تجویز پادزهر یا انجام سایر روش های تهاجمی دریافت کنید.
- حمل و نقل به یک مرکز مراقبت های بهداشتی.
قرار گرفتن در معرض پوست یا چشم
- قربانیان را از قرار گرفتن در معرض. پرسنل اورژانس باید از قرار گرفتن در معرض تری اکسید گوگرد خودداری کنند.
- علائم حیاتی از جمله نبض و تعداد تنفس را ارزیابی کنید و هرگونه ضربه را یادداشت کنید. اگر نبض تشخیص داده نشد، CPR را انجام دهید. در صورت مشاهده عدم تنفس، نفس منصنوعی بدهید. در برخی موارد مشاهئه شده که تنفس مشکل دارد، در این صورت از اکسیژن یا سایر حمایت های تنفسی استفاده کنید.
- لباس های آلوده را در اسرع وقت خارج و جدا کنید.
- اگر قرار گرفتن در معرض چشم اتفاق افتاده است، چشم ها باید حداقل به مدت ۱۵ دقیقه با آب ولرم شسته شوند.
- نواحی در معرض پوست را به طور کامل با آب و صابون بشویید.
- مجوز و/یا دستورالعمل های بیشتر را از بیمارستان محلی برای تجویز پادزهر یا انجام سایر روش های تهاجمی دریافت کنید.
- حمل و نقل به یک مرکز مراقبت های بهداشتی.
قرار گرفتن در معرض بلع
- علائم حیاتی از جمله نبض و تعداد تنفس را ارزیابی کنید و هرگونه ضربه را یادداشت کنید. اگر نبض تشخیص داده نشد، CPR را انجام دهید. در صورت مشاهده عدم تنفس، نفس منصنوعی بدهید. در برخی موارد مشاهئه شده که تنفس مشکل دارد، در این صورت از اکسیژن یا سایر حمایت های تنفسی استفاده کنید.
- القای استفراغ یا تلاش برای خنثی کردن نکنید!
- دهان را با مقدار زیادی آب بشویید. به قربانیان اطلاع دهید که این آب را قورت ندهند.
- مجوز و/یا دستورالعمل های بیشتر را از بیمارستان محلی برای تجویز پادزهر یا انجام سایر روش های تهاجمی دریافت کنید.
- زغال فعال هیچ ارزشی ندارد.
- به قربانیان آب یا شیر بدهید: کودکان تا ۱ سال، ۱۲۵ میلی لیتر (۴ اونس یا ۱/۲ فنجان). کودکان ۱ تا ۱۲ ساله، ۲۰۰ میلی لیتر (۶ اونس یا ۳/۴ فنجان)؛ بزرگسالان، ۲۵۰ میلی لیتر (۸ اونس یا ۱ فنجان). فقط در صورت هوشیاری و هوشیاری قربانیان باید آب یا شیر داده شود.
- حمل و نقل به یک مرکز مراقبت های بهداشتی.
گوگرد تری اکسید اسید است یا باز
تری اکسید گوگرد یا SO3 یک ترکیب شیمیایی با فرمول SO3 است و به عنوان اسید شناخته می شود. تری اکسید گوگرد در اشکال مختلفی وجود دارد که هر کدام دارای گونه های مولکولی و ساختار کریستالی خاص خود هستند. این ترکیب به شکل مایع بی رنگ است و در محیط اطراف بخار منتشر می کند. این یک ماده شیمیایی بسیار واکنش پذیر است که همچنین یک اکسید کننده قوی و خطر آتش سوزی است. در مقایسه با دی اکسید سلنیوم، این یک مولکول ترمودینامیکی ناپایدار است.
این ماده به عنوان یک عامل سفید کننده برای خلاص شدن از شر پراکسید هیدروژن باقی مانده یا به عنوان یک عامل هضم کننده برای جدا کردن خمیر از لیگنین استفاده می شود. در اکسیداسیون دی اکسید گوگرد به تری اکسید گوگرد از آن به عنوان کاتالیزور استفاده می شود. این ترکیب یک پودر قوی اسید معدنی مبتنی بر اسید سولفوریک است که در صنعت و تولید محصولات تجاری استفاده می شود. در واکنش سولفوناسیون، یک معرف ضروری است.
سلول های فتوولتائیک و گجت های انرژی خورشیدی با این ماده ساخته می شوند. گوگرد را می توان دو بار به هر یک از سه اکسیژن متصل کرد. اتم گوگرد در وسط دارای بار رسمی صفر است، اما اکسیژن هایی که به آن متصل است بسیار الکترونگاتیو هستند (آنها به عنوان گراز الکترون شناخته می شوند)، بنابراین اتم گوگرد در وسط دارای یک بار جزئی به علاوه بر روی آن است. در نتیجه، الکترون ها را برای جبران می پذیرد.



















