زندگی نامه گیلبرت نیوتن لوئیس شیمیدان بزرگ

گیلبرت نیوتن لوئیس یکی از تأثیرگذارترین و تحسینشدهترین دانشمندان قرن بیستم، هم در شیمی و هم در فیزیک پیشگام بود.
کارهای مهم شیمی لوئیس شامل کشف پیوند کووالانسی و مفهوم جفت الکترون است. کارهای دیگر لوئیس مانند پیشنهاد ساختارهای نقطهای، نظریه پیوند ظرفیت و این آثار به شکلگیری نظریههای مدرن پیوند شیمیایی کمک کردند.
روش هایی که او انتخاب می کرد همیشه ساده و دقیق بود. او حوصله توضیحات غیر ضروری را نداشت و مانند سر همفری دیوی که یکی از قهرمانان او بود، دوست داشت با چند لوله آزمایش و مواد شیمیایی ساده به اکتشافات مهمی دست یابد. هنگامی که نقطه مورد بحث به نظر او به اندازه کافی بدجنس بود
با این حال، او در به کارگیری دستگاهی که به مهارت و ظرافت دستکاری نیاز دارد، تردیدی نداشت، مانند آزمایشی زیبا اما دشوار که با آن او و کالوین پارامغناطیس حالت سه گانه فسفری را نشان دادند.
او همیشه به ضرورت صرفه جویی در زمان در تحقیق واقف بود و از میان انبوه اندیشه های خود مراقب بود که آنهایی را انتخاب کند که سریع به هدف منتهی شود.
او به عنوان یک مرد روح بزرگی بود که الهامبخش او هرگز توسط کسانی که او را میشناختند و دوستش داشتند فراموش نخواهد شد. او یکی از آن دانشمندان کمیاب بود، مانند جی. تامسون و رادرفورد که معلمان بزرگ و رهبران یک مدرسه نیز هستند، به طوری که تأثیر آنها بر تعداد زیادی که از آنها الهام گرفته اند، چند برابر می شود.
در ادامه با نشریه علمی جهان شیمی فیزیک همراه باشید تا با این شیمیدان موثر در شیمی بیشتر آشنا شوید.
زندگی نامه گیلبرت نیوتن لوئیس
گیلبرت نیوتن لوئیس، در ۲۳ اکتبر سال ۱۸۷۵ در نزدیکی بوستون، در ویموث ماساچوست به دنیا آمد. خانواده او در سن ۹ سالگی در سال ۱۸۸۴ به نزدیکی لینکلن، نبراسکا نقل مکان کردند. جایی که تحصیلاتش، هرچند ناچیز، برای پذیرش او کافی بود. لوئیس جوانی خود را در لینکلن، گذراند و در ابتدا در خانه توسط والدینش آموزش دید، در سن ۱۳ سالگی وارد مدرسه مقدماتی دانشگاه نبراسکا در لینکلن شد
گیلبرت مدرسه مقدماتی خود را در دانشگاه نبراسکا در سال ۱۸۸۹گذراند و تا پایان سال دوم در آنجا ماند.

دانشگاه هاروارد
در سال ۱۸۹۳ به کالج هاروارد منتقل شد و پس از فارغ التحصیلی در سال ۱۸۹۶ و دریافت مدرک لیسانس خود در رشته شیمی، یک سال را در آکادمی فیلیپس در آندوور تدریس کرد.
سپس برای کار در مقطع کارشناسی ارشد و تکمیل مدارک، به هاروارد بازگشت و مدرک A.M (کارشناسی ارشد) را در سال ۱۸۹۸ و مدرک Ph.D. (دکتری) را در سال ۱۸۹۹، زیر نظر تئودور ریچاردز برای پایان نامه ای در مورد الکتروشیمی آمالگام های روی و کادمیوم کسب کرد.
پس از فارغ التحصیلی، لوئیس به مدت یک سال به عنوان مربی در هاروارد ماند، او با کمک هزینه تحصیلی برای انجام کار تکمیلی در آزمایشگاه، به خارج از کشور رفت و یک ترم با ویلهلم استوالد در لایپزیگ و یک ترم با والتر نرنست در گوتینگن آلمان گذراند. سه سال بعد را در هاروارد به عنوان مربی گذراند و سپس سمتی را به عنوان سرپرست وزن و سنجش در جزایر فیلیپین و شیمیدان در دفتر علوم در مانیل پذیرفت.
دانشگاه کالیفرنیا در برکلی
در سال ۱۹۰۵ لوئیس به هیئت علمی مؤسسه فناوری ماساچوست در کمبریج پیوست و در سال ۱۹۱۲ به عنوان رئیس دائم دانشکده شیمی و رئیس گروه شیمی در دانشگاه کالیفرنیا در برکلی منصوب شد و تا زمان مرگش در آنجا ماند.
اگرچه انتصاب او به عنوان رئیس در برکلی او را از تمام وظایف تدریس در کلاس خلاص کرد، اما لوئیس به دلیل اظهار نظرهای روشنگر و اغلب شوخآمیز خود در طول سمینارهای تحقیقاتی دانشجویان و کارکنان به خوبی شناخته شده بود.
عادات رفتاری گیلبرت نیوتن لوئیس
لوئیس، یک مکالمهگر درخشان، با حجم تقریباً نامحدود جوکها، و جوکهایی با استفاده از لغات و جناس نیز معتاد بود. او ترجیح میداد کتابها و مقالاتش را با دیکته کردن آنها به دستیاران و همکارانش بنویسد، و جملاتی که به دقت ساخته شده بود را در ذهنش کاملاً جمعآوری کرده بود. هنگام دیکته کردن، در حالی که سیگار وارداتی می کشید، اتاق را بالا و پایین می کرد – عادتی که در طول اقامتش در فیلیپین پیدا شد.
ازدواج گیلبرت نیوتن لوئیس
در سال ۱۹۱۲ لوئیس با مری هینکلی شلدون که دختر یکی از استاد های دانشگاه هاروارد بود ازدواج کرد که حاصل آن سه فرزند، یک دختر و دو پسر بود. دو پسر لوئیس و شلدون هردو استاد شیمی شدند.
تحقیقات علمی گیلبرت نیوتن لوئیس
نظریه ترمودینامیکی و کاربرد آن در شیمی، جداول انرژی آزاد، تعادل در واکنشهای متعدد، پتانسیل الکترودی عناصر مشترک، خواص محلولها و فعالیت یونها، ساختار اتم و مولکول و نظریه ظرفیت، سرعت واکنش های شیمیایی، آنتروپی عناصر، قانون سوم ترمودینامیک، اسیدها و بازهای اولیه و ثانویه، و رنگ و ساختار شیمیایی

تحقیقات نظامی گیلبرت نیوتن لوئیس
در سال ۱۹۱۷ او به عنوان سرگرد در سرویس گاز، بعداً سرویس جنگ شیمیایی، کمیسیون دریافت کرد و بلافاصله به فرانسه رفت و در آنجا پس از چند هفته کار در آزمایشگاه علمی، رئیس بخش دفاع این سرویس شد. او در اینجا تا پایان جنگ خدمت کرد، اما در دو ماه گذشته که در واشنگتن بود، به عنوان رئیس بخش آموزشی سرویس جنگ شیمیایی نیز خدمت کرد و به درجه سرهنگی ارتقا یافت.
او برای خدمات جنگی خود نشان صلیب لژیون افتخار را از دولت فرانسه و مدال خدمات برجسته را از کنگره ایالات متحده دریافت کرد.
خلاصه اقدامات گیلبرت نیوتن لوئیس
حوزه اصلی تحقیقات لوئیس حوزه ترمودینامیک شیمیایی بود. در سال ۱۸۹۹ هنوز شکاف بزرگی بین نظریه ترمودینامیکی و عمل وجود داشت. یک تئوری کامل از تعادل شیمیایی وجود داشت که ۲۰ سال قبل توسط فیزیکدان آمریکایی جوزیا ویلارد گیبس ارائه شد و نشان داد که تعادل شیمیایی توسط انرژی های آزاد مواد واکنش دهنده تعیین می شود.
اولین مقاله در رابطه با جرم و انرژی
تقریباً در سال ۱۹۰۲، لوئیس شروع به استفاده از نقاشیهای منتشر نشده اتمهای مکعبی در یادداشتهای سخنرانی خود کرد، که در آن گوشههای مکعب موقعیتهای احتمالی الکترون را نشان میداد.
او در سال ۱۹۰۸ اولین مقاله از چندین مقاله در مورد نسبیت را منتشر کرد که در آن رابطه جرم-انرژی را به روشی متفاوت از اشتقاق آلبرت انیشتین استخراج کرد.
پیوند کووالانسی
در سال ۱۹۱۶ لوئیس سرانجام مدل خود را در مقاله معروف (اتم و مولکول) خود منتشر کرد که پیوند شیمیایی کلاسیک را با اشتراک یک جفت الکترون بین دو اتم پیوندی برابر میدانست. او همچنین اصطلاح مولکول فرد (رادیکال آزاد) را زمانی که یک الکترون به اشتراک گذاشته نمی شود، تعریف کرد. او همچنین اطلاعاتی در مورد الکترون ها در جدول تناوبی عناصر اضافه کرد.
امروزه بیشتر دانشآموزان لوئیس را بهخاطر «نمودار نقطههای الکترونی» میشناسند، که او در این مقاله برای نمادی از ساختارهای الکترونیکی اتمها و مولکولها معرفی کرد. که اکنون به عنوان ساختارهای لوئیس شناخته می شوند، تقریباً در هر کتاب شیمی مقدماتی مورد بحث قرار می گیرند.
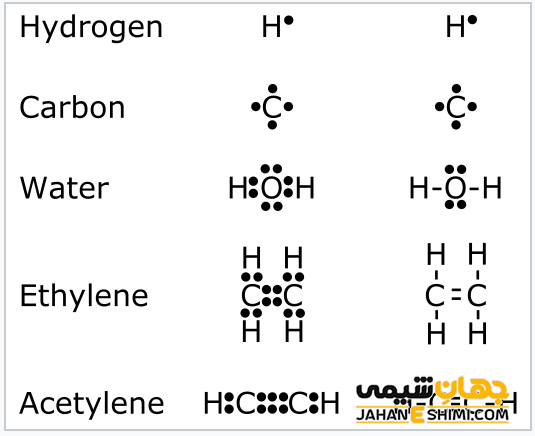
دانشمندان موثر در رواج بیشتر پیوند کووالانسی
او تا سال ۱۹۲۳ به موضوع پیوندهای شیمیایی بازنگشت. تجدید علاقه او به این موضوع تا حد زیادی توسط فعالیت های شیمیدان آمریکایی ایروینگ لانگمویر تحریک شد که بین سالهای ۱۹۱۹ و ۱۹۲۱ مدل لوئیس را رواج داد و به تفصیل پرداخت. بسیاری از اصطلاحات رایج مربوط به پیوند شیمیایی، مانند قانون کووالانسی و هشتگانه، در واقع توسط لانگمویر به جای لوئیس معرفی شدند.
در دهه ۱۹۲۰ شاهد پذیرش و استفاده سریع از مدل لوئیس از پیوند جفت الکترون در زمینههای شیمی آلی و هماهنگی بودیم. در شیمی آلی، این در درجه اول به دلیل تلاش شیمیدانان بریتانیایی آرتور لاپورث، رابرت رابینسون، توماس لوری و کریستوفر اینگولد بود.
در حالی که در شیمی هماهنگی، مدل پیوند لوئیس با تلاش شیمیدان آمریکایی موریس هاگینز و شیمیدان بریتانیایی نویل سیدگویک ترویج شد. اگرچه لوئیس گهگاه در طول دهه ۱۹۲۰ مدل پیوند خود را منتشر می کرد، اما پس از سال ۱۹۳۳ نوشتن در مورد این موضوع را متوقف کرد.
او وظیفه تطبیق مدل پیوندی خود با مکانیک کوانتومی جدیدتر اروین شرودینگر فیزیکدان اتریشی و ورنر هایزنبرگ فیزیکدان آلمانی را به دست شیمیدان آمریکایی لینوس پاولینگ واگذار کرد. پاولینگ آن را به مدل پیوند ظرفیت تبدیل کرد و آن را موضوع کتاب کلاسیک خود، ماهیت پیوند شیمیایی (۱۹۳۹) قرار داد.
نظریه اسید و باز
او در سال ۱۹۲۳ نظریه جفت الکترون واکنش های اسید-باز را فرموله کرد. در این نظریه جفت الکترون اسیدها و بازها، یک «اسید لوئیس» به عنوان گیرنده جفت الکترون و یک «باز لوئیس» به عنوان دهنده جفت الکترون در نظر گرفته می شود. لوئیس ۲۵ سال را صرف تعیین انرژی آزاد مواد مختلف کرد.
این نظریه در توضیح بسیاری از واکنشها مفید بود که طبقهبندی آنها دشوار بود. طبق این نظریه، نه تنها ترکیبات اهداکننده پروتون به عنوان اسیدها طبقه بندی می شوند. هر ترکیب یا یونی که بتواند یک جفت الکترون را برای تشکیل یک ترکیب جدید بپذیرد، اسید در نظر گرفته می شود.
سه سال بعد یعنی در سال ۱۹۲۶، او کتاب آناتومی علم را منتشر کرد که شامل سخنرانیهای سیلیمن در دانشگاه ییل بود. وی همچنین نویسنده ۱۴۰ مقاله علمی است.
لوئیس تقریباً همزمان با کارش بر روی نظریه اسید و باز، تحقیقات کلاسیک خود را در مورد حالت سه گانه و نقش آن در تعیین ماهیت فلورسانس، فسفرسانس و رنگ های آلی آغاز کرد که تا زمان مرگش ادامه یافت.
نظریه دوتریوم
لوئیس اولین کسی بود که با هیدروژن کار کرد و موفق شد نمونه ای از آب سنگین را تصفیه کند. او نمونه خالص اکسید دوتریوم (آب سنگین) را در سال ۱۹۳۳ تولید کرد و اولین کسی بود که بقا و رشد اشکال حیات را در آب سنگین مطالعه کرد. با شتاب دادن به دوترون ها در سیکلوترون ارنست و لارنس، توانست بسیاری از خواص هسته های اتم را مطالعه کند.

بررسی اکسیژن و شکست الکترولیت
در سال ۱۹۱۹، با مطالعه خواص مغناطیسی محلول های اکسیژن در نیتروژن مایع، دریافت که مولکول های O4 تشکیل شده است. این اولین شواهد برای اکسیژن چهار اتمی بود.
در سال ۱۹۲۱، لوئیس اولین کسی بود که معادله ای تجربی را ارائه کرد که در آن شکست الکترولیت های قوی در اطاعت از قانون عمل جرم، مشکلی که برای بیست سال شیمیدانان فیزیک را گیج کرده بود، توصیف کرد. معادلات تجربی او برای آنچه او قدرت یونی نامید بعداً تأیید شد که با معادله دبای-هاکل برای الکترولیتهای قوی مطابقت دارد.
کتاب ترمودینامیک و انرژی آزاد مواد شیمیایی
لوئیس برای تهیه این کتاب، مستلزم آن بود که یا مستقیماً مقادیر انرژی آزاد گمشده برای مواد شیمیایی را اندازه گیری کند یا داده های آنتالپی موجود را با مقادیر آنتروپی تکمیل کند، که امکان محاسبه آنها را فراهم می کند. دوم، همچنین لازم بود راهی برای بسط قوانین تجربی برای دربرگرفتن رفتار گازهای واقعی و محلول های غلیظ پیدا شود.
در تعقیب اولین مورد از این اهداف، لوئیس یک برنامه آزمایشی قوی را آغاز کرد که برای اندازه گیری مقادیر انرژی آزاد و آنتروپی از دست رفته طراحی شده بود. در تعقیب هدف دوم، او به طور متوالی مفاهیم فوگاسیته (۱۹۰۱)، ضریب فعالیت (۱۹۰۷) و قدرت یونی (۱۹۲۱؛ اندازه گیری میانگین برهمکنش های الکترواستاتیکی بین یون ها در یک محلول) را معرفی کرد.
این تلاش ها در سال ۱۹۲۳ با انتشار کتاب ترمودینامیک و انرژی آزاد مواد شیمیایی که با همکاری شیمیدان مرل رندال نوشته شد، به اوج خود رسید.

فوتون
لوئیس گهگاه مقالاتی را در مورد مسائل اساسی در فیزیک نظری منتشر می کرد. زمانی که هنوز دانشجوی هاروارد بود، فرض میکرد که نور میتواند بر ماده رقیق در فضای بیرونی فشار وارد کند، و بعداً در سال ۱۹۲۶ اصطلاح “فوتون” را برای کوچکترین واحد انرژی تابشی (نور) ابداع کرد.
این اصطلاح برای توصیف ذرات ذرهای تابش الکترومغناطیسی در فتوشیمی بکار برده می شود.
افتخارات گیلبرت نیوتن لوئیس
او مدارک افتخاری را از دانشگاه لیورپول، مادرید، شیکاگو، ویسکانسین و پنسیلوانیا دریافت کرده است و عضو افتخاری مؤسسه سلطنتی بریتانیای کبیر، انجمن شیمی لندن، و آکادمیهای ملی سوئد، دانمارک و هند است.
پروفسور لوئیس عضو آکادمی علوم و هنر آمریکا، عضو انجمن شیمی آمریکا، انجمن فلسفی آمریکا، انجمن فیزیک آمریکا، و عضو افتخاری موسسه فرانکلین است. او مدال نیکولز، مدال ویلارد گیبس، مدال دیوی از انجمن سلطنتی، مدال چهارم طلای انجمن هنر و علوم، مدال تئودور ویلیام ریچاردز (اعطا شده توسط بخش شمال شرقی انجمن شیمی آمریکا) اعطا شده است.
او در ژوئن ۱۹۳۹ مدال طلای آرنیوس توسط آکادمی سلطنتی علوم سوئد به او اعطا شد. به قول مختصر خودش که چند سال قبل از مرگش در ۲۳ مارس امسال نوشته بود، حرفه یکی از بزرگترین شیمیدانان آمریکایی بود.
جایزه نوبلی که حق او بود
یکی از معماهای بزرگ زندگی حرفه ای لوئیس عدم دریافت جایزه نوبل است. پیشنهاد شده است که او باید جایزه نوبل شیمی ۱۹۳۴ را با هارولد یوری آمریکایی به دلیل مشارکت در جداسازی و مطالعه دوتریوم و ترکیبات آن به اشتراک میگذاشت و اگر بیشتر عمر میکرد، مطمئناً جایزه نوبل ۱۹۵۴ را برای شیمی با پاولینگ به دلیل مشارکت او در تئوری پیوند شیمیایی به اشتراک میگذاشت.
او بیش از ۳۰ بار نامزد جایزه نوبل شیمی شد و هنوز هم بسیاری از دانشمندان بر این باورند که او سزاوار این جایزه بود.
مرگ گیلبرت نیوتون لوئیس
گیلبرت نیوتن لوئیس سر انجام در تاریخ ۲۳ مارس سال ۱۹۴۶ در سن ۷۰ سالگی به دلیل حمله قلبی هنگام کار در آزمایشگاهش درگذشت. گفته شده است که همیشه علاقه داشت که در حین کار از دنیا برود.
لوئیس در طول ۳۴ سال تصدی خود در برکلی موفق شد دپارتمان شیمی خود را به یکی از بهترین ها در ایالات متحده تبدیل کند.

سخن پایانی
نیم قرنی که با مرگ گیلبرت نیوتن لوئیس به پایان رسید، همیشه به عنوان یکی از درخشانترین قرنها در تاریخ اکتشافات علمی در نظر گرفته میشود و نام او در فهرست افرادی که آن را بزرگ کردهاند، در میان بالاترینها قرار میگیرد.
نظریه الکترون ظرفیت شیمیایی، پیشرفت ترمودینامیک شیمیایی، جداسازی ایزوتوپها که استفاده از دوترون را در تبدیل مصنوعی عناصر شیمیایی ممکن میسازد، کشف پدیدههای پیچیده جذب، فلورسانس و فسفرسانس مواد آلی. رنگها از جمله دستاوردهایی هستند که همیشه با نام او تداعی میشوند.
لوئیس با موفقیت های خودبه ترمودینامیک شیمیایی، فتوشیمی و جداسازی ایزوتوپ کمک بی شماری کرد.
از اینکه تا انتهای این مقاله همراه ما بودید از شما سپاسگزاریم.




















حیف از نوبلی که به دست این دانشمند لمس نشد…
درود. عکس دوم که گذاشته اید، کودکی اینشتین است، نه لوئیس.