
عنصر کروم از عناصر شیمیایی جدول تناوبی مندلیف است که کاربرد متنوعی دارد. نماد شیمیایی عنصر کروم در جدول تناوبی با Cr شناخته میشود. عدد اتمی عنصر کرم ۲۴ و عدد جرمی آن ۵۱.۹۹۶ است. این ماده در گروه ۶ و تناوب ۴ جدول تناوبی جای گرفته است. عنصر کروم از عناصر واسطه بشمار میآید. از خواص عنصر کروم میتوان به رنگ خاکستری و سطح براقش اشاره نمود. کاربرد عنصر کروم به دلیل مقاوت در مقابل خوردگی و سختی بالا صورت می پذیرد. از کاربرد و مزایا عنصر کروم میتوان به خواص ضدزنگ آن در آلیاژ ها اشاره کرد. ایزوتوپ عنصر کروم نیز شناخته شده و برای این عنصر ۳ ایزوتوپ طبیعی گزارش شده است. ترکیبات عنصر کروم نیز به دلیل خواص ویژه این عنصر کاربرد های متنوعی دارند. مدل اتمی بور برای عنصر کروم به شناخت بیشتر این ماده کمک میکند.
نشریه علمی جهان شیمی فیزیک به بررسی و معرفی عناصر جدول تناوبی و خواص آن ها پرداخته است. مانند : نیتروژن، اکسیژن، کربن، فلوئور و… . در ادامه با معرفی خواص و کاربرد عنصر کروم با ما همراه باشید.
پیشینه عنصر کروم
در سال ۱۷۶۱ ماده معدنی نارنجی قرمزی توسط یوهان گوتلوب لمن کشف شد. این دانشمند نام سرب قرمز سیبریایی را بر این ماده نهاد. البته این دانشمند به اشتباه آن را ترکیب سرب با آهن و سلنیوم تصور نمود. در حقیقت ماده معدنی کشف شده توسط این دانشمند کرومات سرب (PbCrO۴) بود.
سپس در سال ۱۷۷۰ سرب قرمز سیبریایی در همان مکانی که لمن مشاهده کرده بود، توسط پیتر سیمون پالاس مشاهده شد. این ماده خواص مفید زیادی داشت. از جمله خواص این ترکیب عنصر کروم کاربرد آن به عنوان رنگدانه در تولید رنگ بود. کاربرد و ویژگی این ترکیب به سرعت توسعه یافت.
در سال ۱۷۹۷ دانشمندی به نام نیکلاس لوئی واکلین نمونه هایی از سنگ معدن کروکوئیت را یافت. او موفق به تهیه اکسید کروم (CrO۳) گشت. اکسید کروم با مخلوط کردن کروکوئیت و اسید هیدرو کلریک ایجاد شد. واکلین در سال ۱۷۹۸ توانست با حرارت دادن این اکسید در کوره های زغالی کروم فلزی را تولید کند. او موفق به شناسایی مقدار کمی کروم در سنگ های قیمتی مانند یاقوت و زمرد نیز شد.
در دهه اول قرن نوزدهم از کروم بیشتر در رنگ ها استفاده میشد. اما امروزه بیشترین کاربرد عنصر کروم در آلیاژهای فلزی، در صنایع شیمیایی، مواد نسوز و صنایع پایه است.
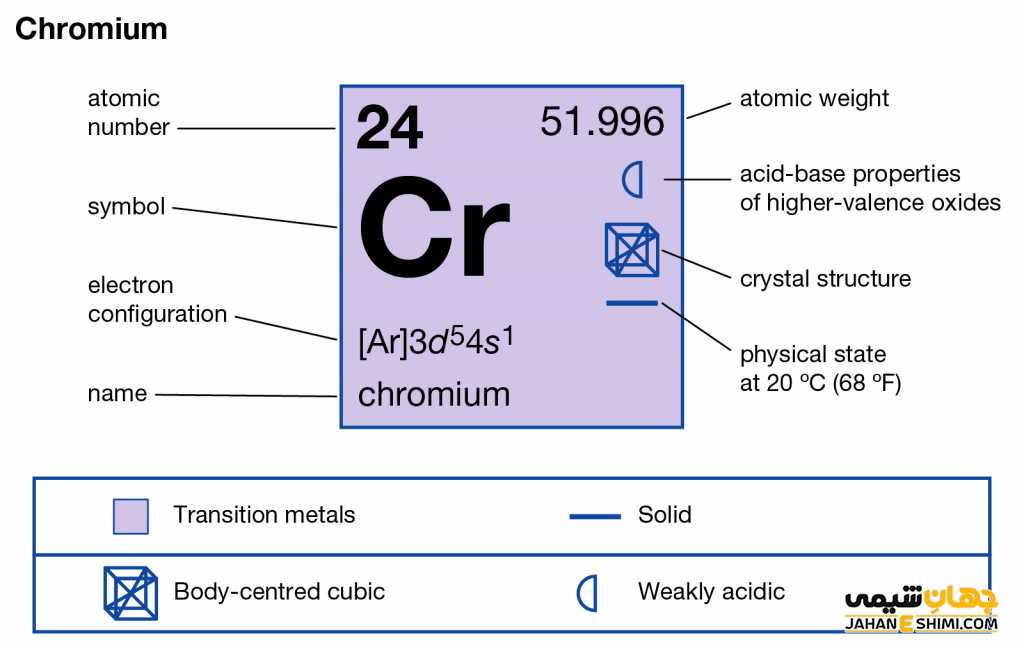
ویژگی عنصر کروم عنصر شماره ۲۴ جدول تناوبی عناصر
- نشان شیمیایی: Cr
- گروه: ۶
- دوره: ۴
- بلوک: بلوک-d
- چگالی: ۷.۱۹ g/cm۳
- فشار بخار: ۲۰-
- الکترونگاتیویته: ۱.۶۶ (مقیاس پائولینگ)
- حالت در شرایط STP: جامد
- دسته: فلزات واسطه
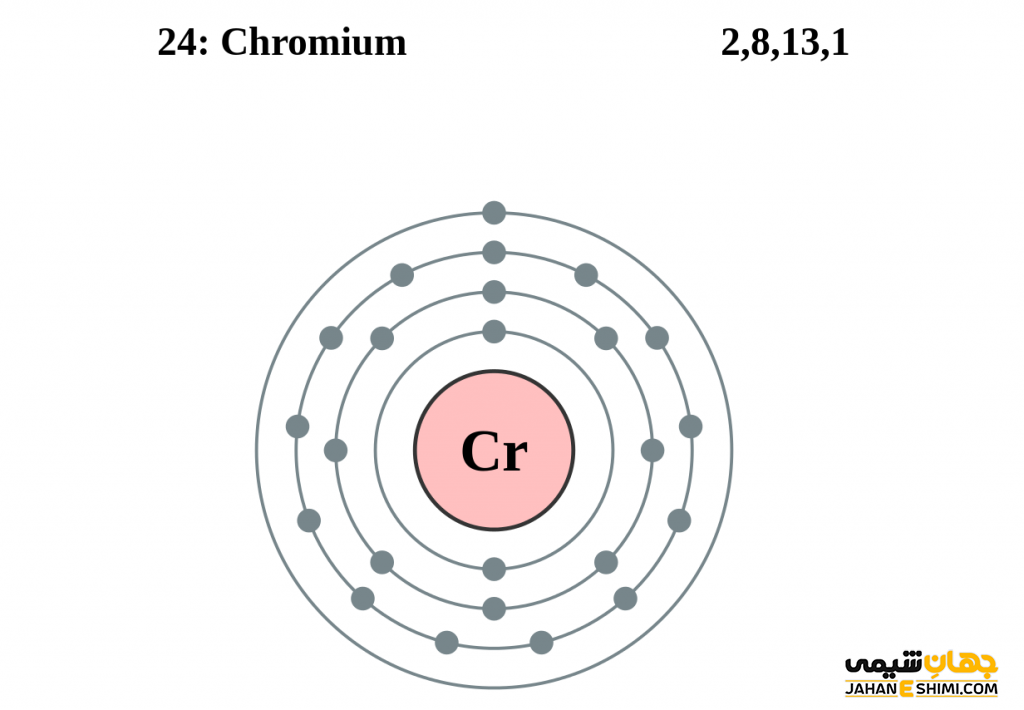
- آرایش الکترونی: ۴s۱ ۳d۵ [Ar]
- جرم مولی (گرم در مول): ۵۲
- دمای ذوب: ۱۹۰۷ درجه سانتی گراد
- دمای جوش: ۲۶۷۱ درجه سانتی گراد
- شعاع اتمی: ۱۲۸ pm
خواص عنصر کروم
عنصر کروم که در انگلیسی Chromium نامیده می شود فلزی سخت، براق و خاکستری رنگ است. عنصر کروم عنصر شماره ۲۴ جدول تناوبی فلزی بسیار جلا پذیر است. به سختی قابل جوش خوردن بوده و در برابر زنگ زدگی و سیاه شدن نیز مقاوم است. حالت های اکسیداسیون کروم ۲+ ،۳+ و ۶+ نسبت به بقیه فرم های اکسایش آن پایدار تر است. حالت اکسایش ۳+ پایدارترین حالت و حالت های ۴+ و ۵+ نسبتاً کمیاب می باشند. لازم به ذکر است که ترکیبات عنصر کروم اکسیدکننده هایی قوی در حالت اکسیداسیون ۶ هستند. برای شناخت بیشتر این ماده شگفت انگیز می توان به مدل اتمی بور برای عنصر کروم مراجعه نمود.
عنصر کروم در بدن
عنصر کروم از عناصر سه ظرفیتی فلزی بوده که مقدار کم آن در بدن بسیار ضروری است. این ماده برای سوخت و ساز کامل قند در بدن انسان به کار می رود. کمبود عنصر کروم در بدن بر توانایی انسولین در ثابت نگه داشتن میزان قند خون نیز موثر است. البته برای عنصر کروم عملکرد بیولوژیکی در متالوپروتئین مشاهده نشده است.
منابع عنصر کروم
سنگ معدن ساخته شده از ترکیبات کرومی کرومیت یا سنگ آهن کرومیت (FeCr۲O۴) است. در بسیاری از مواد معدنی دیگر به ویژه در کروکوئیت (PbCrO۴) نیز در مقادیر کم وجود دارد. استخراج کروم نیز مانند منگنز به دلیل وابستگی زیاد به اکسیژن از سنگ معدن آن مشکل است. اما کروم نیز می تواند با همان روش هایی انجام شود که با منگنز موفقیت آمیز بوده اند. امروزه مقادیر قابل توجهی از آلیاژ کروم با آهن به نام فروکرومیوم برای صنعت فولاد تولید می شود.
فراوانی عنصر کروم
- در خورشید ۰.۰۰۲٪
- در شهاب سنگ ها ۰.۳٪
- در پوسته زمین ۰.۰۱۴٪
- در اقیانوس ها ۶ × ۱۰-۸٪
- کروم در بدن انسان ۳ × ۱۰-۶٪
کاربرد عنصر کروم
- در متالوژی برای مقاوم کردن در مقابل پوسیدگی و براقیت
- کاربرد آن به عنوان یک جز در آلیاژ ها مانند در فولاد ضد زنگ
- کاربرد در آبکاری
- کاربرد در آلومینیوم آنادایز
- کاربرد به عنوان کاتالیزور
- کاربرد در ساخت قالب های پخت آجر
- کاربرد نمک کروم در سبز نمودن رنگ شیشه
- کرومات ها و اکسید ها در رنگ مو و رنگ های معمولی به کار می روند.
نکته
ترکیب دی کرومات پتاسیم یک معرف شیمیایی است. کاربرد این معرف در تمیز کردن ظروف شیشه ای آزمایشگاهی به عنوان یک عامل تیترات وجود دارد. این عنصر به صورت دندانه (عامل ثابت نگه دارنده) در رنگرزی کاربرد دارد.
در تولید نوار های مغناطیسی نیز دی اکسید کروم (CrO۲) کاربرد دارد. مقاومت مغناطیسی این نوار ها نسبت به نوار های اکسید آهن بیشتر بوده و بنابراین کارایی بهتری فراهم می شود.
فلز کروم میتواند بسیاری از فلزات دیگر را ضد زنگ کرده و از آن ها در برابر خوردگی و زنگ زدن محافظت نماید. این ویژگی عنصر کروم باعث شده تا آلیاژ های اصلی فولاد ضد زنگ یا استینلس استیل از کروم تشکیل شود.
کاربرد عنصر کروم در استیل
استفاده از خواص عنصر کروم در فولاد برای تولید استیل روز به روز کاربرد بیشتری پیدا می کند. امروزه نیاز مصرف کنندگان به فولاد ضد زنگ بیشتر شده است. بنابراین امروزه تولیدات بیشتری از بزرگ ترین تولید کنندگان فولاد دنیا صورت می پذیرد. کاربرد عنصر کروم در تولید استنلس استیل دلیلی بر تولید انواع لوله ها، ورق ها، نبشی و ناودانی، اتصالات و شیرآلات و انواع شمش ها وجود دارد.
کاربرد نبشی استنلس استیل
در ساختمان سازی به نبشی هایی نیاز است که بتوانند در برابر اکسیداسیون مقاوم باشند.
دوام بالا در عین ایجاد زیبایی و نمای مناسب وجود داشته باشد.
استحکام متریال با روکش کروم افزایش پیدا نموده و در برابر کشش و خمش نیز مقاوم می شود.
کاربرد نبشی استیل ساخته شده با کروم می تواند گزینه مناسبی باشد.
لوله استنلس استیل
کاربرد کروم در لوله های فولاد ضد زنگ می تواند نیازهای صنایع مختلف را برطرف نماید.
استفاده از این لوله ها در صنایع غذایی برای محافظت در برابر اکسیداسیون ها صورت میپذیرد.
کاربرد این ماده در شرکت های نفت و گاز برای مقابله با حرارت بالا صورت می گیرد.
کاربرد آلیاژ کرومیوم برای تولید مواد شوینده و برای مقابله با خورندگی های اسیدی در بسیاری از کارخانه ها صورت می پذیرد.
ترکیبات عنصر کروم
دی کرومات پتاسیم یک عامل اکسیدکننده بسیار قوی است. این ترکیب برای تمیز کردن ظروف آزمایشگاهی ارجحتر از سایرترکیبات آلی است.
اکسید کرومیک که همان اکسید کروم سبز (Cr۲O۳) است، در نقاشی لعابی و رنگ کردن شیشه مورد استفاده قرار می گیرد.
زردینه کروم (PbCrO۴) رنگدانه زرد درخشانی است که مورد استفاده نقاشان قرار می گیرد.
اسید کرومیک و اسید دی کرومیک در طبیعت یافت نمی شوند. اما آنیون های آن ها در ترکیبات متنوعی یافت می شود.
تری اکسید کروم CrO۳، اسید بدون آب اسید کرومیک به صورت تجاری به عنوان اسید کرومیک بفروش می رسد.
ایزوتوپ عنصر کروم
بهطور طبیعی عنصر کروم از ۳ ایزوتوپ پایدار تشکیل شده است. این ۳ ایزوتوپ ۵۲Cr، ۵۳Cr و ۵۴Cr است. فراوان ترین ایزوتوپ کروم ۵۲Cr با فراوانی طبیعی ۷۸۹/۸۳٪ است. برای این عنصر ۱۹ رادیو ایزوتوپ نیز شناخته شده است. پایدار ترین رادیو ایزوتوپ ۵۰Cr است. ۵۱Cr نیز با نیمه عمر ۷۰۲۵/۲۷ روز نیز دیگر رادیو ایزوتوپ پایدار کروم است. سایر ایزوتوپ های رادیو اکتیو این عنصر از نیمه عمری کمتر از ۲۴ ساعت برخوردارند. و درواقع نیمه عمر بیشتر آن ها کمتر از ۱ دقیقه است.
این عنصر دارای ۲ حالت برانگیخته نیز است. ۵۳Cr محصول فروپاشی پرتوزا ۵۳Mn است. محتویات ایزوتوپی عنصر کروم با محتویات ایزوتوپی منگنز ترکیب شده و در زمین شناسی ایزوتوپی کاربرد دارند. نسبت های ایزوتوپ Mn-Cr تایید کننده شواهد بدست آمده از ۲۶Al و ۱۰۷pd درباره تاریخ ابتدایی است.
لازم به ذکر است که ۵۳Cr دلایل بیشتری را درباره فرایند های نوکلئوسنتزی قبل از یکپارچگی منظومه شمسی در اختیار میگذارد. ایزوتوپ های کروم از نظر وزن اتمی، در بازه ۴۳ amu (کروم ۴۳) تا ۶۷ amu (کروم ۶۷) قرار دارند. حالت فروپاشی اتمی قبل از فراوان ترین ایزوتوپ پایدار کروم ۵۲، جذب الکترون است. حالت بعد از آن نیز کاهش بتا است.
تولید عنصر کروم
۲۸٫۸ میلیون تن سنگ معدن کرومیت قابل فروش در سال ۲۰۱۳ تولید و به ۷.۵ تن فروکروم تبدیل شده است. طبق تحقیقات فروکروم اصلی ترین کاربرد سنگ معدنی کرومیت است. تولید فولاد ضد زنگ نیز اصلی ترین کاربرد فروکروم است.
در سال ۲۰۱۹ بزرگ ترین تولیدکنندگان سنگ کروم به ترتیب آفریقای جنوبی (۳۹٪)، ترکیه (۲۳٪)، قزاقستان (۱۵٪) و هند (۹٪) بوده اند. ۱۴٪ باقی مانده تولید نیز مربوط به سایر کشورهاست.
فروکروم و کروم فلزی دو محصول اصلی تصفیه سنگ کروم هستند. فرآیند تولید این دو محصول تفاوت زیادی با هم دارد.
برای تولید فروکروم، سنگ معدن کرومیت (FeCr۲O۴) در مقیاس بزرگ در کوره قوس الکتریکی یا در کارخانه های ذوب کوچکتر، با آلومینیوم یا سیلیسیم در یک واکنش آلومینوترمی کاهش می یابد.

برای تولید کروم خالص، آهن باید در یک فرایند دو مرحله ای پخت و سنگ شویی از کروم جدا شود. سنگ معدن کرومیت با مخلوطی از کربنات کلسیم و کربنات سدیم در حضور هوا گرم شود. کروم اکسید شده و به کروم شش ظرفیتی تبدیل میشود. در حالی که آهن به شکل پایدار Fe۲O۳ تبدیل می گردد. سپس سنگ شویی در دمای بالاتر باعث حل شدن کرومات ها گردیده و اکسید آهن نا محلول باقی میماند.
کرومات توسط اسید سولفوریک به دی کرومات تبدیل میشود. دی کرومات با کاهش با کربن به اکسید کروم (III) تبدیل شده و سپس در واکنش آلومینوترمی به کروم کاهش می یابد.
هشدار مصرف عنصر کروم
به طور معمول فلز کروم و ترکیبات کروم (III) برای سلامتی خطری ندارند. اما در صورت بلع ترکیبات کروم VI می توانند سمی باشند. نصف قاشق چای خوری ترکیبات کروم سمی (VI) کشنده است. حتی مقادیر غیر کشنده کروم VI نیز سرطان زا است. بیشتر ترکیبات کروم VI برای چشم، پوست و بافت های مخاطی مضر است. تماس دائمی با این ترکیبات خطر ناک بوده و می تواند موجب آسیب های دائمی چشم گردد. در این موارد باید درمان کامل صورت پذیرد.
سازمان بهداشت جهانی (WHO) در سال ۱۹۵۸ حداکثر میزان مجاز مصرف کروم VI از جنبه سلامتی را ۰.۰۵ میلی گرم در لیتر آب آشامیدنی اعلام نموده کرد. البته این پیشنهاد بار ها بررسی شد. اما در این فاصله مقدار اعلام شده تغییری نکرد.
سخن آخر
در این مقاله از نشریه علمی جهان شیمی فیزیک به بررسی خواص و کاربرد عنصر کروم و ویژگی های فیزیکی و شیمیایی آن پرداخته شده است. عناصر جدول تناوبی به دلیل خواص متفاوتی که دارند می توانند کاربرد متنوعی در صنایع گوناگون داشته باشند. عناصر شیمیایی با توجه به خواص مختلفی که دارند در گروه ها و دوره های جدول مندلیف جای گرفته اند. معمولا عناصری که در یک گروه قرار دارند خواص مشابهی نیز دارند. با شناخت بیشتر و بهتر عناصر جدول تناوبی می توان به کاربرد و خواص آن ها بیشتر پی برد. دانشمندان همواره در تلاشند تا با شناخت بیشتر عناصر بتوانند به پیشرفت علم و فناوری کمک نمایند. با شناخت خواص عناصر و کاربرد آن ها زندگی راحت تر و آسان تری برای بشر فراهم خواهد شد.



















