سری الکتروشیمیایی چیست؟ – علامت قراردادی و کاربرد آن

یک سری الکتروشیمیایی یا سری فعالیت را نسبت به الکترود مرجع هیدروژن و بر اساس پتانسیل الکتروشیمیایی و بر حسب ولت مرتب می کنند. اندازه گیری سری الکتروشیمیایی در دمای ۲۵ درجه سانتی گراد، فشار یک اتمسفر و غلظت یک مولار صورت می گیرد. سری الکتروشیمیایی به صورت پتانسیل استاندارد الکترود (E°) که همان قدرت کاهندگی عنصر است، نشان داده می شود. این مقاله نشریه جهان شیمی فیزیک ما را با سری الکتروشیمایی آشنا می کند.
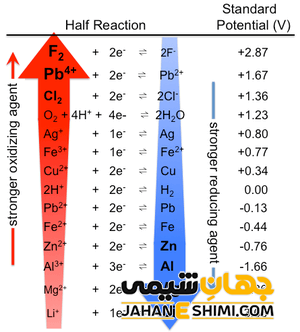
سری الکتروشیمیایی
فهرستی از پتانسیل استاندارد الکترود عناصر در جدولی تنظیم شده است که به نام سری الکتروشیمیایی نامیده می شود. پتانسیل های استاندارد الکترود که سری فعالیت نیز نامیده می شود، به صورت افزایشی و کاهشی در این جدول آورده شده است. مقدار عددی بزرگ پتانسیل استاندارد کاهشی در جدول نشان دهنده کاهش راحت تر عناصر است و این که این عناصر اکسنده بهتری هستند.
به عنوان مثال در مقایسه پتانسیل استاندارد کاهشی F۲ (۲,۸۷+) و Li+ (۳,۰۵-) می توان گفت که کاهش عنصر فلوئور به راحتی صورت گرفته و این عنصر یک اکسید کننده خوب است. اما لیتیم مثبت با مقدار پتانسیل استاندارد کاهش منفی و کم، کاهش سختی داشته و اکسنده خوبی نیست. در صورتی که این عنصر یک کاهنده خوب بوده و به راحتی اکسید می شود.
همچنین هر عنصری با مقدار پتانسیل استاندارد کاهشی که دارد، توسط عناصری می توان اکسید شود که پتانسیل استاندارد کاهشی بیشتری داشته باشد. به عنوان مثال Zn۲+ با مقدار پتانسیل استاندارد کاهشی ۰,۷۶- ولت، توسط عناصری که دارای پتانسیل استاندارد کاهشی بیشتر از این مقدار داشته باشند، اکسید می شود. کاهش این عنصر نیز توسط عناصری انجام می شود که مقدار پتانسیل استاندارد کاهشی کمتر از این مقدار داشته باشند.
نکات مهم درباره سری الکتروشیمیایی
همان طور که گفته شد، سری الکتروشیمیایی در یک جدولی برای عناصر تنظیم شده است. در سری الکتروشیمیایی باید به یک سری نکات توجه کرد.
در سری الکتروشیمیایی، پتانسیل استاندارد کاهشی عناصر نسبت به الکترود استاندارد هیدروژن اندازه گیری شده است. این عدد برای هر عنصر نشان دهنده توصیف تمایل آن عنصر به کاهش است.
وقتی مقدار پتانسیل استاندارد کاهشی یک عنصر بزرگتر باشد، نشان دهنده کاهش راحت تری آن عنصر بوده و در صورت کم بودن این مقدار، عنصر راحت تر اکسید می شود.
در سری الکتروشیمیایی عناصری با میزان الکترون دهندگی بهتر، دارای مقدار پتانسیل استاندارد کاهشی منفی بوده و محل قرارگیری این عناصر در پایین جدول مذکور است. اما در عوض عناصری با میزان الکتروفیلی بالا، مقدار پتانسیل استاندارد کاهشی مثبتی داشته و مکان قرارگیری آن ها در جدول نیز در قسمت بالا است.
عناصری که کاهنده بهتری هشتند، در این جدول دارای مقدار پتانسیل استاندارد کاهشی منفی بوده و پایین تر از هیدروژن در جدول قرار دارند.
اما عناصری که به عنوان کاهنده ای ضعیف عمل می کنند، مقدار پتانسیل استاندارد کاهش مثبتی داشته و در جدول سری الکتروشیمیایی جایگاه بالاتری از هیدروژن دارند.
اگر در جدول پتانسیل استاندارد کاهشی، از بالا به سمت پایین حرکت کنیم، به میزان قدرت کاهندگی عناصر افزوده شده و از قدرت عامل اکسید کننده ها کاسته می شود.
کاربرد سری الکتروشیمیایی
در سیستم های ردوکس (اکسایش – کاهشی) در علم زیست شناسی و بیوشیمی و محاسبات مربوط به آن ها از پتانسیل های الکترود استاندارد استفاده می شود. این گونه محاسبات مربوط به PH هستند. برای مقایسه میزان اکسندگی و کاهندگی در چنین سیستم هایی از روش استاندارد پتانسیل های الکترود آن ها در PH = 7 استفاده می شود. این پتانسیل ها به صورت E°۷ نشان داده می شوند.

نمونه هایی از سیستم های اکسایش – کاهشی که در بیوشیمی وجود دارند، می توان به فلاوین ها، پیروات – لاکتات، اگزالاستات – مالات و NAD-NADH اشاره کرد. سیتوکروم ها نیز به عنوان مثالی از این سیستم ها، برای راحتی انتقال الکترون ها عمل می کنند.
تشخیص و شناسایی کاهنده و اکسنده قوی
یکی از کاربردهای جدول سری الکتروشیمیایی، شناخت اکسید کننده ها و کاهش دهنده های خوب است. به عبارتی با این جدول می توان یک عامل کاهنده خوب و یا یک اکسید کننده خوب را به راحتی شناسایی کرد. بر این اساس، عناصر بالای جدول با مقدار پتانسیل کاهشی استاندارد به عنوان عوامل اکسید کننده خوب بوده ولی عناصری که در قسمت پایینی جدول قرار داشته و مقدار پتانسیل استاندارد کاهشی منفی دارند، به عنوان عوامل کاهنده خوب هستند. همان طور که در بالا مقایسه مربوط به دو عنصر فلوئور و لیتیم مثبت بررسی شد، نشان داده شد که F۲ یک اکسید کننده عالی و Li+ یک کاهنده عالی و قوی است.
کاربرد سری الکتروشیمیایی در محاسبه emf استاندارد پیل الکتروشیمیایی
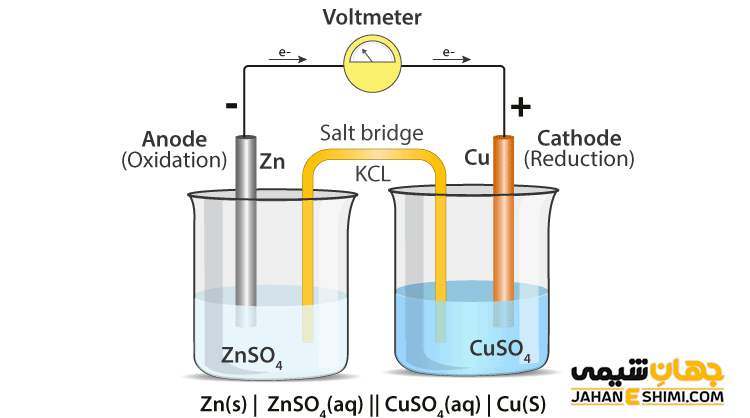
یک سلول الکتروشیمیایی وسیله ای است که با کمک آن می توان انرژی الکتریکی از واکنش های شیمیایی به دست آورد و یا برای آسان تر کردن واکنش های شیمیایی از انرژی الکتریکی تامین شده استفاده می کند. به عبارتی با این وسیله تبدیل انرژی شیمیایی به انرژی الکتریکی و یا برعکس آن انجام می شود. در فرایندهای مربوط به برقکافت، آبکاری فلزات و پالایش از این سلول ها استفاده می شود.
برای محاسبه نیروی الکتروموتوری یا emf استاندارد از جدول مذکور و اعداد مربوط به پتانسیل کاهش استاندارد استفاده می شود. در محاسبه این نیرو، پتانسیل کاهش استاندارد مربوط به دو نیم سلول با هم جمع می شود.
E°cell = E°red + E°ox
بر اساس استاندارد، پتانسیل کاهشی استاندارد برای پتانسیل اکسیداسیون استاندارد استفاده می شود.
پتانسیل کاهش استاندارد – = پتانسیل اکسیداسیون استاندارد
پیش بینی امکان سنجی واکنش اکسایش – کاهشی
یکی دیگر از کاربردهای جدول مربوط به سری الکتروشیمیایی، پیش بینی امکان انجام واکنش های ردوکس است. همان طور که می دانیم، واکنشی به طور خود به خودی انجام می شود که مقدار تغییر انرژی گیبس آن منفی باشد. رابطه بین انرژی آزاد گیبس با مقدار emf محاسبه شده به صورت زیر است.
∆G = nFE°
در این رابطه n تعداد الکترون مبادله شده، F ثابت فارادی و E° مقدار emf پیل را نشان می دهد.
اگر مقدار پتانسیل کاهشی استاندارد در یک سلول دارای مقداری مثبت باشد، تغییر انرژی آزاد گیبس منفی خواهد بود. با مثبت بودن مقدار E° و خود به خودی بودن واکنش، منبع انرژی الکتریکی بوده و یا الکتریسیته تولید می شود.
اما در صورت منفی بودن E°، واکنش به طور غیر خود به خودی بوده و برای این که بتواند انجام شود نیاز دارد که به آن انرژی وارد شود.
پیش بینی محصول الکترولیز
یکی دیگر از کاربردهای سری الکتروشیمیایی، در الکترولیز است. به عنوان مثال در فرایند الکترولیز که دو یا چند یون مثبت و منفی در محلولی وجود داشته باشد، یونی که به عنوان عامل اکسید کننده قوی تر است، مقدار پتانسیل کاهشی استاندارد بزرگتری داشته و در کاتد به آسانی رسوب می کند.
به عنوان مثال در فرایند الکترولیز محلول آبی نمک سدیم کلرید، یون هیدروژن مثبت در کاتد رسوب می کند. زیرا این یون پتانسیل کاهش استاندارد بالاتری نسبت به سدیم دارد. در این فرایند پتانسیل کاهشی استاندارد هیدروژن برابر صفر و پتانسیل کاهشی استاندارد یون سدیم مثبت، برابر با ۲,۷۱- است.
در این فرایند آنیونی که دارای مقدار پتانسیل کاهشی کمتری است در آند دچار اکسیداسیون می شود. بنابراین یون هیدروکسید منفی با مقدار پتانسیل کاهشی استاندارد برابر با ۰,۴۰ ولت در مقایسه با یون کلرید با پتانسیل کاهشی استاندارد ۱,۳۶ ولت، سریع تر اکسید می شود.
علامت قراردادی سری الکتروشیمیایی
دو روش آمریکایی و اروپایی به طور قراردادی برای علامت گذاری مقدار پتانسیل وجود دارد. روش آمریکایی همان قرارداد نرنست- لوئیس- لاتیمر و روش اروپایی، گیبس- استوالد- استکهلم است. با این که هر دو روش توسط آیوپاک تایید شده است، اما بیشتر روش دوم برای این منظور برای جلوگیری از ابهامات انتخاب شده است.
مقدار الکترود استاندارد در هر دو روش برای عنصر هیدروژن برابر صفر در نظر گرفته می شود. واکنش نیم پیل نیز در هر دو روش بر حسب قرارداد به صورت کاهشی نوشته می شود. بین این دو روش تفاوت مهم و اصلی وجود دارد که آن تغییر علامت E در موقع برعکس نوشتن واکنش است. در روش آمریکایی وقتی واکنش به صورت معکوش نوشته می شود، علامت مربوط به پتانسیل نیز معکوس می شود، اما در صورتی که در روش اروپایی به این صورت نخواهد بود.
الکتروشیمی چیست؟
دانش الکتروشیمی از پرکاربردترین آن ها بوده و می تواند نقش زیادی در زندگی داشته باشد. با استفاده از این دانش است که باتری های قابل حمل در موبایل، دوربین های دیجیتالی، لپ تاب، تبلت و ساعت های هوشمند استفاده می شود. در فرایندهایی مانند خوردگی در صنعت، تولید کلر، سدیم هیدروکسید و آلومینیوم نیز از علم الکتروشیمی استفاده می شود. در شیمی تجزیه از الکترودهایی استفاده می شود که برای تجزیه و آنالیز آلوده کننده ها در آب های طبیعی و یا وجود مقدارهای کمی مواد شیمیایی در خون، کاربرد دارد. برای ساخت این الکترودها از روش های الکتروشیمیایی استفاده می شود.
همچنین این دانش می تواند با توجه به این که علم تبادل انرژی شیمیایی و الکتریکی در واکنش های اکسایشی – کاهشی به کار می رود، تعریف شود. این واکنش ها به دو گروه خود به خودی و غیرخود به خودی تقسیم می شوند. واکنش های خود به خودی منجر به تولید جریان الکتریکی از واکنش شیمیایی می شود. واکنش غیر خود به خودی نیز با کمک جریان الکتریکی، واکنش شیمیایی انجام می گیرد.



















