
برای اندازه گیری جرم در مقیاس های بسیار کوچک مانند اتم و مولکول از یکای جرم اتمی استفاده شده و با (amu) نشان داده می شود. یکای جرم اتمی برابر با ۱۲/۱ جرم اتم کربن ۱۲ است. توجه شود جرمی که توسط یکای جرم اتمی (amu) بیان می شود مجموع جرم پروتون و نوترون هاست. درواقع از جرم الکترون ها به دلیل ناچیز بودن صرفه نظر شده است. یکای جرم اتمی برای آسان تر نمودن اندازه گیری جرم اتم ها به وجود آمده است. در ادامه این مقاله می خواهیم دلایل به وجود آمدن یکای جرم اتمی و نحوه کاربرد آن را بررسی نماییم. با ما همراه باشید تا با کاربرد یکای جرم اتمی (amu) آشنا شوید.
نشریه علمی جهان شیمی فیزیک قبلا به بررسی بسیاری از مفاهیم علم شیمی پرداخته است. مانند عدد اتمی، عدد جرمی، جدول مندلیف و… . در ادامه با بررسی ماهیت یکای جرم اتمی همراه ما باشید.
یکای جرم اتمی (amu)
اتمها جرم بسیار کمی دارند. امروزه دستگاه های جدید مانند طیف سنج جرمی اندازه گیری چنین جرمهایی را ممکن نموده است. اتم اکسیژن ۱۶، جرمی برابر با ۲۳– ۱۰ *۲.۶۶ گرم دارد. این عدد بسیار کوچک است و استفاده از آن راحت نیست. بنابراین با وجود دستگاه های جدید باز هم نیاز به واحد های بهتری برای اندازه گیری اتم وجود دارد. بنابراین یکای جرم اتمی با واحد amu به وجود آمد تا جرم اتم ها را بتوان ساده تر بیان نمود.
دانشمندان برای راحت شدن اندازه گیری، هسته اتم کربن ۱۲ را به عنوان مرجع استاندارد استفاده کردند. با این روش امکان مقایسه جرم اتم ها با هم امکان پذیر شد. یک اتم کربن ۱۲، جرمی معادل با ۱۲ یکای جرم اتمی داراست. این یکا با ۱۲amu نشان داده می شود. یکا جرم اتمی برابر با ۱٫۶۶ × ۲۷− ۱۰ است.
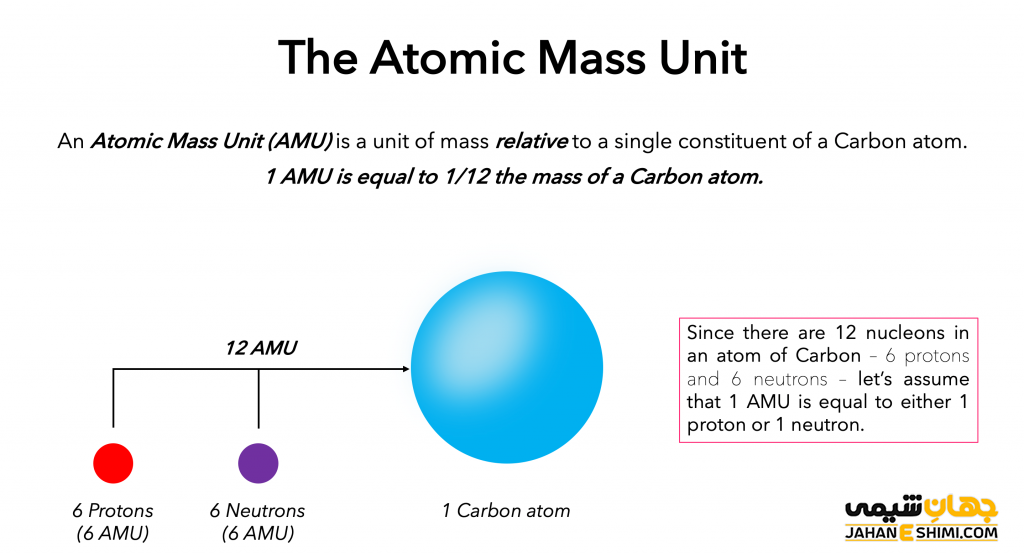
محاسبه جرم اتمی
جهت اندازه گیری جرم اتمی روش طیف سنجی جرمی به کار می رود. این روش شامل جداسازی یون های یک یا چند اتم بر پایه نسبت جرم به بار و اندازه گیری m/z و فراوانی یون ها در فاز گازی است. طیف سنجی جرمی به بررسی نسبت جرم به بار مولکولها می پردازد. این بررسی با استفاده از میدان های الکتریکی و مغناطیسی صورت می گیرد.
محاسبه جرم مولکولی
همان طور که جرم اتمی قابل محاسبه است، جرم مولکولی نیز قابل محاسبه است. برای محاسبه جرم مولکولی کافیست تا ترکیب شیمیایی مولکول شناخته شده باشد. با جمع کردن جرم اتمی اجزای تشکیل دهنده آن، جرم مولکولی ترکیب مورد نظر به دست می آید. برای مثال آب (با فرمول شیمیایی H۲O) از یک اتم اکسیژن با جرم اتمی ۱۶ و دو اتم هیدروژن با جرم اتمی ۱٫۰۰۸ تشکیل شده است.
پیشینه یکای جرم اتمی (amu)
دانشمندی به نام جان دالتون در سال ۱۸۰۳ روشی برای بیان جرم اتمی البته به صورت نسبی پیشنهاد کرد. دالتون برای بیان جرم اتمی پروتیوم را به کار برد. اما دانشمند دیگری به نام (Wilhelm Ostwald) به جای استفاده از هیدروژن، ۱۶/۱ جرم اکسیژن را پیشنهاد داد.
اما در سال ۱۹۲۹ با کشف ایزوتوپ های اکسیژن دیگر تعریف پیشنهادی استوالد با چالش روبه رو شد. برخی دانشمندان، یکای جرم اتمی را بر اساس ایزوتوپ اکسیژن ۱۶ بکار میگرفتند. برخی هم فراوانی طبیعی اکسیژن را مبنای کار قرار می دادند.
در نهایت در سال ۱۹۶۱ از اتم کربن ۱۲ به عنوان واحد جرم اتمی استفاده شد. این واحد جدید با نماد u نشان داده شد. درواقع u را جایگزین amu نمودند. برخی از دانشمندان برای یکای جرم اتمی نام (Dalton) را پیشنهاد کردند. اما استفاده از نمادهای u و Da به طور جهانی مورد قبول واقع نشد. دانشمندان زیادی واحد amu را مورد استفاده قرار دادند. آن ها در تعریف amu به جای اکسیژن ۱۶ از کربن ۱۲ استفاده نمودند. به طور کلی تمامی مقادیری که با علائم u، amu، AMU و Da معرفی می شوند، به یک عدد اشاره می کنند.
نحوه محاسبه یکای جرم اتمی
همان طور که گفته شد یکای جرم اتمی معادل با ۱/۱۲ جرم یک اتم کربن ۱۲ است. جرم ایزوتوپ هر عنصر نیز نسبت به جرم اتم کربن ۱۲ بیان می شود. اتم کربن ۱۲، ۶ پروتون و ۶ نوترون در هسته خود دارد. تقریبا کل جرم اتم را هسته اتم تشکیل میدهد. یک پروتون یا یک نوترون به تنهایی، دارای جرمی برابر با ۱amu خواهد بود. توجه شود که جرم اتم ها به صورت اعداد صحیح بیان نمی شود. زیرا به میزان بسیار کم جرم یک اتم از برهمکنش های ذرات با هسته متاثر می شود. البته این تاثیر میتواند حاصل جرم کم الکترونها نیز باشد.
آشنایی با اتم ها و مولکول ها و واحد های مختلف مرتبط با آن ها مثل مول، جرم مولی، حجم مولی، عدد اتمی، عدد جرمی و یکای جرم اتمی از جمله موارد ضروری در دنیای شیمی به شمار میآیند. بنابراین ما در نشریه علمی جهان شیمی فیزیک به بررسی این موارد پرداخته ایم. با ما همراه باشید.
آشنایی با جرم اتمی و عدد جرمی
عدد جرمی را با نماد A نشان می دهند. عدد جرمی به عنوان جرم اتمی یا عدد نوکلئون نامیده می شود. این عدد تعداد کل پروتون ها و نوترون ها در هسته اتم است. عدد جرمی تقریباً برابر با یکای جرم اتمی (amu) است. عدد جرمی بعد از نام عنصر و به شکل بالانویس در قسمت چپ نشان شیمیایی عناصر نوشته می شود. البته توجه شود که در ایزوتوپ های یک عنصر وضعیت متفاوتی حاکم است.
برای مثال عنصر هیدروژن دارای ۳ ایزوتوپ طبیعی به صورت ۱H، ۲H و ۳H دارد. برای هر یک از این ایزوتوپ ها نیز عدد جرمی متفاوتی ذکر شده است. ۱H شامل ۱ پروتون و عدد جرمی آن نیز برابر با ۱ است. ۲H یک پروتون و یک نوترون دارد، اما عدد جرمی آن برابر با ۲ خواهد بود. ۳Hیک پروتون و ۲ نوترون دارد و عدد جرمی آن برابر ۳ ذکر شده است. با ترکیب این ۳ ایزوتوپ H، جرم اتمی هیدروژن، برابر با ۱.۰۰۷۸۴ می باشد.

عدد اتمی و عدد جرمی
مشکلی که اغلب شیمی آموزان با آن رو به رو هستند، درک مفاهیمی همچون عدد اتمی و عدد جرمی است. برخی مواقع عدد اتمی با عدد جرمی اشتباه گرفته میشود. به مجموع پروتونها و نوترونها در یک اتم عدد جرمی گفته میشود. اما در عدد اتمی، تنها تعداد پروتونها مشخص شده است. به کمک عدد اتمی عنصر، محل آن در جدول مشخص میشود. یعنی میتوانیم بگوییم چندمین عنصر جدول تناوبی عناصر است.
تنها زمانی که مشغول بررسی ایزوتوپ پروتیم از هیدروژن باشیم عدد اتمی و عدد جرمی برابر خواهند بود. زیرا این ایزوتوپ تنها یک پروتون دارد. توجه نمایید که عدد اتمی هیچگاه تغییر نمیکند. اما با توجه به اینکه ایزوتوپ های مختلفی برای یک عنصر وجود دارند، عدد جرمی متفاوتی خواهیم داشت.
سخن آخر
استفاده از واحد های مختلف در شیمی و نحوه به کار گیری آن ها شاید در ابتدا مشکل باشد. اما با یادگیری درست این واحدها میتوان در مباحث پیشرفته علمی به موفقیت دست یافت. هر یک از تعاریف علم شیمی کاربرد ویژهای داشته و قسمتی از یادگیری را فرا میگیرد. یکاها و واحد های شیمی می توانند در ساده نمودن محاسبات به ما کمک کنند. همچنین در بسیاری از موارد تنها با دانستن تبدیل این واحد هاست که می توانیم واکنش های شیمیایی را انجام دهیم. در انجام واکنش های شیمیایی در بسیاری از مواقع مقدار مواد با مول بیان می شوند. یک شیمیست باید قادر باشد تا واحد مول را به گرم یا بر عکس تبدیل سازد. بنابراین شناخت واحد ها در شیمی از مهم ترین مسائل است که باید در یادگیری آن توجه ویژه ای شود.
نشریه جهان شیمی فیزیک به بررسی بسیاری از واحدها، واکنش ها و نکات مرتبط با شیمی پرداخته است. با مراجعه به این نشریه می توانید با دنیای شیمی و کاربرد هایش آشنا شوید.




















بسیار مطلب کاربردی و مفیدی بود