
عنصر ایندیم (Indium) با نماد شیمیایی In، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۴۹ می باشد. این عنصر در حقیقت چهل و نهمین عنصر از جدول تناوبی بوده که در گروه XIII و دوره پنجم جدول تناوبی قرار دارد. در واقع عنصر ایندیوم یک فلز نرم و به رنگ سفید- نقره ای و از عناصر گروه بور است. این فلز با عناصر بور (B)، آلومینیم (Al)، گالیم (Ga)، تالیم (Tl) و نیهونیوم (Nh)، در گروه سیزده یا گروه سه اصلی جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر ایندیوم پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تاریخچه کشف عنصر ایندیم
۲- پیدایش و منابع عنصر شماره ۴۹ جدول تناوبی
۳- ویژگی های فیزیکی و شیمیایی عنصر ایندیم
۴- ایزوتوپ های عنصر ایندیوم
۵- کاربرد های عنصر ایندیم
۶- ترکیبات عنصر ایندیم
۷- خطرات ایندیم بر روی سلامتی انسان
تاریخچه کشف عنصر ایندیم
برای نخستین بار در سال ۱۸۶۳ میلادی، دو شیمیدان آلمانی به نام های فردیناند رچ (Ferdinand Reich) و تئودور ریچر (Theodore Richter) توانستند عنصر ایندیوم را کشف و نامگذاری کنند. در واقع زمانیکه در جستجوی عنصر تالیم، با یک طیف نگار مشغول آزمایش بر روی کانی های روی بودند این عنصر را کشف کردند. آنها با مشاهده یک خط نیلی براق در طیف سنجی نمونه ها به وجود ایندیم پی بردند. در حقیقت کلمه ایندیوم از واژه یونانی (Indicum) به معنای رنگ نیلی گرفته شده است. این دو شیمیدان آلمانی تا جداسازی عنصر ایندیم در سال ۱۸۶۷ به فعالیت خود ادامه دادند.

پیدایش و منابع عنصر شماره ۴۹ جدول تناوبی
عنصر ایندیوم از کمترین مواد معدنی موجود در زمین محسوب می شود. این ماده در طبیعت به صورت آزاد پیدا شده است. اما آن را بیشتر می توان از ته مانده هایی که در طی فرآیند پردازش کانی روی بجا می ماند، تولید کرد. به علاوه در سنگ معدن آهن، سرب و مس نیز یافت می شود. لازم به ذکر است که ایندیوم از لحاظ فراوانی مثل نقره است. در حالیکه بسیار ساده تر از نقره بازیابی می شود. به طور کلی می توان گفت که عنصر ایندیوم به صورت تجاری به عنوان محصول جانبی تصفیه روی تولید می شود.

ویژگی های فیزیکی و شیمیایی عنصر ایندیم
فلز ایندیوم، بسیار نرم، چکش خوار و قابل انعطاف است. به عبارت دیگر، ایندیوم نرم ترین فلزی است که در دسته فلزات قلیایی قرار ندارد. این فلز با چاقو بریده می شود و سطح درخشانی دارد. همچنین به راحتی با ناخن خراشیده می شود و می تواند به هر شکلی خم شود. از لحاظ شیمیایی شبیه عناصر آلومینیوم و گالیوم است. در حالیکه از لحاظ ظاهری بیشتر شبیه عنصر روی می باشد. علاوه بر آن، این عنصر به راحتی ذوب می گردد. نقطه ذوب آن نسبت به عناصر گالیم و سدیم بیشتر است، اما نسبت به لیتیم و قلع کمتر می باشد.
این عنصر با آب واکنش نمی دهد. در حالیکه می تواند به وسیله اکسید کننده های قویتر مانند هالوژن ها اکسید شود. در این صورت ترکیبات ایندیوم (III) بدست می آید. خاصیت ویژه و غیرمعمول ایندیوم، اینست که حتی در دما های بسیار پایین، نرم و قابل کار باقی می ماند. لازم به ذکر است که اگر ایندیوم خالص باشد، در هنگام خم شدن، صدایی ممتد و زیر تولید می کند. ذکر این نکته خالی از لطف نیست که دو عنصر گالیم و ایندیم، توانایی خیس کردن شیشه را دارند.
جالب است بدانید که
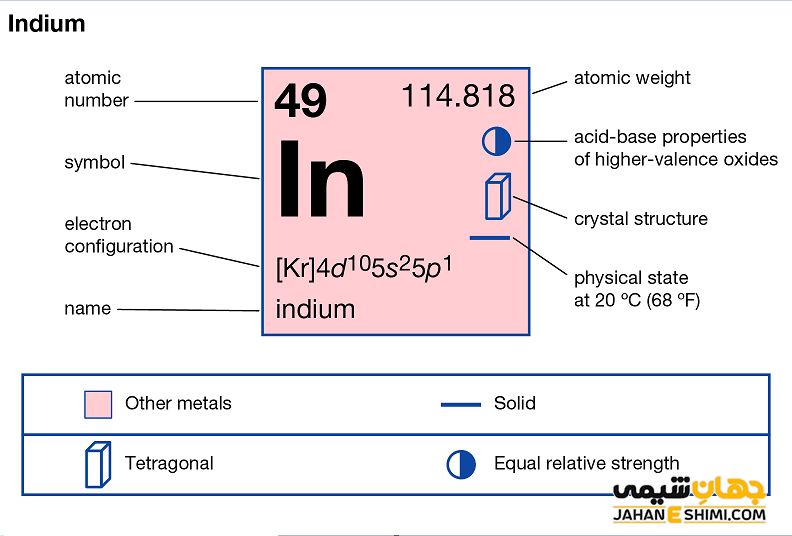
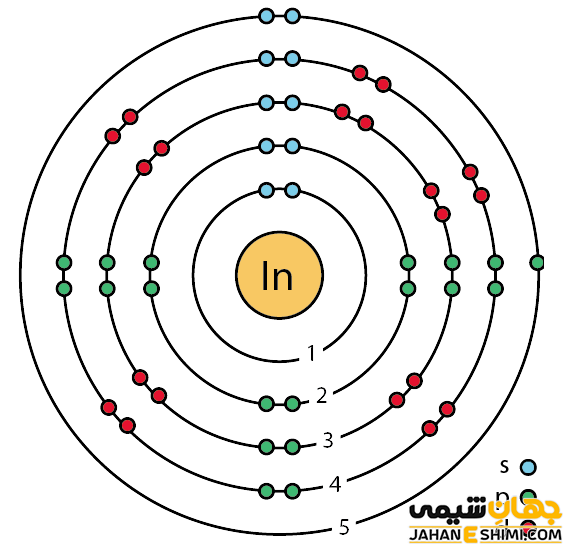
خصوصیات قابل توجه ایندیم از ساختار اتمی آن ([۳۶Kr] 4d۱۰۵s۲۵p۱) ناشی می شود. همانطور که مشخص است، اوربیتال p لایه آخر در این عنصر در حال پر شدن است. با توجه به آرایش الکترونی آن مشخص است که سه الکترون در دورترین لایه الکترونی ایندیم وجود دارد. بنابراین این عنصر دوست دارد که هر سه الکترون را از دست بدهد و به کاتیون ایندیوم(III) تبدیل شود. دقت داشته باشید که در بعضی حالت ها نیز می تواند فقط یک الکترون از دست دهد و در نتیجه به ایندیوم (I) تبدیل گردد. شکل های قابل دسترس آن معمولا به صورت شمش و گرانول است. از دیگر ویژگی های عنصر ایندیوم می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۱۵۶.۶ و ۲۰۷۲ درجه سانتی گراد است.
- عنصر ایندیم در هوا اکسید نمی شود. این عنصر حتی در مواجه با گرما نیز اکسید نمی شود.
- عنصر ایندیم دیا مغناطیس است.
- ساختار بلوری آن به شکل چهارگوشه (Centered Tetragonal)است.
- این عنصر آلوتروپ ندارد.
- جرم اتمی ایندیم برابر با ۱۱۴.۸۱۸ g/mol است.
- چگالی آن نیز برابر با ۷.۳۱ g/cm۳ می باشد.
- یون های ایندیم معمولا عدد اکسایش برابر با اعداد -۱، -۲، -۵، ۰، +۱، +۲ و +۳ دارند. در حقیقت یک اکسید آمفوتری محسوب می شود. اعداد اکسایش ۰ و +۳ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۵۵۸.۳ kJ/mol است.
ایزوتوپ های عنصر ایندیوم
همانطور که می دانید، ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر ایندیوم ایزوتوپ های فراوانی دارد. ایندیومی که در طبیعت وجود دارد دارای دو ایزوتوپ ۱۱۵In (95.71 %) و ۱۱۳In (4.29 %) می باشد. دقت داشته باشید که فقط ایزوتوپ ۱۱۳In پایدار است. علاوه بر آن، ۳۹ ایزوتوپ ناپایدار ایندیوم نیز شناخته شده است. عدد جرمی این ایزوتوپ ها از ۹۷ تا ۱۳۵ گزارش شده است. در جدول زیر نیمه عمر تعدادی از ایزوتوپ های رادیواکتیو را مشاهده می کنید.
| نیمه عمر | ایزوتوپ |
| ۲/۸ روز | ۱۱۱In |
| ۱/۷ ساعت | ۱۱۳Inm |
| ۱/۲ دقیقه | ۱۱۴In |
| ۶۵/۵ روز | ۱۱۴Inm |
| ۴/۵ ساعت | ۱۱۵Inm |
| ۱۴/۱ ثانیه | ۱۱۶In |
| ۵۴/۲ دقیقه | ۱۱۶Inm |
| ۴۴ دقیقه | ۱۱۷In |
| ۱/۹ ساعت | ۱۱۷Inm |
کاربرد های عنصر ایندیم
عنصر ایندیم کاربرد های بسیار زیادی در صنایع مختلف از جمله تهیه آلیاژ ها، لحیم ها و همچنین علم الکترونیک دارد. اما توجه داشته باشید که امروزه به دلیل بالا بودن قیمت آن، از بسیاری از این کاربرد ها صرف نظر شده است. در ادامه مقاله به بررسی کاربرد های عمده ایندیوم می پردازیم. همانطور که بیان شد، این فلز در دما های بسیار پایین به شکل غیر معمولی نرم و همچنین قابل انعطاف باقی می ماند. این خصوصیت جهت استفاده در ابزار های مورد نیاز در شرایط بسیار سرد همچون پمپ های برودتی و سیستم با خلا بالا بکار می رود. عنصر ایندیم همچنین در صنعت جواهر سازی، به منظور ایجاد سختی، ایجاد جلا و شفافیت نیز کاربرد دارد. خاصیت منحصر به فرد دیگر ایندیوم، چسبندگی زیاد است که به عنوان لحیم (در صنعت لحیم کاری) بسیار مفید و کاربردی است.
عنصر ایندیم به شکل اکسید قلع ایندیوم (ITO)، یکی از ترکیبات شیمیایی بسیار مهم است که در نمایشگر های LCD عالی عمل می کند. در واقع ITO، یک ترکیب سه تایی در نسبت های مختلف از عناصر ایندیم، قلع و اکسیژن می باشد. این LCD ها اجزایی کلیدی در کامپیوتر های لپ تاپ، مانیتور ها و تلویزیون های مسطح می باشند. آنها همچنین در صفحات خورشیدی، صفحات لمسی، تلفن های همراه، دستیار های شخصی دیجیتال، ساعت های دیواری و مچی، دوربین های دیجیتال، گیرنده های جی پی اس، منشی های تلفن و دیگر وسایل الکترونیکی بکار می روند .از جمله خصوصیات ITO می توان به اینکه شفاف است، محکم به شیشه می چسبد، برق را هدایت می کند، در برابر خوردگی مقاومت است، از نظر شیمیایی و مکانیکی پایدار است، اشاره کرد. به عبارت دیگر، بیشترین میزان مصرف ایندیوم جهت تولید جهانی نمایشگر های LCD است.

جالب است بدانید که
ایندیوم اغلب برای ساخت آلياژ کاربرد دارد. مقدار کمی از فلز ایندیم می تواند تفاوت فاحشی در خصوصیات یک آلیاژ ایجاد نماید. به همین دلیل از ایندیم با نام ویتامین فلزی یاد می شود. مثلا، اضافه کردن مقدار کمی ایندیوم به آلیاژ های طلا و پلاتین، می تواند آنها را بسیار سخت تر کند. به علاوه، این عنصر به منظور ساخت آلیاژ هایی با نقطه ذوب پایین نیز کاربرد دارد. به عنوان نمونه، آلیاژی از ایندیم و قلع و یا آلیاژ ۷۶ درصد گالیم و ۲۴ درصد ایندیوم در دمای اتاق به شکل مایع است. آلیاژ ایندیم- ژرمانیم در ساخت ترانزیستور ها مورد استفاده قرار می گیرد. همچنین در ساخت دستگاه های الکترونیک و اجزای الکتریکی دیگر همچون رکتیفایر، مقاومت های گرمایی و رسانا های نوری نیز بکار می رود.
از طرفی دیگر، فیوز های ساخته شده از آلیاژ های ایندیوم به صورت گسترده در سیستم های آژیر خطر آتش استفاده می شوند. بعضی از قطعات هواپیما نیز از آلیاژ ایندیوم ساخته می شود. در این صورت از اکسید شدن و یا فرسودگی آنها جلوگیری می شود. برای پوشش دادن یاتاقان های موتور های پر سرعت و سایر سطوح فلزی نیز از آلیاژهای ایندیوم استفاده می شود. در واقع ایندیم به توزیع روغن روانکار در این یاتاقان ها کمک می کند.
علاوه بر آن، ایندیم در ساخت آیینه هایی که مثل آیینه های نقره اندود شفافیت دارند، نیز استفاده می شود. آیینه های ایندیمی بسیار دیرتر از آیینه های نقره ای، کدر و تار می شوند. در برابر فرسایش نیز مقاومت بیشتری دارند. زیرا ایندیوم در معرض هوا بر خلاف نقره از جلا نمی افتد. از طرفی دیگر، از مقدار کمی از این عنصر جهت ساخت عوامل ضد بخار برای جلوگیری از میعان بر روی پنجره هواپیما و لوکوکوتیو بهره می برند.
کاربرد های جالب ایندیوم
عنصر ایندیم در پزشکی نیز کاربرد دارد. به عنوان مثال، انسان ها از ایندیوم در مکمل ها به منظور افزایش انرژی، افزایش تولید هورمون، جلوگیری از پیری، تقویت سیستم ایمنی بدن و افزایش جذب مواد مغذی استفاده می کنند. پزشکان حتی گاهی اوقات، ترکیبی از ایندیوم را از طریق تزریق درون رگ، به عنوان یک روش درمانی برای سرطان هایی که به استخوان رسیده اند، استفاده می کنند. علاوه بر آن، می توان از ایندیوم و رادیو ایزوتوپ ۱۱۱ آن، به منظور تعیین محل تومور های بدخیم و همچنین درمان تومور ها استفاده نمود. از دیگر کاربرد های ایندیوم می توان به موارد زیر اشاره کرد.

- صنایع نیمه هادی مانند ترموکوپل ها (وسایل اندازهگیری اختلاف درجه حرارت)
- ساخت یکسو کننده (دستگاهی که جریان متناوب را به جریان مستقیم تبدیل می کند)
- ساخت ترمیستور (مقاومت الکتریکی وابسته به دما)
- ساخت هادی نوری (دستگاهی که هنگامی در معرض نور قرار بگیرد، رسانایی الکتریکی خود را افزایش می دهد) و نور رسان ها
- ساخت ترانزیستور های سرعت بالا
- ساخت آشکارساز های مادون قرمز و آشکارساز های تابشی
- ساخت تلسکوپ ها، نورافکن ها و آلات انعکاس نور
- مهر و موم های فلزی نرم
- استفاده به عنوان روکش فلزات
- تولید پوشش های رسانایی شفاف از اکسید قلع
- الکترونیک و ابزار های فتوولتائیک
- انواع لامپ ها
- جوشکاری آلیاژ ها با نقطه ذوب پائین
- جایگزین جیوه در باتری های قلیایی
- آمالگام دندان
- میله های کنترل کننده در راکتور های هسته ای
- استفاده در پوشش شیشه ها (پنجره هواپیما ها، پنجره ساختمان های پر اهمیت، در یخچال ها، در فر ها)
- ساخت لایه های نازک روغن کاری شده
ترکیبات عنصر ایندیم
همانطور که بیان شد اکسید ایندیوم یکی از ترکیبات کاربردی فلز ایندیوم است. این فلز همچنین می تواند به راحتی با هالوژن ها و گوگرد واکنش دهد و در نتیجه هالید ها و سولفید تولید نماید. از دیگر ترکیبات آن می توان به موارد زیر اشاره کرد.
- اکسید ایندیم (III) (In۲O۳)
- برمید ایندیم(I) (InBr)
- برمید ایندیم(III) (InBr۳)
- کلرید ایندیم (III) (InCl۳)
- فلوئورید ایندیم (III) (InF۳)
- نیترید ایندیم (InN)
- ایندیم فسفید (InP)
- آرسنید ایندیم (InAs)
- ایندیم آنتیمونید (InSb)
- هیدرید ایندیم (InH۳)
- سولفید ایندیم (III) (In۲S۳)
- سلنید ایندیم (III) (In۲Se۳)
- تلورید ایندیم (III) (In۲Te۳)
- سولفات ایندیم (III) (In۲(SO۴)۳)
- تری متیل ایندیم (InC۳H۹)
- سیکلو پنتا دی انیل ایندیوم (I) (C۵H۵In)
- هیدروکسید ایندیم (In(OH)۳)

خطرات ایندیم بر روی سلامتی انسان
خوشبختانه مردم به ندرت در زندگی روزمره با ترکیبات ایندیوم مواجه می شوند. دقت داشته باشید که مدارک تایید نشده ای برای سمی بودن ایندیم وجود دارد. در واقع این عنصر برای بسیاری از قسمت های مختلف بدن سمی است. به بیان دیگر، ترکیبات ایندیوم می توانند به قلب، کلیه و کبد آسیب جدی برسانند و به احتمال زیاد تراتوژنیک هستند. همچنین اگر ایندیوم خورده شود، بسیار خطرناک است. به ویژه در زمان بارداری و یا شیردهی، مصرف آن از طریق دهان یا به صورت وریدی خطرناک است. لازم به ذکر است که اثرات ایندیوم بر روی نوزادان متولد نشده یا شیرخوار هنوز نا شناخته است، اما سمی بودن ایندیوم محرز می باشد.
عنصر شماره ۴۹ جدول تناوبی در هیچ ارگانیسم زنده ای نقش متابولیکی ندارد. همانند نمک های آلومینیوم، یون های ایندیم (III) نیز می توانند در هنگام تزریق برای کلیه ها سمی باشند. علاوه بر آن، اکسید قلع ایندیم و فسفید ایندیوم، می توانند به سیستم ریوی و یا سیستم ایمنی بدن آسیب بزنند (بیشتر از طریق ایندیوم یونی). اما توجه داشته باشید که در صنایع جوشکاری و نیمه هادی ها، که در آنها مقدار مواجهه با عنصر ایندیم بسیار زیاد است، هیچ شواهدی در مورد اثرات جانبی و مسمومیت گزارش نشده است. از آنجاییکه درباره اثرات منفی این ماده بر روی سلامتی انسان، اطلاعات بسیار اندکی موجود است، پس باید مراقب بود.




















