انرژی فعالسازی (اکتیواسیون) چیست؟ – تعریف و اهمیت آن

برای این که در یک سیستم شیمیایی و یا هسته ای، یک واکنش شیمیایی از ترکیب واکنش دهنده ها بتواند انجام شود، باید به آن انرژی وارد شود که به آن، انرژی فعالسازی (اکتیواسیون) گفته می شود. نمادی که انرژی فعالسازی را با آن نشان می دهند، Ea است. انرژی فعالسازی (اکتیواسیون) را با واحدهای ژول، کیلوژول بر مول و یا کیلوکالری بر مول نشان می دهند. این مقاله نشریه جهان شیمی فیزیک، ما را با مفهوم انرژی فعالسازی آشنا می کند.
اهمیت انرژی فعالسازی (اکتیواسیون) در واکنش ها
قرار داشتن یک سنگ در بالای کوه، از نظر ترمودینامیکی نشان دهنده ناپایدار بودن آن است. اما اگر سنگ از بالای کوه سقوط کند، به حالت پایدار می رسد. توضیح پایداری ترمودینامیکی با استفاده از دو پارامتر انرژی و آنتروپی است. همه سیستم ها دوست دارند که به سمت موقعیتی پیش روند که انرژی کمتری را متحمل شده و آنتروپی بیشتری داشته باشند. افتادن سنگ از بالای کوه، باعث کاهش انرژی آن و رسیدن به حالت پایدار می شود. ولی طبق اصل بقای انرژی، انرژی کاسته شده از بین نمی رود. بلکه با تبدیل شدن به گرما به قسمت دیگری از زمین منتقل می شود.
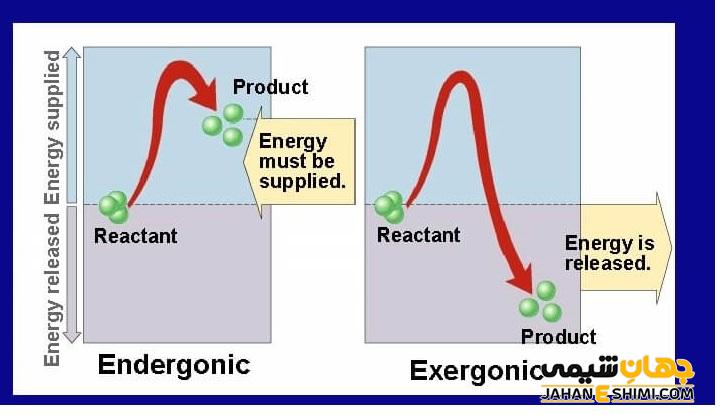
با در نظر گرفتن قوانین ترمودینامیک، واکنش های زیادی در محیط چون از بین رفتن کوه ها، تبدیل شدن گرافیت به الماس، ترکیب شدن مواد سوختنی چون چوب با اکسیژن و … باید انجام شوند. اما نکته ای که باید توجه کرد، سینتیک و سرعت انجام این واکنش هاست. ترمودینامیک در مورد سینتیک شیمیایی واکنش های مختلف و زمان وقوع آن ها، چیزی برای گفتن ندارد. عامل مهمی که در تعیین سرعت واکنش ها حائز اهمیت است، انرژی فعالسازی (اکتیواسیون) است.
مفهوم انرژی فعالسازی (اکتیواسیون)
تمام واکنش هایی که در بالا به آن ها اشاره شد، دارای یک سد انرژی هستند که سرعت انجام آن ها را آهسته می کند. پیشرفت واکنش ها، با بزرگتر بودن سد انرژی گفته شده، کند و سرعت انجام آن ها آهسته تر می شود. وجود همین سد انرژی به نام انرژی فعالسازی، باعث می شود که بدن ما با اکسیژن ترکیب نشده و به خاکستر تبدیل نشود. برای بار اول شیمیدان سوئدی به نام آرنیوس بود که انرژی فعالسازی را معرفی کرد.
با بیان مفهوم سد انرژی گفته شده، پس سنگی که در بالای کوه وجود دارد برای این که بتواند سقوط کند، نیاز به عبور از سد انرژی خود دارد. انرژی که به سنگ وارد می شود تا سقوط کند، به نام انرژی اکتیواسیون نامیده می شود. این انرژی را می توان با هل دادن سنگ و یا زلزله هایی که اتفاق می افتد، به سنگ داد.
پس برای تبدیل گرافیت به الماس نیز نیاز به انرژی فعالسازی و اکتیواسیون است. اما میزان انرژی فعالسازی مورد نیاز برای این فرآیند بسیار زیاد است، به همین دلیل واکنش به کندی و با هزینه بالا قابل انجام خواهد بود. کاتالیزورها موادی هستند که می توانند به کاهش انرژی فعالسازی پرداخته و سرعت انجام واکنش ها را بالا ببرند.
انرژی فعالسازی چیست؟
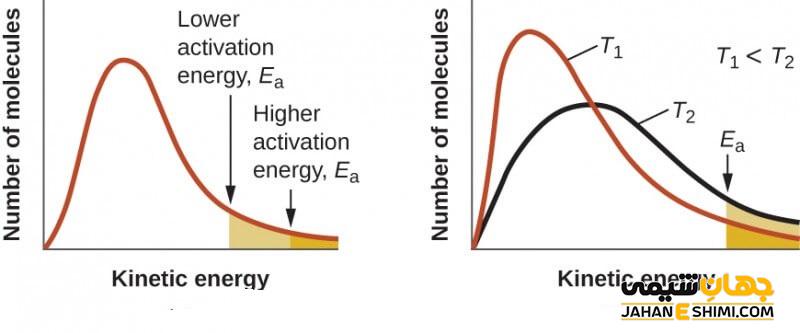
انرژی حداقلی که در هر مولکولی وجود دارد، به شکل انرژی جنبشی و یا پتانسیل است. انجام واکنش های شیمیایی در نتیجه برخورد مولکول ها به هم انجام می شود که موجب خمش، کشش و یا شکست پیوندها می شود. در صورتی این واکنش ها می تواند انجام شود که در درجه اول، مولکول ها با انرژی کافی به هم برخورد کنند و در درجه دوم، برخورد آن ها در جهتی مناسب باشد. در غیر این صورت، مولکول ها با دفع یکدیگر، مانع انجام واکنش می شوند. میزان انرژی جنبشی برای انجام واکنش باید از حداقل مقدار انرژی مورد نیاز، بیشتر باشد تا این اتفاق بیفتد. به مقدار حداقل انرژی مورد نیاز برای انجام یک واکنش شیمیایی، انرژی فعالسازی (اکتیواسیون) می گویند.
به عنوان مثال برای این که جسمی به قله برسد، باید دارای سرعت مناسبی باشد. برای داشتن این سرعت مناسب، انرژی جنبشی مناسبی لازم است. پس برای این که یک واکنش شیمیایی انجام شود، برای شکستن پیوندهای آن ها، نیاز به انرژی فعالسازی مناسب است.
نشان دادن انرژی فعالسازی در نمودار
با توجه به نمودار پیشرفت یک واکنش شیمیایی، به اختلاف انرژی که بین مواد واکنش دهنده و کمپلکس فعال وجود دارد، انرژی فعالسازی (اکتیواسیون) می گویند. به اختلاف انرژی مذکور، حالت گذار می گویند که در یک سیستم به عنوان بیشترین حالت انرژی، تعریف می شود. زمانی یک واکنش انجام می شود که انرژی آن بیشتر از انرژی حالت گذار باشد و برخورد مولکول ها در جهتی مناسب باشد. اما هر چه میزان انرژی فعالسازی در یک واکنش شیمیایی بیشتر باشد، انجام آن با سختی بیشتری انجام می شود. نمونه ای از انرژی فعالسازی، ۱۰ میلیون درجه حرارت مورد نیاز برای جوش دادن هسته ای هیدروژن ها و تبدیل آن به هلیم است.

تاثیر کاتالیزور و آنزیم ها بر انرژی فعالسازی
برای این که یک واکنش شیمیایی با سرعت بیشتری انجام شود، نیاز به کاهش انرژی فعالسازی مورد نیاز است. چون در این صورت به انرژی کمتری نیاز است تا حالت گذار و کمپلکس فعال تشکیل شود. برای رسیدن به انرژی فعالسازی کمتر، می توان از کاتالیزور استفاده کرد. یکی از این کاتالیزورها در واکنش های زیستی، آنزیم ها هستند.
تاثیر آنزیم ها و کاتالیزورها در انجام واکنش های شیمیایی، در هر دو مسیر رفت و برگشت است. چون مقدار انرژی لازم برای برخورد مولکول ها به هم، در صورت استفاده از کاتالیزورها، کاهش پیدا می کند پس میزان ثابت سرعت واکنش (k) و در نهایت سرعت انجام واکنش افزایش پیدا می کند. آنزیم ها به عنوان پروتئین ها و یا مولکول های RNA ی هستند سرعت واکنش ها را بالا می برند. آنزیم ها این کار را از طریق کاهش انرژی اکتیواسیون با اتصال خود به سوبسترا، انجام می دهند. با آنزیم ها، مسیر انجام واکنش به طور کامل تغییر پیدا می کند.
معادله آرنیوس
رابطه ی بین انرژی فعالسازی یک واکنش شیمیایی و آهنگ پیشرفت آن با استفاده از یک رابطه کمی به نام معادله آرنیوس بیان می شود. طبق این رابطه می توان انرژی فعالسازی را محاسبه کرد.

در این رابطه، A ضریب ثابت واکنش یا ضریب آرنیوس، R ثابت جهانی گازها، T دمای مطلق بر حسب کلوین، k ضریب سرعت واکنش و Ea انرژی فعالسازی (اکتیواسیون) واکنش است. طبق این رابطه، وقتی دما افزایش پیدا می کند انرژی جنبشی زیاد می شود بنابراین تعداد بیشتری از مولکول ها می توانند بر حداقل انرژی غلبه کنند.
در موارد پیشرفته تر می توان از معادله آرنیوس استفاده کرد تا نشان داده شود که سرعت یک واکنش تحت تاثیر تغییرات دما است. اما محاسبات مربوط به معادله آرنیوس، دارای دو نقص است. یکی این که تعیین نمی کند که واکنش در یک مرحله یا چند مرحله انجام می شود. در این معادله، میانگین موانع آستانه ای در مرحله های اولیه در نظر گرفته می شود که از نظر علمی، ارزش تئوری کمتری دارند. دومین نقض مربوط به برخوردهای فردی است که در واکنش های ابتدایی، همچنان نتیجه های حاصل از آزمایش ها را ثابت نگه می دارد. چون در آزمایشات بزرگ، چندین میلیارد مولکول با اشکال هندسی مختلف وجود دارد که انرژی های انتقالی و ارتعاشی متفاوتی دارند.
روابط بین آنتالپی، آنتروپی و انرژی آزاد گیبس
تغییرات انرژی آزاد گیبس (∆G) در ترمودینامیک با استفاده از رابطه زیر به دست می آید.
∆G = ∆H – T∆S
تغییر انرژی گیبس در شرایط استاندارد به شکل ∆G° نشان داده می شود. تغییرات انرژی آزاد گیبس در شرایط غیراستاندارد با معادله زیر به دست می آید.
∆G = ∆G° + RT lnK
در این رابطه K ثابت تعادل، R ثابت گازهای ایده آل (ثابت جهانی گازها)، ∆G° تغییرات انرژی آزاد گیبس استاندارد و ∆G تغییرات انرژی گیبس واکنش است.



















