ترکیب یونی – ساختار و خواص
ترکیب یونی به دسته ای از مواد شیمیایی که اجزای تشکیل دهنده آن ها یون ها هستند گفته می شود. این دسته از ترکیبات در کل از نظر شیمیایی خنثی هستند. اجزای تشکیل دهنده آن ها یون های مثبت (کاتیون) و یون های منفی (آنیون) هستند. کاتیون ها و آنیون ها در یک ساختار شبکه سه بعدی در کنار هم قرار می گیرند و ترکیبات یونی را به وجود می آورند. ترکیبات یونی به طور طبیعی در سنگ های معدنی و آب دریاها و اقیانوس ها یافت می شود. این نشریه جهان شیمی فیزیک به بررسی تشکیل و برخی ویژگی ها این ترکیبات می پردازد.
فهرست مطالب :
۱- تعریف ترکیب یونی
۲- پیوند یونی
۳- ساختار ترکیبات یونی
۴- ویژگی های ترکیبات یونی
۴-۱- تشکیل بلور
۴-۲- نقطه ذوب
۴-۳- خاصیت شکنندگی
۴-۴- رسانایی در ترکیب یونی
۴-۵- انحلال پذیری ترکیب یونی
۴-۶- رنگ ترکیبات یونی
۵- نام گذاری ترکیبات یونی
۶- انواع ترکیبات یونی
۱- تعریف ترکیب یونی :
مایکل فارادی اولین کسی بود که نام یون (معنای رونده) را روی جزهای تشکیل دهنده ترکیبات یونی گذاشت. ترکیبات یونی جامدات بلوری هستند که آنیون ها و کاتیون ها که به طور معمول از نافلزات و فلزات به دست می آیند با آرایشی منظم در کنار هم قرار می گیرند. فلزات با ازدست دادن الکترون و نافلزات با گرفتن الکترون به آرایش اوکتت (هشتایی) رسیده و با پیوند یونی کنار هم قرار می گیرند.
۲- پیوند یونی :
پیوندی شیمیایی که بین کاتیون ها و آنیون ها به وسیله نیروی الکتروستاتیک قوی برقرار می شود. در این پیوند الکترون های ظرفیت از یک اتم خارج (تشکیل کاتیون) و به اتم دیگر وارد می شود ( تشکیل آنیون) و این یون ها با نیروی جاذبه قوی کنار هم قرار می گیرند. یون های مثبت و منفی همدیگر را جذب می کنند.
مثال :
به عنوان مثال در ترکیب یونی کلرید سدیم که به عنوان نمک طعام از مهمترین ترکیبات مورد نیاز بشر است، سدیم در اوربیتال ظرفیت خود (۳s) یک الکترون دارد برای رسیدن به آرایش اوکتت یک الکترون را از دست داده و کاتیون Na+ تولید می کند. همچنین کلر با آرایش لایه ظرفیت ۳s۲۳p۵ که یک الکترون برای رسیدن به آرایش گاز نجیب کم دارد، آن الکترون را گرفته و تشکیل آنیون Cl– می دهد.

حال این یون ها با تبادل الکترون به آرایش پایدار رسیدند و بارهای مخالف هم دارند که با نیروی جاذبه الکتروستاتیکی جذب هم می شوند و پیوند یونی تشکیل می دهند. در مثال بالا ترکیب یونی سدیم کلرید تشکیل شده از نظر الکتریکی خنثی می باشد چون تعداد بارهای مثبت و منفی برابر دارد.
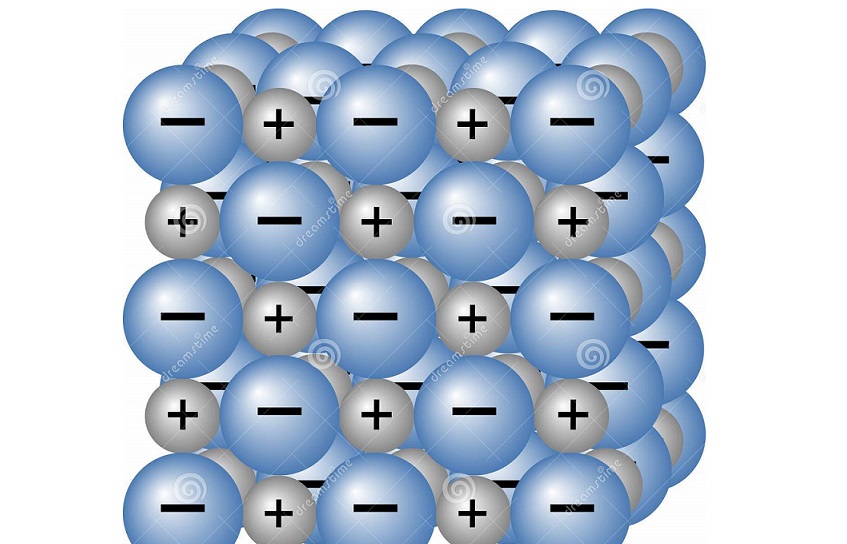
۳- ساختار ترکیبات یونی :
ترکیبات یونی جامدات بلوری هستند که با ساختار هندسی منظمی کنار هم قرار می گیرند. نیروی جاذبه بین بارهای مثبت و منفی باعث می شود یون ها در این ساختار شبکه بلوری منظم در کنار هم بتوانند قرار گیرند و کمترین انرژی شبکه را داشته باشند. ساختار ترکیبات یونی بلورین که شبکه به هم پیوسته ای از یون هاست و با تکرار ساده ترین نسبت کاتیون ها و آنیون ها در این ساختار، فرمول شیمیایی آن ها نوشته می شود. به این نسبت که تکرار می شود سلول واحد گویند. هفت شبکه بلوری برای ترکیبات یونی به نام های مکعبی، سه گوشه، شش گوشه، چهار گوشه، راست لوزی، تک شیب و سه شیب وجود دارد.
ترکیب یونی سدیم کلرید ساختار مکعبی دارد.

۴- ویژگی های ترکیبات یونی :
۴-۱- تشکیل بلور :
اولین خصوصیت ترکیب یونی تشکیل ساختار بلوری است که در بالا توضیح داده شد.
۴-۲- نقطه ذوب :
چون نیروی جاذبه بین آنیون ها و کاتیون ها در شبکه بلوری ترکیبات یونی بسیار قوی است، برای شکستن این پیوند قوی به انرژی زیادی احتیاج است. همین دلیل بالا بودن نقطه ذوب در ترکیبات یونی است به طوری که سدیم کلرید در ۸۰۰ درجه سانتیگراد ذوب می شد.
۴-۳- خاصیت شکنندگی :
از خصوصیات ترکیب یونی سخت بودن و شکنندگی آن است. وقتی یک نیروی مکانیکی قوی مثل کوبیدن چکش به ساختار بلوری برخورد می کند، یون ها جابه جا شده و یون های هم نام در کنار یکدیگر قرار می گیرند. پس بین کاتیون های مقابل هم و همچنین بین آنیون های کنار هم نیروی دافعه به وجود می آید و ساختار بلوری از هم گسسته و پاشیده می شد.
۴-۴- رسانایی در ترکیب یونی :
ترکیبات یونی در حالت مذاب و نه در حالت جامد، رسانای خوب الکتریسیته هستند. چون در حالا جامد یون ها حرکتی ندارند و ثابت هستند نمی توانند هادی جریان الکتریکی باشند. اما در حالت مذاب چون یون ها در حال حرکت و جابه جایی هستند می توانند الکتریسیته را همراه به حرکتشان هدایت کنند.
۴-۵- انحلال پذیری ترکیب یونی :
در هنگام انحلال یک ترکیب یونی پیوند بین یون ها گسسته شد و هر کدام از یون ها توسط مولکول های حلال احاطه می شود که به این فرآیند حلال پوشی می گویند. مثلا در هنگام حل شدن سدیم کلرید در آب یون های Na+ و Cl– با مولکول های آب پیوند برقرار می کند، به اصطلاح آب پوشی می شود. در حلال های قطبی میزان انحلال پذیری یون ها بیشتر از حلال های غیرقطبی است. پیوند بین آن ها یون – دوقطبی است. ترکیبات یونی با قابلیت انحلال پذیری بالا الکترولیت قوی محسوب می شوند.

توجه :
می دانیم برای شکستن پیوندها انرژی لازم است و از تشکیل پیوندها انرژی آزاد می شود. در بحث انحلال هرگاه میزان انرژی لازم برای شکستن پیوند بین یون ها و همچنین بین مولکول های حلال بیشتر از انرژی آزاد شده از تشکیل پیوند بین مولکول های حلال و یون ها با هم باشد انحلال گرماگیر و اگر برعکس این باشد انحلال گرماده است.
۴-۶- رنگ ترکیبات یونی :
رنگ ترکیبات یونی در حالت جامد با ر نگ آن ها در حالت محلول آبی متفاوت است. به عنوان مثال کبالت (II) کلرید بی آب، آبی رنگ می باشد اما کبالت (II) کلرید شش آبه به رنگ قرمز است.
۵- نام گذاری ترکیبات یونی :
در روش آیوپاک از مجموع نام کاتیون و آنیون تشکیل دهنده ترکیب، نام ترکیب نوشته می شود. در ترکیب های ساده دوتایی، ترکیباتی که شامل دو اتم هستند و کاتیون و آنیون آن یک اتمی است، اسم کاتیون بدون تغییر می آید و سپس نام آنیون با اضافه کردن پسوند –ید یا –اید آورده می شود. مانند NaCl که سدیم کلرید، LiI که لیتیم یدید و AlN که آلومینیم نیترید نام گذاری می شود.
نام گذاری ترکیبات یونی چند اتمی :
اگر کاتیون و آنیون تشکیل دهنده ترکیب یونی از چند اتم تشکیل شده باشد، از نام یون چند اتمی استفاده می شود. به عنوان مثال در CaCO۳ که آنیون این ترکیب دواتمی است و کربنات نام دارد، اسم ترکیبمان کلسیم کربنات می شود.
در برخی فلزات واسطه مانند آهن که توانایی تشکیل بیش از یک نوع کاتیون را دارند، یعنی ظرفیت های متفاوتی دارند، برای نام گذاری در روش آیوپاک در ترکیبات یونی تعداد بار را به رومی داخل پرانتز بعد از نام یون مربوطه می نویسند. به عنوان مثال FeCl۲، آهن (II) کلرید و FeCl۳، آهن (III) کلرید نامیده می شود.
نکته :
در روش قدیمی کاتیون با بار کمتر با پسوند –وس و کاتیون با بار بیشتر با پسوند –یک نوشته می شود. به عنوان مثال به FeCl۲، فروس کلرید و FeCl۳، فریک کلرید نامیده می شود.
۶- انواع ترکیبات یونی :
اسیدها :
اسیدها مزه ای ترش داشته که در واکنش با فلزات هیدروژن آزاد می کنند و در واکنش با بازها نمک تولید می کنند. همه آن ها دارای عامل اسیدی H هستند و با انحلال در آب خاصیت الکترولیتی پیدا می کنند. اسید کلریدریک و اسید سولفوریک نمونه های اسید هستند.
بازها :
بازها یا قلیاها که مزه ای تلخ دارند و در صورت تماس با دست آن را صابونی می کنند. بازها دارای عامل بازی هیدروکسید (OH) هستند و با اسیدها ترکیب شده، نمک می دهند. آمونیاک و سدیم هیدروکسید نمونه هایی از باز هستند.
نمک ها :
ترکیبات یونی که شامل یک فلز و یک نافلز هستند. نمک ها از کنارهم قرار گرفتن کاتیون های فلزی و آنیون های نافلزی کنار هم تشکیل می شوند. با حل شدن در آب خاصیت رسانایی الکتریکی پیدا می کنند.



















