آنیون چیست و از ویژگی های آن چه می دانید؟
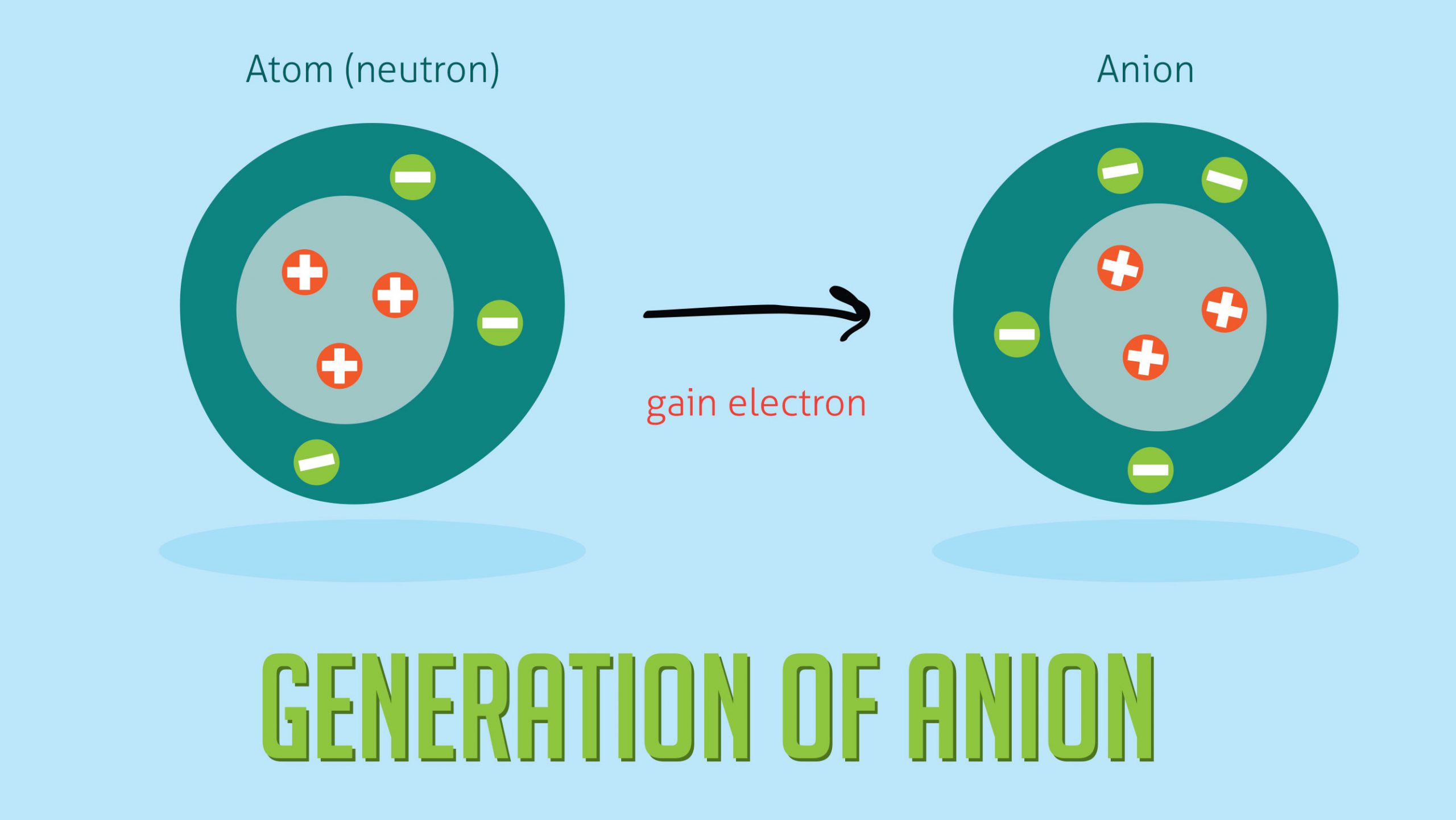
آنیون یک گونه یونی است که به دلیل داشتن الکترون اضافی در لایه الکترونی خود دارای بار الکتریکی منفی است. از نظر اندازه آنیون ها از کاتیون ها (یونهای دارای بار مثبت) بزرگتر هستند زیرا الکترون های اضافی جذب کرده اند.
در واقع با افزودن یک یا چند الکترون به پوسته خارجی یک اتم، آنیون تشکیل می شود. به عنوان مثال عناصر گروه ۱۷ یک الکترون ، عناصر گروه ۱۶ دو الکترون و عناصر گروه ۱۵ سه الکترون به پوسته بیرونی خود اضافه می کنند. آنیون ها با حذف انتهای نام عنصر و افزودن -ide نامگذاری می شوند .
کلمه آنیون (AN-aye-un) توسط کشیش ویلیام ووئل در سال ۱۸۳۴ از اصطلاح یونانی به مفهوم “چیزی که بالا می رود” پیشنهاد شده است که اشاره به حرکت آنیون ها در هنگام الکترولیز دارد. فیزیکدان معروف ، مایکل فارادی اولین شخصی بود که از این اصطلاح در مقالات خود استفاده کرد. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا ما را همراهی کنید.
پرکاربردترین آنیون ها در صنایع
یونها به عنوان اتمها یا مولکولهایی که الکترون نابرابر دارند، تعریف می شوند. یون های دارای بار مثبت به عنوان کاتیون شناخته می شوند ، در حالی که یون های دارای بار منفی به عنوان آنیون شناخته می شوند. آنیون های زیر بیشترین استفاده را در صنایع مختلف دارا می باشند :
- کلرید آزاد : –Cl
- اکسیژن واحد: -O
- سوپراکسید: O -۲
- یون هیدروکسید: –OH
- سولفات: SO ۴ -۲
آنیون چگونه تشکیل می شود؟
اتمهای فلزی نسبت به غیر فلزات الکترون های لایه های آخر خود را نسبتاً آزاد نگه می دارند به همین دلیل جدا شدن این الکترون ها بسیار راحت خواهد بود و با جدا شدن آنها کاتیون تولید می شود. در مقابل ، اتمهای غیر فلزی الکترون های خود را بسیار محکم تر نگه می دارند و به دلیل تمایل بالا به جذب الکترون ، آنیون تشکیل دهند. از ترکیب گونه های فلزی و غیر فلزی با خاصیت الکترونگاتیویته مخالف پیوند یونی تشکیل می شود.
بطورکلی فلزات الکترون از دست می دهند و کاتیون مثبت تشکیل می دهند. غیر فلزات با بدست آوردن الکترون ، یون منفی ایجاد می کنند. غیر فلزات به طور کلی الکترونگاتیوتر از فلزات هستند ، به این معنی که کشش بیشتری روی الکترون های خود دارند.
شناسایی و سنجش این گونه ها به دلیل نقش مهمی که در فرایندهای بیولوژیکی ، صنعتی و زیست محیطی بازی می کنند بسیار حائز اهمیت است و اخیراً به عنوان برخی از زمینه های اصلی تحقیق در شیمی فوق مولکولی مورد توجه قرار گرفته اند.

آنیون و کاتیون در جدول تناوبی
با توجه به جایگاه قرارگیری اتم ها در جدول تناوبی می توان پیش بینی کرد آنها کاتیون یا آنیون تشکیل می دهند. به عنوان مثال هالوژن ها آنیون تشکیل می دهند درحالیکه فلزات قلیایی و قلیایی خاکی کاتیون تشکیل می دهند. برخی از اتم ها نیز بسته به شرایط می توانند آنیون یا کاتیون تشکیل دهند مثلا هیدروژن به صورت H+ یا H− وجود دارد.
آنیون و کاتیون در الکتروشیمی
از خواص یونی در کروماتوگرافی ، الکتروشیمی و باتری ها استفاده می شود. مثلا باتری ها از دو الکترود رسانا به نام های کاتد و آند تشکیل می شوند که با حرکت جریان آنیون ها و کاتیون ها برق تولید می شود. در الکتروشیمی نیز از این خواص استفاده می شود.
کاربردهای آنیون در پزشکی
در حال حاضر مطالعه شناخت آنیون به یکی از زمینه های اصلی شیمی فوق مولکولی تبدیل شده است به خصوص الکترون های خنثی و لیپوفیلی که می تواند در غشای سلولی قرار بگیرد و آنیونها را بهم دیگرمتصل کند. مثلا یون کلر (-Cl) به عنوان آنیون برای جداسازی سلول از محلول آبی مورد استفاده قرار می گیرد. اینها می توانند به عنوان ناقل عمل کنند و آنیونها را از طریق غشاها منتقل کنند.
جالب اینجاست که در مقایسه با آنتی بیوتیک های یونوفور قابل حمل توسط کاتیون (به عنوان مثال والینومایسین) هیچ مولکولی از این نوع در طبیعت یافت نمی شود و همه آنیون های ناقل به صورت آزمایشگاهی تولید می شوند. علاوه بر این ممکن است ناقلین آنیونی انواع جدیدی از فعالیت های بیولوژیکی را از خود نشان دهند. اگر این گونه ها اثرات منفی از خود نشان ندهند ، ممکن است برای بیمارانی که ناقلین سلولی خود از دست داده اند، مفید باشد. یکی از بیماری های ژنتیکی که منجر به نقص در ناقلین آنیونی می شود فیبروز کیستیک (CF) است.
جایگاه آنیون ها در نامگذاری ترکیب شیمیایی
هنگام نامگذاری یک ترکیب شیمیایی ، ابتدا کاتیون نام برده می شود و سپس آنیون. به عنوان مثال ، ترکیب سدیم کلرید که به صورت NaCl نوشته شده است ، +Na کاتیون است و -Cl آنیون است. بار الکتریکی خالص آنیون پس از نماد شیمیایی بالای فرمول شیمیایی نوشته می شود. به عنوان مثال یون فسفات PO ۴–۳ دارای ۳ بارمنفی می باشد.
از آنجا که طیف وسیعی از ظرفیت ها در عناصرمختلف وجود دارد ، تعیین آنیون و کاتیون در یک فرمول شیمیایی همیشه واضح نیست. به طور کلی ، می توان از اختلاف در الکترون برای شناسایی کاتیون و آنیون در یک فرمول شیمیایی استفاده کرد.

موارد استفاده آنیون در صنایع مختلف
رزین آنیونی و کاتیونی
در صنایع مختلف که مهمترین آن تصفیه آب است از رزین آنیونی و کاتیونی که قدرت جذب و اتصال بسیار قوی دارند ، استفاده می شود. این رزین ها دو قطبی هستند و قدرت تبادل یون بالایی داشته و بر اساس اینکه کاتیون هستند یا آنیون، کاربردهای متفاوتی دارند.
رزین آنیونی
این رزین ها آنیون فعال دارند و نیترات ها و کلراید که عناصر مضری برای آب هستند را حذف می کنند. رزین های تبادل یونی موادی هستند که به طور همزمان یون ها را به منظور تصفیه یا ضدعفونی مایعات به دام می اندازند.
روند تبادل یون به جذب یون ها و جایگزینی این یون ها با بارهای مخالف ، به یک ماده تخصصی اشاره دارد. مبدلهای یونی علاوه بر رزینهای ساخته شده توسط انسان به صورت طبیعی نیز وجود دارند و شامل زئولیت ، خاک رس و هوموس خاک هستند.
مضرات آنیون ها در صنایع
مفهوم آنیون در صنعت خوردگی مهم است زیرا خوردگی را تسهیل می کنند. هنگامی که فلزاتی مانند فولاد در یک محلول آبی دچار خوردگی می شوند ، معمولاً الکترولیت های خاصی ، به ویژه کلریدها ، سولفات ها و غیره ، خورنده هستند. قرار گرفتن بتن آرمه در معرض یون های کلرید علت اصلی خوردگی زودرس آرماتورهای فولادی است. با افزایش مقدار کلرید خطر خوردگی افزایش می یابد. ایجاد حفره در فولاد ضد زنگ در محلول های خنثی یا اسیدی حاوی هالیدها ، در درجه اول کلریدها (-CI) ، به عنوان مثال آب دریا رخ می دهد.



















