آشنایی با تعریف حلال و حل شونده به زبان ساده

حلال و حل شونده دو اصطلاحی است که در علم شیمی خیلی زیاد مورد استفاده قرار می گیرد و برای درک بهتر فرآیندهای شیمیایی باید با آنها آشنا بود.

وقتی دو ماده با هم مخلوط می شوند و محلول ایجاد می کنند حل شونده گونه ای است که با نسبت کمتر در محلول وجود دارد. به عنوان مثال ، در یک محلول اسید سولفوریک ۱ مولار، اسید سولفوریک محلول است در حالی که آب حلال است.
اصطلاحات ” حل شونده ” و “حلال” را می توان در مورد آلیاژها و محلول های جامد نیز به کار برد. مثلا کربن ممکن است به عنوان یک ماده حل شونده در فولاد در نظر گرفته شود. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا همراه ما باشید.
حلال چیست؟
اصطلاح حلال به دسته ای از ترکیبات شیمیایی اطلاق می شود که به معنای سست کننده پیوند است . در شیمی ، از حلال ها – که عموماً به صورت مایع هستند – برای حل کردن ، تعلیق یا استخراج مواد دیگر استفاده می شود بدون اینکه تغییر شیمیایی در محلول یا مواد دیگر ایجاد کند.
از حلال های مختلف در طیف گسترده ای از کاربردهای روزمره استفاده می شود – از رنگ و محصولات مراقبت شخصی و دارویی گرفته تا سموم دفع آفات ، مواد پاک کننده و جوهر. بدون حلال ، بسیاری از محصولات مورد اعتماد ما عملکرد خوبی نخواهند داشت.
حلال ها بسیار متنوع هستند و نیازهای خاص تولید محصولاتی با ویژگی های عملکردی مطلوب را برآورده می کنند ، از جمله رنگ های اسپری که به سرعت خشک می شوند و نازل اسپری را مسدود نمی کنند ، جوهرهایی که لک تیره ایجاد نمی کنند، رنگ هایی که به نظر خوب می آیند و مدت طولانی دوام دارند و پاک کننده هایی که برای مشاغل سخت و چرب مناسب هستند.
انواع حلال ها
طبقه بندی شیمیایی یک حلال بر اساس ساختار شیمیایی آن است. به عنوان مثال حلال های هیدروکربنی بر اساس نوع “اسکلت کربن” مولکولهایشان در سه زیر گروه طبقه بندی می شوند و به ما خانواده حلال های آلیفاتیک ، آروماتیک و پارافینی را می دهند. رقیق کننده رنگ نمونه متداول حلال هیدروکربنی است.
حلال های اکسیژنه از طریق واکنش های شیمیایی الفین ها (حاصل از روغن یا گاز طبیعی) تولید می شوند و به ما الکل ها ، کتون ها ، استرها ، اترها ، گلیکول اترها و استرهای گلیکول اتر را می دهند.
حلال های هالوژنه حلال هایی هستند که حاوی هالوژن مانند کلر ، برم یا ید هستند. بسیاری از افراد پرکلرواتیلن را به عنوان نمونه – حلال بسیار موثری که در خشکشویی استفاده می شود – می شناسند.
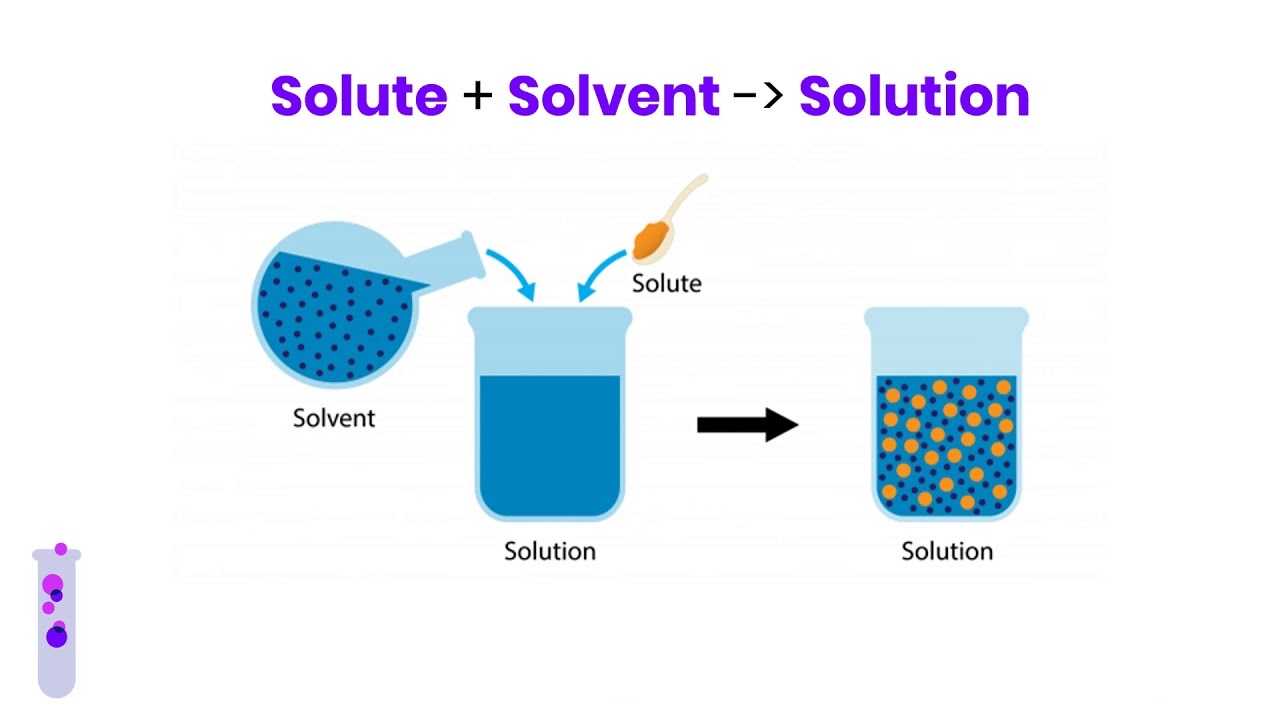
حل شونده چیست؟
حل شونده به عنوان ماده ای تعریف می شود که در محلول حل می شود. برای محلول های مایع ، مقدار حلال بیشتر از ماده محلول یا حل شونده است. اندازه گیری غلظت حل شونده موجود در یک محلول شیمیایی ، با توجه به مقدار حلال انجام می شود.
به عبارت دیگر حل شونده ماده ای است که می تواند توسط حلال حل شده و محلول ایجاد کند. یک ماده حل شده به اشکال مختلفی در می آید یعنی می تواند گاز ، مایع یا جامد باشد. حلال یا ماده ای که حل شونده را حل می کند مولکول های آن را به طور مساوی توزیع کرده و یک مخلوط همگن یا محلول هموژن ایجاد می کند.
حقایقی در رابطه با حل شونده ها
حل شونده معمولاً یک جامد است که در مایع حل می شود. یک نمونه روزمره حل شدن نمک در آب است. نمک ماده ای است که در آب به عنوان حلال حل می شود و یک محلول نمکی تشکیل می دهد. از طرف دیگر بخار آب به عنوان یک ماده حل شونده در هوا در نظر گرفته می شود زیرا نیتروژن و اکسیژن در غلظت های بسیار بیشتری در هوا وجود دارند.
غلظت یک حل شونده برابر با مقدار حل شونده تقسیم بر حجم کل محلول است. یک حلال می تواند مقادیر مختلفی از حل شونده را رقیق کند که بستگی به میزان استفاده از یک حلال و تفکیک راحت مولکول های حل شونده دارد. این ویژگی حل شونده برای حل شدن در یک حلال به عنوان قابلیت انحلال شناخته می شود.
عامل مهمی که در حل شدن سریع حل شونده موثر است سطح در معرض آن است. به عنوان مثال در صورت استفاده از نمک درشت ، سطح کمتری در معرض آب قرار می گیرد و حل شدن همان مقدار نمک بیشتر از نمک ریز طول می کشد. نمک ریزتر باعث می شود که یون های بیشتری در معرض آب قرار بگیرند و حل شونده سریعتر در آب پخش می شود و در نهایت دیگر نمکی در کف لیوان دیده نمی شود زیرا به طور مساوی در سراسر لیوان پخش خواهد شد.
انواع حل شونده
حل شونده ها می توانند یونی یا کوالانسی باشند. حل شونده های یونی هنگام حل شدن به یون های مجزا تفکیک می شوند درحالیکه حل شونده های کووالانسی به مولکول های مجزا تفکیک می شوند. مثلا نمک طعام (سدیم کلرید) یک حل شونده یونی است. یون های مثبت سدیم جذب سر منفی مولکول های آب شده و یون های منفی کلر جذب سر مثبت مولکول آب که هیدروژن است می شوند.
از طرف دیگر شکر یک ترکیب کووالانسی است و موقع حل شدن در آب مولکول های مجزای گلوکز را تشکیل می دهد. جالب است بدانید شکر مانند آب یک ترکیب قطبی و دارای دو سر مثبت و منفی است نیروهای جاذبه بین بارهای مخالف بین مولکول های آب و شکر سرانجام تمام بلورهای شکر را از هم تفکیک کرده و توسط مولکول های آب احاطه می شوند.
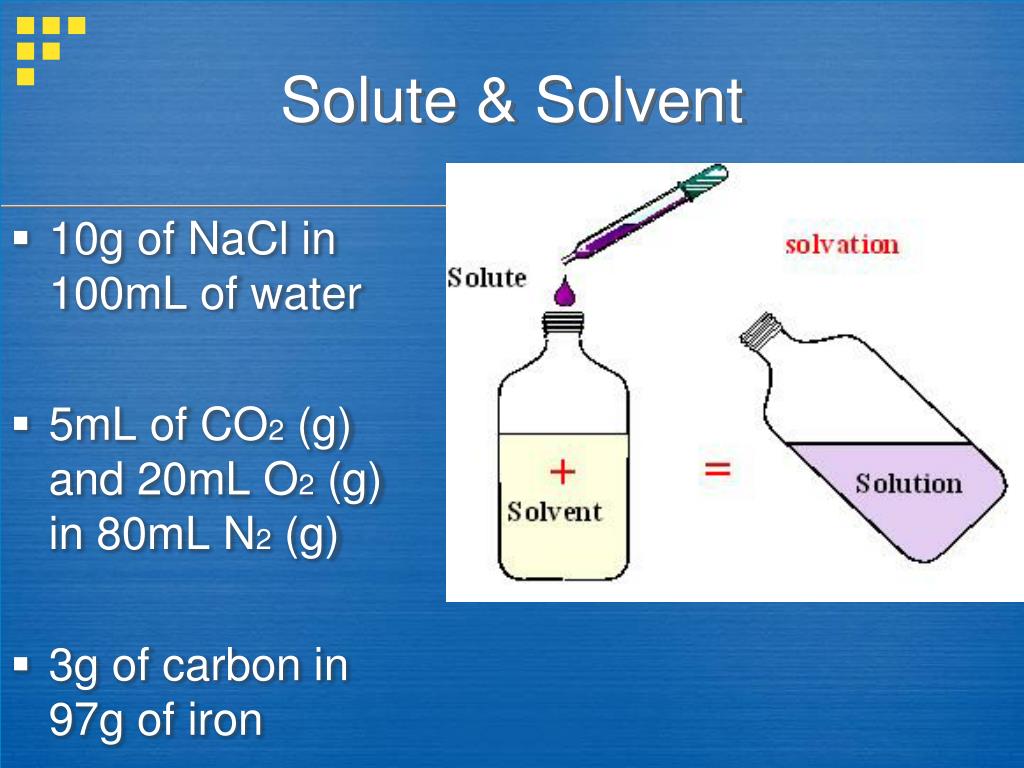
محلول ها و حلالیت
هنگامی که یک ماده در ماده دیگر حل می شود ، یک محلول تشکیل می شود. این در شرایطی است که ترکیبات مانند شن و ماسه در آب محلول نیستند. در یک محلول ، همه مواد به طور یکنواخت در سطح مولکولی توزیع می شوند و هیچ باقیمانده ای باقی نمی ماند. محلول از یک فاز تشکیل شده است و تمام مولکول های حل شونده بطور کامل در حلال حل می شوند. توانایی حل شدن یک ماده در ماده ای دیگر به عنوان حلالیت شناخته می شود. اگر این اتفاق در تمام نسبت ها رخ دهد آن ماده را اختلاط پذیر می نامند.
علاوه بر مخلوط شدن ، مواد موجود در یک محلول در سطح مولکولی با یکدیگر برهم کنش دارند. وقتی چیزی حل می شود ، مولکول های حلال در اطراف مولکول های ماده حل شده قرار می گیرند. در این حالا انتقال گرما رخ می دهد و آنتروپی افزایش می یابد و باعث می شود محلول از نظر ترمودینامیکی پایدارتر از ماده حل شده و حلال باشد. این آرایش با توجه به خواص شیمیایی مربوط به حلال و حل شونده از جمله پیوند هیدروژنی ، گشتاور دوقطبی و قابلیت قطبش ایجاد می شود.
انحلال باعث ایجاد واکنش شیمیایی یا تغییرات پیکربندی شیمیایی در محلول نمی شود. با این حال ، حلالیت شبیه یک واکنش تشکیل کمپلکس است که اغلب دارای انرژی قابل توجهی است (گرمای حلال و آنتروپی حلال) و بنابراین از یک فرآیند خنثی فاصله دارد. محلول ها را می توان با انواع و اشکال مختلف از حل شونده و حلال ها تشکیل داد.
بررسی آب به عنوان حلال
بسیاری از مواد اعم از جامد و مایع در آب حل می شوند و آب در شیمی به عنوان یک حلال همه کاره شناخته می شود. از آنجاییکه آب یک ماده قطبی است دارای دو سر باردار مثبت و منفی است و به این ترتیب می تواند طیف گسترده ای از ترکیبات را در خود حل کند. به عنوان مثال حل شونده های باردار جذب قطب های باردار مولکول آب می شوند و ذرات حل شونده از یکدیگر جدا می شوند. موادی که در آب حل نمی شوند مانند روغن ها مولکول هایی نا قطبی هستند و نمی توانند با مولکولهای قطبی آب پیوند برقرار کنند. بنابراین همواره به خطر داشته باشید که شبیه ، شبیه را حل می کند.
تفاوت حلال و حل شونده علوم هشتم
حلال و حل شونده دو جزء محلول هستند که برای تشکیل محلولی استفاده می شوند. یکی را حل شونده در نظر می گیریم و آن را در یک حلال حل می کنیم تا یک محلول تشکیل شود. معمولاً به ماده جامدی که مقدار کمتری دارد حل شونده و به ماده ای که مقدار آن بیشتر است حلال می گویند. (به طور کلی، حلال ها ماهیتی مایع دارند) آب یک حلال جهانی است زیرا می تواند مواد مختلفی را حل کند. حل شونده ها بر اساس خواص فیزیکی و شیمیایی طبقه بندی می شوند.
- حل شونده یونی: از یون هایی تشکیل شده اند که با تفکیک به یون های تشکیل دهنده خود در یک حلال حل می شوند.
- حل شونده مولکولی: املاح مولکولی از مولکول هایی تشکیل شده اند که از طریق نیروهای بین مولکولی ضعیف در یک حلال حل می شوند.
- حل شونده اسیدی و اساسی: این نوع املاح به دلیل توانایی آنها در اهدا یا پذیرش پروتون (یون H+) مشخص می شود.
- حل شونده کلوئیدی: املاح کلوئیدی از ذرات بزرگتر از مولکول های حلال تشکیل شده اند.
حلال ها با توجه به خواص مختلف مواد شیمیایی، قطبیت و کاربرد به انواع مختلفی تقسیم می شوند. در زیر انواع حلال ها را تعریف کرده ایم.
- حلال قطبی: حلال های قطبی حلال های بار مثبت خاصی هستند که در یک انتها باردار و یک بار منفی جزئی در طرف دیگر دارند که به آنها اجازه می دهد املاح قطبی را حل کنند.
- حلال های غیر قطبی: حلال های غیر قطبی بار جزئی ندارند و نمی توانند املاح قطبی را حل کنند.
- حلال های آپروتیک: حلال های آپروتیک حاوی اتم هیدروژن اسیدی نیستند و نمی توانند پروتون اهدا کنند.
- حلال های پروتیک: حلال های پروتیک حاوی یک اتم هیدروژن اسیدی هستند که می توانند پروتون ها را نیز اهدا کنند.



















