کاتالیزور شیمیایی چیست و چه نقشی در واکنش های شیمیایی دارد؟
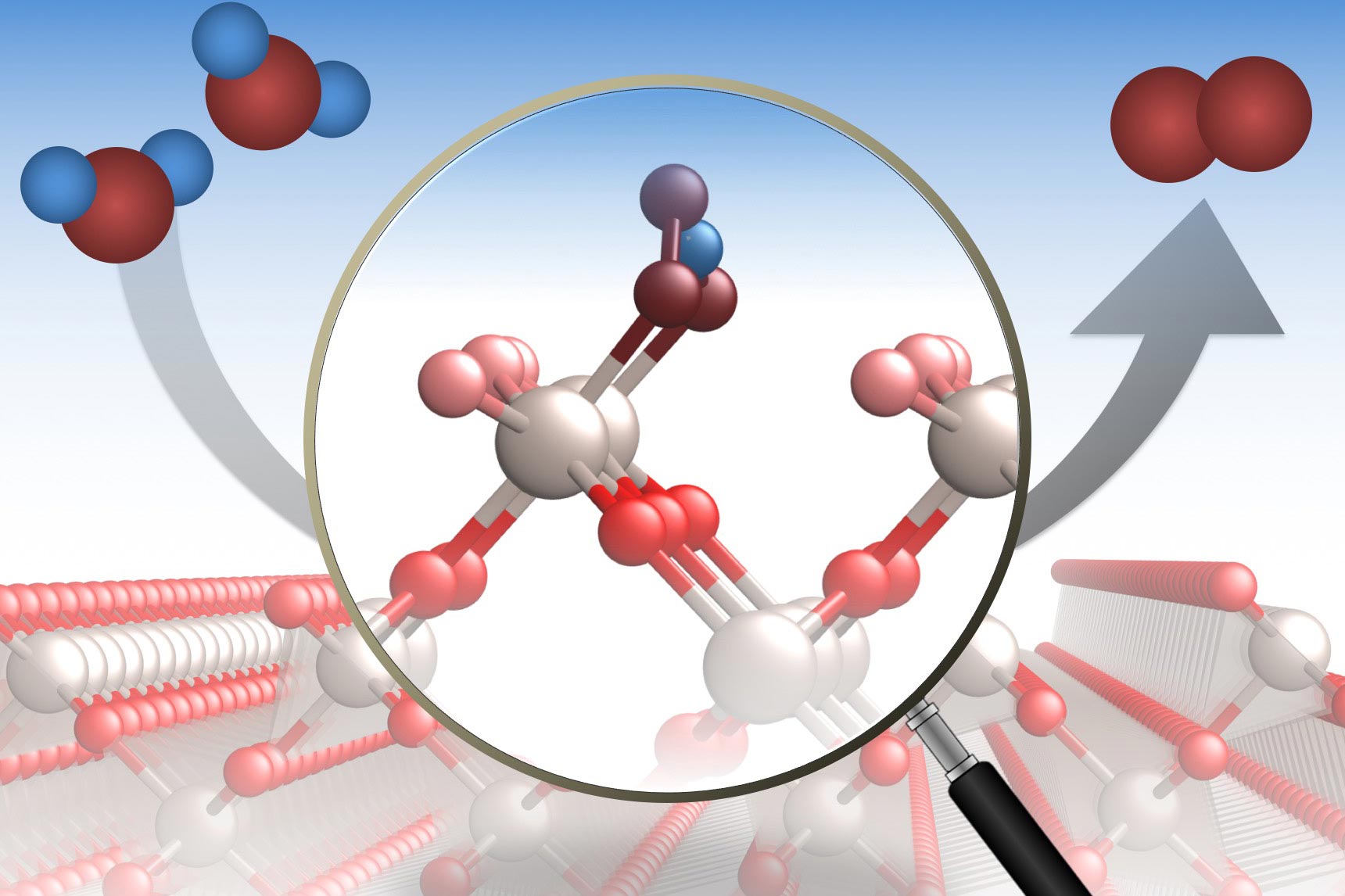
کاتالیزور شیمیایی ماده ای است که سرعت واکنش را بدون اینکه خودش مصرف شود ، افزایش می دهد. آنزیم ها کاتالیزورهای طبیعی هستند که مسئول بسیاری از واکنش های بیوشیمیایی اساسی در بدن موجودات زنده هستند. این ترکیبات با افزایش سرعت واکنش شیمیایی نقش مهمی در صنایع تولیدی دارند و بدون وجود آنها نمی توان فرآیندهای شیمیایی را با سرعت و شدت دلخواه انجام داد.
بیشتر کاتالیزورهای جامد ، فلزات یا اکسیدها ، سولفیدها و هالیدهای عناصر فلزی و عناصر نیمه فلزی بور ، آلومینیوم و سیلیکون هستند. کاتالیزورهای گازی و مایع معمولاً به شکل خالص یا در ترکیب با حامل ها یا حلال های مناسب استفاده می شوند. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می شود.
کاتالیزور شیمیایی چیست ؟
آشنایی ما با کلمه کاتالیزور شیمیایی میتواند از کتاب درسی علوم پایه هشتم آغاز شده باشد کاتالیزگرها قهرمانان گمنام واکنش های شیمیایی هستند. با کمک یک کاتالیزور مولکول هایی که ممکن است برهم کنش آنها باهم سال ها به طول بینجامد در عرض چند ثانیه با یکدیگر واکنش می دهند. تمام کارخانه های تولیدی از پلاستیک سازی گرفته تا صنعت دارو به این ترکیبات متکی هستند.
کاتالیست ها به تبدیل نفت و ذغال سنگ به سوخت های مایع کمک می کنند. آنها بازیگران اصلی در تکنولوژی انرژی پاک هستند. کاتالیزورهای طبیعی در بدن – که به عنوان آنزیم شناخته می شوند – حتی نقش مهمی در هضم غذا و موارد دیگر دارند.
کاتالیزگرها می توانند به صورت اکسیدها ، نیتریدها، اسیدها و یا نمکها مورد استفاده قرار بگیرند و تهیه و آماده سازی آنها هنر بسیار پیچیده ای است. این ترکیبات بر اساس نوع فرایندی که در آن بکار می روند در اشکال و اندازه های مختلف (میکروسکوپیک، مزوسکوپیک و ماکروسکوپیک) طراحی و تولید می شوند.
انواع کاتالیزور شیمیایی
کاتالیست ها بطورکلی دو دسته هستند مرغوب و نامرغوب. کاتالیزور مرغوب در طی واکنش فقط اجازه تشکیل یک نوع محصول را می دهد. اما در حضور کاتالیزور نامرغوب محصولات متفاوتی طی واکنش تولید می شوند.

مکانیسم اثر کاتالیزور در یک واکنش شیمیایی
کاتالیست در یک واکنش شیمیایی به عنوان فعال کننده عمل کرده و سرعت واکنش را افزایش می دهد. این ترکیبات در یک مرحله از واکنش مصرف شده و در مرحله بعدی مجددا تولید می شود و این مسئله ممکن است در طول یک واکنش بارها و بارها رخ دهد.
کاتالیزگر یک راه جدید برای پیشرفت واکنش ایجاد می کند که به انرژی فعال سازی کمتری نیاز دارد به همین دلیل سرعت واکنش را افزایش می دهد. علاوه بر این کاتالیست باعث می شود مولکول های بیشتری انرژی لازم برای برخوردی که منجر به واکنش می شود را بدست بیاورند در نتیجه تعداد کل برخوردهای مؤثر را در واحد زمان افزایش می دهد که در نهایت منجر به تسریع واکنش شیمیایی خواهد شد.
لازم به ذکر است که کاتالیزورها دارای طول عمر معینی هستند بنابراین پس از بی اثر شدن سرعت واکنش می تواند به طور ناگهانی یا تدریجی کاهش یابد. در این شرایط اگر مایل به ادامه واکنش هستید باید کاتالیزگر جدیدی را وارد واکنش کنید.
طبقه بندی سیستم های کاتالیزوری
کاتالیزورها می توانند در دو فاز هموژن و هتروژن اثر خودشان را اعمال کنند. در فاز هموژن مواد واکنش دهنده و کاتالیزور در یک فاز قرار می گیرند ولی در فاز هتروژن یا ناهمگن واکنش دهنده و کاتالیزور در دو فاز مختلف دارند که معمولا با یک مرز باریک از یکدیگر جدا می شود.
اثر کاتالیزور بر سرعت واکنش شیمیایی
در طی هر واکنش شیمیایی مولکول ها پیوندهای شیمیایی بین اتم های خود را می شکنند و اتم ها پیوندهای جدیدی با اتم های مختلف دیگر تشکیل می دهند. این روند مانند تعویض شرکا در یک فرآیند است. گاهی اوقات ، این مشارکت ها به راحتی از بین می روند. اما در مشارکت های پایدار مولکول ها یا اتم ها برای مدت زمان طولانی در کنار هم باقی می مانند.
کاتالیزورها باعث می شوند که چنین تجزیه و بازسازی هایی با کارایی بیشتری اتفاق بیفتد. آنها این کار را با کاهش انرژی فعال سازی برای واکنش شیمیایی انجام می دهند. انرژی فعال سازی مقدار انرژی مورد نیاز برای انجام واکنش شیمیایی است. کاتالیزور فقط مسیر همکاری جدید شیمیایی را تغییر می دهد. به عبارت دیگر مانند بزرگ راهی آسفالته برای دور زدن یک جاده خاکی پر از دست انداز است. هر چند یک کاتالیزور در واکنش مصرف نمی شود اما مولکول های دیگر را تشویق به واکنش می کند و پس از انجام واکنش از فرآیند کنار می کشد.
در حال حاضر واکنشهای کاتالیزوری اساس بسیاری از فرآیندهای شیمیایی صنعتی هستند و تولید کاتالیست خود یک فرآیند صنعتی مهم است که به سرعت در حال رشد می باشد.



















