معادله محاسبه PH (محاسبه پی اچ) و مقدار آن در مواد مختلف

یکی از مباحثی که درعلم شیمی مورد بحث فراوان بوده و در زندگی نیز مورد استفاده است، محاسبه PH است. برای محاسبه PH، معمول ترین فرمولی که به کار می رود، با رابطه لگاریتمی از غلظت یون هیدروژن بیان می شود. بازه PH بین ۰ تا ۱۴ بوده و میزان خاصیت بازی و اسیدی در محلول ها را نشان می دهد. مقدار عددی کمتر از ۷، PH نشان دهنده محلول های اسیدی و بیشتر از این مقدار، نشان دهنده محلول های بازی است. این مقاله نشریه جهان شیمی فیزیک ما را با محاسبه PH و تعریف این مبحث مهم آشنا می کند.
PH چیست؟
در یک محلول، PH را با غلظت یون هیدروژن تعریف می کنند. به محلول هایی که دارای مقدار غلظت یون هیدروژن بالا هستند، اسیدی بوده و محلول هایی که غلظت یون هیدروژن در آن ها کم است، بازی به حساب می آیند. به عبارتی یک اسید با حل شدن در آب، یون هیدروژن آزاد کرده و یک باز با حل شدن در آب یون هیدروکسید آزاد می کند.
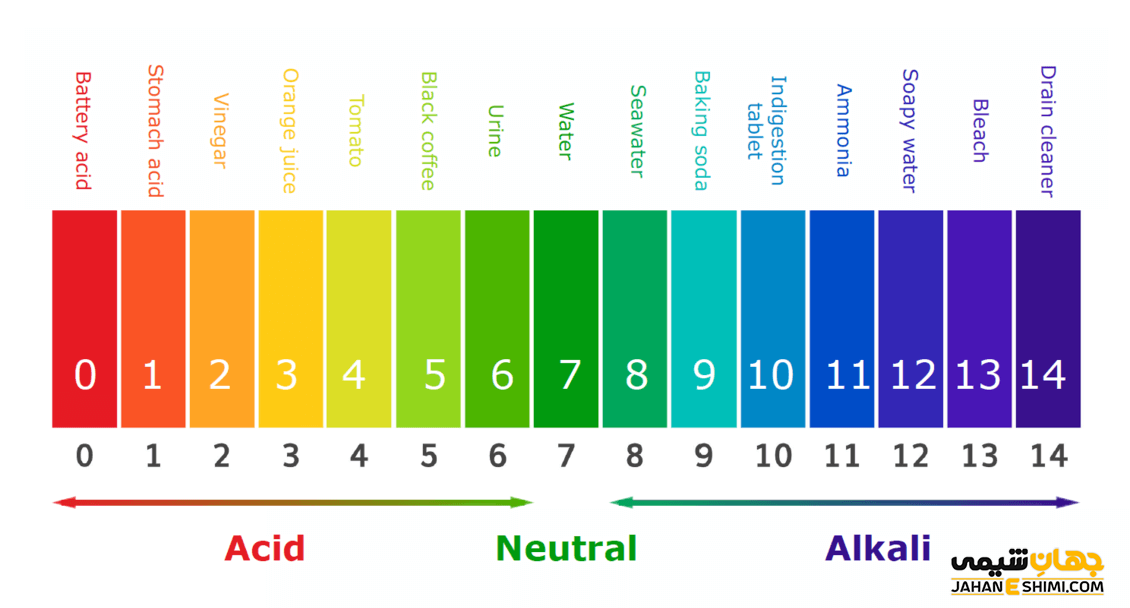
مقدار PH بین ۰ تا ۱۴ تعریف می شود، هر چند در برخی از واقع می توان PHهای خارج از این بازه را نیز در محلول ها مشاهده کرد. این اعداد با غلظت یون هیدروژن بین ۱ تا ۱۰-۱۴ مولار تعیین می شود. به طوری که اگر غلطت یون هیدرونیوم به ۱ نزدیکتر باشد، نشان دهنده اسیدی بودن محلول است. اما غلظت یون هیدرونیوم نزدیک به ۱۰-۱۴ نشان دهنده محلول های بازی است. در زندگی روزمره با بسیاری از محلول های اسیدی و بازی مواجه هستیم. آب پرتقال با پی اچ ۳ و محلول های سفید کننده با پی اچ ۱۲ نمونه ای از این محلول های کاربردی هستند. آب را به دلیل داشتن پی اچی برابر با ۷، به عنوان محلولی خنثی می شناسیم.
PH سنج چیست؟
از ابزارهای مهم آزمایشگاهی، PH سنج است که برای اندازه گیری PH محلول ها مورد استفاده قرار می گیرد. ساختار PHسنج به گونه ای است که دو حسگر الکترود در پروب شیشه ای آن وجود دارد. ولتاژ دستگاه با کمک این دو الکترود اندازه گیری می شود. از دو الکترودی که در ساختار این دستگاه وجود دارد، یکی در محلول مرجع قرار گرفته و دارای مقدار PH ثابت است. الکترود دیگر را در محلول مورد نظر قرار داده و PH آن اندازه گیری می شود. ولت متر نیز وسیله ای است که تفاوت ولتاژ بین دو الکترود را اندازه گیری می کند. PH با تبدیل این تفاوت ولتاژ به دست آمده حاصل می شود. در استفاده از دستگاه PHسنج باید دقت کرده که هر چند وقت آن را کالیبره می کنند و برای این کار از محلول های بافر استفاده می کنند.
شناساگر PH
یکی از روش های آزمایشگاهی و ساده برای محاسبه PH استفاده از شناساگرهاست. از ارجحیت های به کار بردن این روش، عدم نیاز به کالیبراسیون و همچنین نگهداری آسان آن هاست. شناساگرها ارزان بوده و میزان پی اچ را می توانند به طور سریع اندازه گیری کنند. شناساگرها ترکیبات هالوکرومیکی هستند که با قرار گرفتن در یک محلول می توانند به واسطه تغییر رنگ، میزان اسیدی و یا بازی بودن محلول را نشان دهند. وجود یون های هیدروژن با کمک شناساگرها نشان داده می شود.
همچنین شناساگرها به صورت طبیعی در برخی از موجودات زنده یافت می شوند. به عنوان نمونه در گیاهان، این ترکیبات یافت می شوند. کلم قرمز شناساگر آنتوسیانین داشته و زردچوبه نوع دیگری از این شناساگرهاست که در محلول های اسیدی، زرد و در محلول های بازی، قهوه ای مایل به قرمز است. نمونه دیگری از شناساگرهای طبیعی، گل ادریسی است که رنگ آبی را از خود در خاک اسیدی و رنگ صورتی یا بنفش را در خاک های قلیایی نشان می دهد.
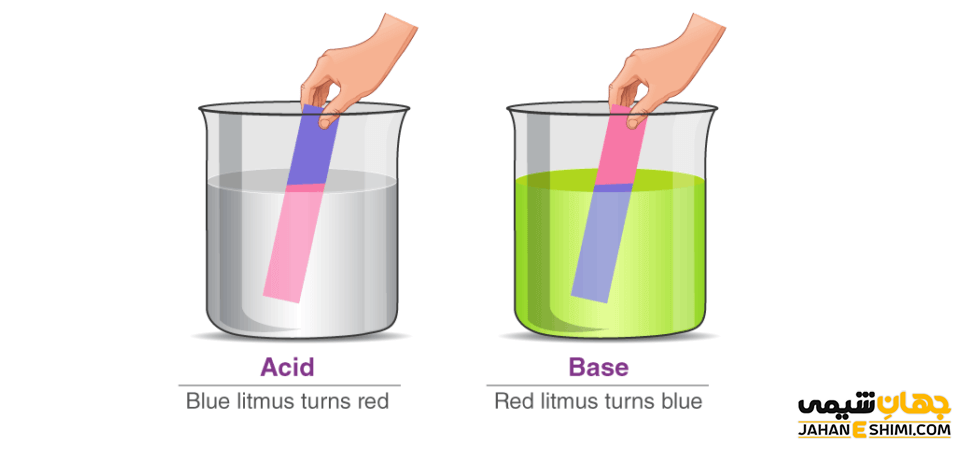
کاغذ تورنسل
از معمول ترین ابزار و وسایلی که در هر آزمایشگاه شیمی و … وجود دارد، کاغذ تورنسل است که به نام کاغذ لیتموس نیز خوانده می شود. دو رنگ آبی و قرمز در کاغذهای تورنسل دیده می شود که در محیط های اسیدی و بازی دچار تغییر رنگ می شوند. خیلی آسان و سریع، کاغذ تورنسل به ما کمک می کند تا محلول های اسیدی و بازی را از هم تشخیص دهیم. زیرا کاغذ لیتموس در محیط های اسید به رنگ قرمز و در محیط های بازی به رنگ آبی، تغییر رنگ می دهد.
شناساگر یونیورسال
از شناساگرهای دیگر، یونیورسال است که با داشتن چند محلول، مزیت مهمی دارد و آن داشتن محدوده وسیع و گسترده ای از PH است. در این شناساگرها ترکیبات مختلفی وجود دارد که هر کدام از آن ها، رنگ متفاوتی دارند. به عنوان مثال، متیل اورانژ به رنگ قرمز در PHهای پایین و به رنگ زرد در PHهای بالا در می آید. بازه و محدوده رنگی در این شناساگر، بین قرمز تا زرد در محیط اسیدی، رنگ سبز در محیط خنثی و رنگ آبی تا بنفش در محیط بازی است.
محاسبه PH با لگاریتم
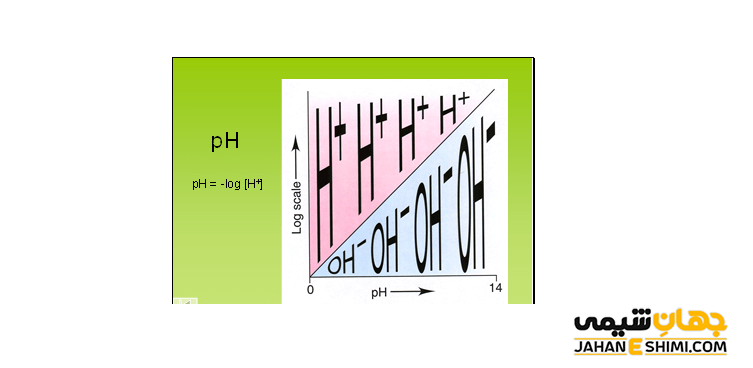
استفاده از لگاریتم، روشی در شیمی برای ساده کردن اعداد درک نشده است که می توان به طور راحت تری آن ها را با هم مقایسه کرد. لگاریتم به صورت رابطه بین pA و A بیان شده که به صورت معادله زیر نوشته می شود.
pA = -log [A]
به همین ترتیب اگر رابطه بین غلظت یون هیدروژن و پی هاش را بیان کنیم نیز به شکل زیر نوشته می شود.
pH = -log [H+]
در این معادله غلظت یون هیدروژن به صورت مولار بیان می شود که در تعریف به صورت تعداد مول های ماده حل شده در یک لیتر از محلول بیان می شود. به واحد غلظت مولار، مول بر لیتر نیز گفته می شود.
با توجه به رابطه گفته شده برای PH، می توان این رابطه را برای POH نیز به صورت زیر نوشت.
POH = -log [OH–]
محاسبه PH با کمک اکتیویته
همان طور که گفته شد برای محاسبه PH در یک محلول از غلظت یون هیدروژن استفاده می شود ولی به کار بردن این کمیت، از دقت کافی برخوردار نیست. به همین جهت برای این که محاسبه دقیق تری از PH داشته باشیم از اکتیویته و یا فعالیت یون هیدروژن استفاده می کنیم. رابطه ای که برای این منظور به کار برده می شود به صورت زیر نوشته می شود.
pH = -log (αH+)
فقط در محلول های رقیق است که میزان پی اچ اندازه گیری شده با آنچه که با استفاده از رابطه گفته شده برای محاسبه PH به دست می آید، برابر است. اما در دیگر محلول ها، این دو مقدار با هم یکی نیستند. علت این امر را می توان به یکی نبودن مقدار غلظت مولاریته یون هیدروژن با مقدار اکتیویته آن دانست.
رابطه بین PH و POH
با توجه به این که بازه PH برای محلول ها بین ۰ تا ۱۴است می توان رابطه زیر را نوشت.
PH + POH = 14
با استفاده از این رابطه که با کمک خودیونش آب به دست می آید می توان PH محلول های قلیایی را به دست آورد. در حل مسایل با استفاده از مقدار یکی از آن ها می توان مقدار عددی دیگر را به دست آورد.
محاسبه PH آنلاین
یکی از راه های محاسبه سریع و آسان PH، استفاده از برخی از وب سایت هاست. وب سایت های مختلفی برای این منظور استفاده می شوند. به عنوان مثال، وب سایت omnicalculater است که در آن می توان غلظت های مختلفی را برای محاسبه پی اچ اسیدها و بازها انتخاب کرد. وب سایت lattelog نمونه ی دیگری است که امکان محاسبه PH چند محلول با وارد کردن غلظت و حجم اولیه آن ها صورت می گیرد. وب سایت های aqion و planetcalc مثال های دیگری است.
مقدار PH مواد مختلف
این که بتوان PH بسیاری از مواد را اندازه گیری کرد، موضوع بسیار مهم و با اهمیتی است. زیرا با استفاده از این کمیت می توان بسیاری از بیماری ها را شناسایی کرده و بسیاری از مشکلات زیستی را برطرف کرد. به عنوان مثال، بخش های مختلف بدن انسان دارای PH های متفاوتی است که مقدار آن ها با توجه به مکان و نوع عملکرد آن ها متفاوت است. پی اچ اسید معده در بدن برابر با ۱,۵ تا ۳,۵ است که به دلیل نقش مهم معده در هضم غذا، اسیدی است. PH بالایی برابر با ۷,۳۴ تا ۷,۴۵ در خون نیز به دلیل انتقال اکسیژن در این بخش بدن است.
PH لیزوزم برابر ۴,۵، پوست برابر ۴,۷، ادرار برابر با ۶، سیتوزول برابر با ۷ بوده و بخش های دیگر نیز دارای PH های مختلف دیگر است. حفظ این شرایط PH در بدن بسیار مهم است که با فرایند هم ایستایی اسید – باز صورت می گیرد. اگر PH خون در حالت پایدار نماند، برخی از فرایندهایی چون اسیدوز و آلکالوز صورت می گیرد.
محاسبه ph شیمی دوازدهم
pH محلول معیاری است که نشان می دهد چقدر اسیدی یا بازی است. pH در مقیاس ۰ تا ۱۴ اندازه گیری می شود. pH یا پتانسیل هیدروژن یک معیار مهم در شیمی است که برای نشان دادن اسیدیته یا قلیایی بودن یک محلول استفاده می شود. در واقع غلظت یون هیدروژن (H+) را در محلول اندازه گیری می کند. pH عامل مهمی در بسیاری از واکنشهای شیمیایی است، به ما کمک میکند که محلول چقدر اسیدی یا بازی باشد، که به نوبه خود چگونگی واکنش مواد شیمیایی با یکدیگر را پیشبینی میکند. pH به طور قابل توجهی بر محیط زیست تأثیر می گذارد. pH یک شاخص اولیه برای کیفیت آب است، چه برای آب آشامیدنی یا زیستگاه های آبی، نظارت بر PH اطمینان حاصل می کند که آب برای استفاده مورد نظر ایمن است. درک pH در زمینه های مختلف، از شیمی و زیست شناسی گرفته تا علوم محیطی و مراقبت های بهداشتی ضروری است. PH محلول را به روش های زیر محاسبه کنیم:
– با استفاده از PH متر
با استفاده از گام های زیر می توانیم PH محلول را با کمک PH متر محاسبه کنیم:
مرحله ۱: کالیبره کردن pH متر: قبل از اندازه گیری pH متر با استفاده از محلول های بافر با pH شناخته شده کالیبره می شود.
مرحله ۲: الکترود pH را غوطه ور کنید: الکترود تمیز را در محلول قرار دهید.
مرحله ۳: پی اچ را بخوانید: PH متر PH محلول را نشان می دهد.
-با استفاده از نشانگرهای pH
با استفاده از مراحل زیر می توانیم PH محلول را با کمک نشانگرهای pH محاسبه کنیم:
مرحله ۱: انتخاب نشانگر: یک شاخص مناسب بر اساس محدوده pH مورد انتظار محلول انتخاب کنید.
مرحله ۲: افزودن اندیکاتور: چند قطره از نشانگر را به محلول اضافه کنید.
مرحله ۳: تغییر رنگ را مشاهده کنید: تغییر رنگ PH تقریبی محلول را بر اساس نمودار رنگ نشانگر نشان می دهد.



















