در علم شیمی، کربوکاتیون (Carbocation) به مولکول هایی گفته می شود که یک اتم کربن مثبت دارند. به بیان دیگر، کربوکاتیون یک یون آلی محسوب می شود که دارای یک اتم کربن با بار مثبت و سه پیوند شیمیایی است. مهمترین مشخصه آن، ناپایداری بسیار زیادش است، بنابراین فقط برای مدت زمان کوتاهی وجود دارد. از این رو، به همراه کربورادیکال ها و کربوآنیون ها، واسطه های مهم در واکنش های آلی هستند. یعنی به عنوان مراحل ضروری در زمان انجام مکانیسم های مولکولی در نظر گرفته می شوند. به عبارت دیگر می توان گفت که بسیاری از واکنش های آلی از مسیر یکی از این حد واسط ها (حد واسط در مسیر یک واکنش تولید و سپس دوباره مصرف می شود) می گذرد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی کربوکاتیون و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
مقدمه
همانطور که بیان شد، کربوکاتیون ها دارای بار مثبت هستند، بنابراین می توان به آنها کاتیون کربن نیز گفت. در گذشته، آنها با نام یون کربونیوم نامیده می شدند. بسته به ظرفیت اتم کربن، در دو دسته اصلی یون کربنیوم (۳+) و یون کربانیوم (۵+) تقسیم بندی می شوند.
این نامگذاری توسط جرج اندرو الاه (George Andrew Olah) پیشنهاد شده است. یون های کربنیوم (carbenium ion)، با یک طرح پیوند غیر محلی دو الکترونی سه مرکزی مشخص می شوند. در واقع با کربوکاتیون های غیرکلاسیک مترادف هستند، که این کربوکاتیون ها دارای پیوند های سیگمای پل زده C-C یا C-H می باشند. یون های کربنیوم اغلب به دلیل داشتن یک اکتت ناقص الکترون، بسیار واکنش پذیر هستند. با این حال، یون های کربنیوم خاص همچون یون تروپیلیوم (tropylium ion or cycloheptatrienyl cation) با فرمول مولکولی +[C۷H۷] به دلیل اینکه بار مثبت بین اتم های کربن جابجا می شود، نسبتا پایدار اند. از طرفی، اصطلاح یون کربانیوم (carbonium ion) را به عنوان آلکان های پروتونه شده یا آلکیله شده (+CR۵، که در آن گروه Rمی تواند هیدروژن یا آلکیل باشد)، تعریف کرده اند.
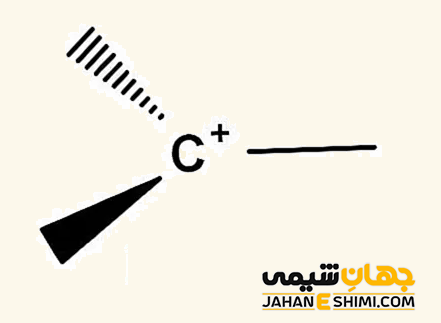
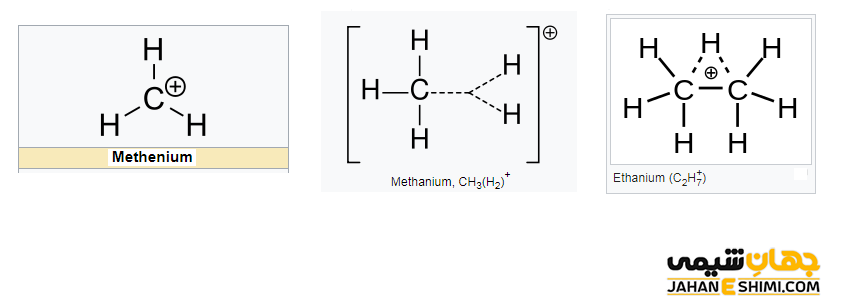
از جمله ساده ترین مثال های کربوکاتیون می توان به مولکول های متنیوم (+CH۳)، متانیوم (+CH۵)، کاتیون وینیل (+C۲H۳)، اتنیوم (+C۲H۵) و اتانیوم (+C۲H۷) اشاره کرد. جالب است بدانید که تعدادی از آنها حتی می توانند بیش از دو بار مثبت داشته باشند، مانند اتیلن دی کاتیون (+C۲H۴۲). همانطور که مشخص است، کربوکاتیون ها در لایه ظرفیت خود هشت الکترون ندارند (اتم کربن شش الکترونی)، بنابراین از قاعده هشت تایی پیروی نمی کنند. به همین دلیل (کامل نبودن تعداد الکترون های لایه والانس) بسیار ناپایدار و همانند رادیکال آزاد بسیار واکنش پذیر هستند.
هیبریداسیون کربوکاتیون
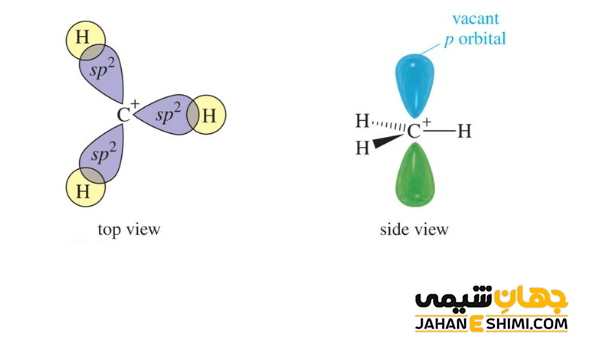
همانگونه که گفته شد، اتم کربن این ترکیبات یک کربن سه ظرفیتی است، از این رو هیبریداسیون sp۲ و شکل سه ضلعی مسطح دارد. از آنجاییکه بار مثبت دقیقا بر روی اتم کربن قرار گرفته است، پس در ساختار الکترونی آن، یک اوربیتال p خالی وجود دارد. بنابراین، کربوکاتیون ها با کمبود الکترون مواجه هستند، پس می توان نام الکتروفیل یا الکترون دوست را به آنها نسبت داد. کربوکاتیون ها می توانند در واکنش های حذفی و یا واکنش هایی با مکانیسم SN۱ شرکت کنند.
انواع کربوکاتیون ها
این دسته از ترکیبات آلی را می توان بر اساس تعداد اتم ها یا گروه های کربنی متصل به اتم کربن، به دسته های متیل، کربوکاتیون نوع اول، نوع دوم و نوع سوم تقسیم بندی کرد. در کاتیون متیل با فرمول شیمیایی +CH۳، هیچ گروه کربنی متصل به اتم کربن آن وجود ندارد. لازم به ذکر است که کاتیون متیل با نام های متنیوم (methenium)، متیلیم (methylium)، کاربنیوم (carbenium) و متیلن پروتونه شده (protonated methylene) نیز شناخته می شود. در کربوکاتیونهای نوع اول، نوع دوم و نوع سوم به ترتیب یک گروه آلکیلی، دو گروه و سه گروه آلکیلی به کربن با بار مثبت کربوکاتیون متصل شده اند.
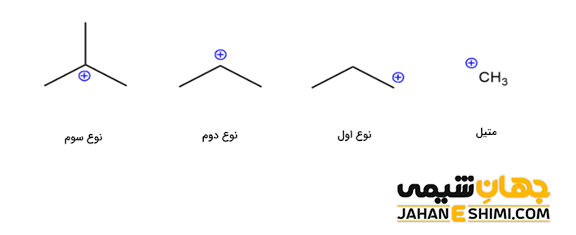
لازم به ذکر است که بسته به نوع گروه کربنی متصل به اتم کربن، این دسته از ترکیبات آلی، نام های مختلفی خواهند داشت. به عنوان مثال، اگر کربن با بار مثبت، جز یک حلقه بنزنی باشد، در این صورت به آن، کربوکاتیون آریل گفته می شود. در حالیکه اگر این کربن مثبت بلافاصله بعد از حلقه بنزنی قرار بگیرد، با نام کربوکاتیون بنزیلی خوانده می شود. کربوکاتیون آلیلی به حالتی گفته می شود که یک پیوند پای کربن- کربن در کنار اتم کربن با بار مثبت قرار گرفته است. حال اگر کربن مثبت، دقیقا به یک پیوند دوگانه متصل باشد، با نام کربوکاتیون وینیلی شناخته می شود (هیبریداسیون اتم کربن با بار مثبت به صورت sp بوده و شکل آن نیز خطی خواهد بود).
علاوه بر موارد ذکر شده، کربوکاتیون های هرمی نیز وجود دارند. یون های مورد بررسی در این دسته از ترکیبات، یک اتم کربن دارند که معمولا تمایل دارد در راس یک هرم چهار (دارای بار ۱+) یا پنج وجهی (دارای بار ۲+) قرار بگیرد.
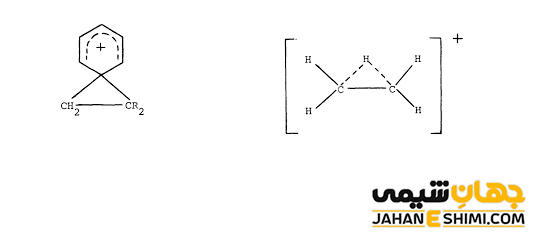
کربوکاتیون کلاسیک و کربوکاتیون غیر کلاسیک
دیدگاه کلاسیک در آغاز قرن بیستم مطرح بوده است. این دیدگاه بر این اساس استور است که کربن موجود در کربوکاتیونها شارژ را در خود دارند. در حالیکه بر طبق دیدگاه غیرکلاسیک، شارژ کربن بار مثبت می تواند به وسیله سایر اتم های مجاور به اشتراک گذاشته شود.
پایداری کربوکاتیون ها
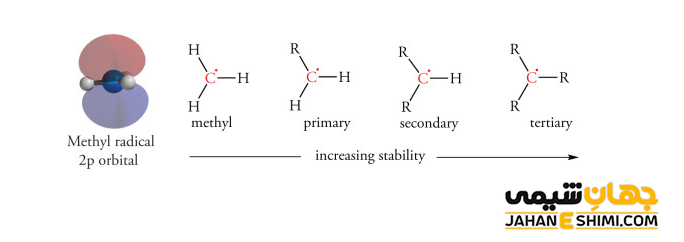
همانطور که بیان شد، کربوکاتیونها به خاطر کمبود الکترون، واکنش پذیری بسیار بالایی دارند. بنابراین، برای پایدار شدن نیازمند دریافت الکترون و در نتیجه تکمیل قاعده اوکتت هستند. به طور کلی، ترتیب پایداری کربوکاتیون های جایگزین آلکیل به این شکل است که کربوکاتون نوع سوم پایدارتر از کربوکاتیون نوع دوم، کربوکاتیون نوع دوم پایدارتر از کربوکاتیون نوع اول و در نهایت کربوکاتیون نوع اول پایدارتر از کربوکاتیون متیل می باشند. بر اساس سه فرآیند اضافه شدن یک هسته دوست یا نوکلئوفیل، تشکیل یک پیوند دوگانه و همچنین بازآرایی می توان به بررسی پایداری آنها پرداخت.
اضافه شدن یک هسته دوست
بار مثبت بر روی اتم کربن کربوکاتیون ها از طریق اضافه شدن یک گروه نوکلئوفیل به آنها پایدار می شود. در این صورت، یک پیوند کووالانسی جدید ایجاد می گردد. به بیان دیگر، نیاز به الکترون و تکمیل قاعده اوکتت رفع شده و سبب پایداری کربوکاتیون خواهد شد. جالب است بدانید که از آنجاییکه این دسته از ترکیبات آلی بسیار واکنش پذیر هستند، حتی یک هسته دوست ضعیف نیز می تواند به اتم کربن کربوکاتیون پیوند دهد.
تشکیل پیوند دوگانه
کربوکاتیون ها همچنین می توانند جهت حذف بار مثبت اتم کربن خود و تکمیل قاعده هشت تایی از اتم هیدروژن نزدیک به خود، الکترون بگیرند. بدین شکل یک پیوند دوگانه جدید تشکیل می شود. همانطور که می دانید، اتم هیدروژن بایستی به وسیله یک باز جدا شود. از آن جهت که کربوکاتیون ها بسیار واکنش پذیرند، بنابراین بازهای ضعیفی مثل آب یا حتی یون ید نیز می توانند واکنش پروتون زدایی یا دپروتوناسیون (Deprotonation) را انجام دهند. لازم به ذکر است که در چنین فرآیند هایی دو نوع محصول تولید می شود. فرآورده بیشتر، محصولی است که پایدارتر خواهد بود.
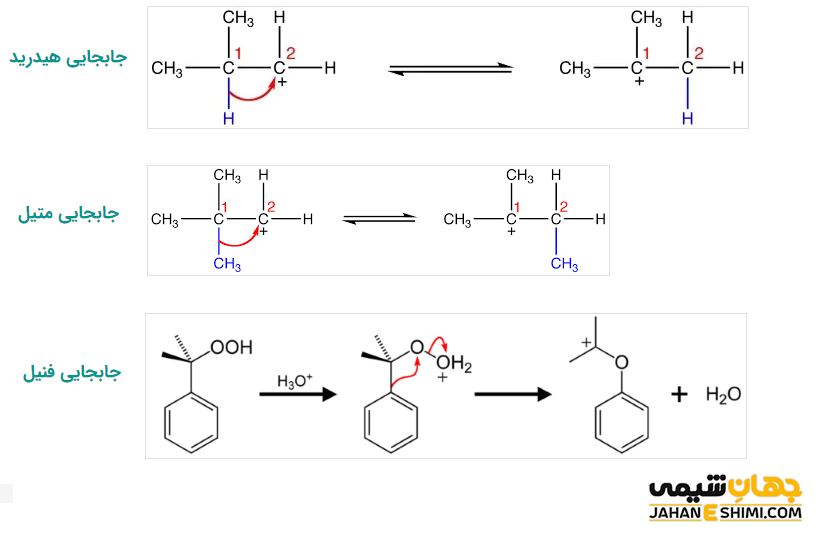
بازآرایی
کربوکاتیون ها با جابجایی الکترون های پیوندی خود در بین اتم های مجاور، باعث تشکیل کربوکاتیون پایدارتر می شوند. به طور مثال، یک کربوکاتیون نوع اول در طی بازآرایی به کربوکاتیون نوع دوم که پایدارتر است تبدیل می شود. از جمله انواع مختلف بازآرایی کربوکاتیون ها می توان به مواردی همچون جابجایی هیدرید، جابجایی متیل و جابجایی فنیل اشاره کرد. در بازآرایی هیدرید، هیدروژن از کربن اول به کربن دوم و در بازآرایی متیل، گروه متیل از کربن اول به کربن دوم جابجا می شود. در این صورت، کربوکاتیون از نوع اول به نوع دوم (نوع پایدارتر) تبدیل خواهد شد. به علاوه، در بازآرایی فنیل، با جابجایی گروه فنیل، کربوکاتیون پایدارتر نوع دوم یا سوم تشکیل می شود. دقت داشته باشید که که جابجایی گروه فنیل، نسبت به جابجایی گروه متیل، اولویت دارد.
عوامل موثر بر پایداری کربوکاتیون
عوامل مختلفی همچون رزونانس، اثر فوق مزدوج شدن، اثر القایی و الکترونگاتیوی بر پایداری این ترکیبات آلی تاثیر دارند. در ادامه مقاله به بررسی این عوامل می پردازیم.
رزونانس
رزونانس باعث پایداری کربوکاتیون ها می شود. در واقع، هرچه تعداد ساختار های رزونانسی بیشتر باشد، کربوکاتیون ها نیز پایداری بیشتری نشان خواهند داد. دلیل این پایداری در حقیقت در متمرکز نبودن بار مثبت است. در این حالت، بار مثبت مولکول بر روی یک یا دو اتم متمرکز نیست، بلکه بر روی قسمتی از مولکول یا حتی کل آن مولکول پخش می شود. در نتیجه تحمل کردن بار مثبت توسط مولکول راحت تر بوده و سبب پایداری بیشتر کربوکاتیون می گردد. به عنوان مثال می توان به کربوکاتیون های آلیلی و بنزیلی اشاره کرد. این کربوکاتیونها به دلیل داشتن ساختار رزنانسی و پخش بار، بسیار پایدارند. در حالیکه کربوکاتیون ونیلی، نا پایدارترین کربوکاتیون محسوب می شود. کاتیون وینیل در حقیقت یک کربوکاتیون با بار مثبت بر روی کربن آلکن است. در حقیقت کربن حامل بار مثبت بخشی از یک پیوند دوگانه بوده و هیبرید شده است.
اثر فوق مزدوج شدن
افزایش جانشینی باعث افزایش اثر فوق مزدوج شدن یا هيپرکانژوگاسيون (Hyperconjucation) و به دنبال آن افزایش پایداری خواهد شد. اثر فوق مزدوج شدن در واقع برهمکنش میان پيوند های σ و π است. زمانی چنين پدیده ای اتفاق می افتد که پيوند σ بتواند با اوربيتال های پيوند π و يا اوربيتال P در کربوکاتيون ها موازی قرار بگیرد تا امکان همپوشانی فراهم شود. بنابراین هرچه میزان فوق مزدوج شدن بیشتر باشد، پایداری نهایی نیز بیشتر خواهد بود. استدلال درباره پايداری بالای کربوکاتيون های نوع سوم، می تواند به خاطر امکان ۹ بار عمل هایپر کانجوگیشن پيوندهای σ با اربيتال های P كربوكاتيون باشد.
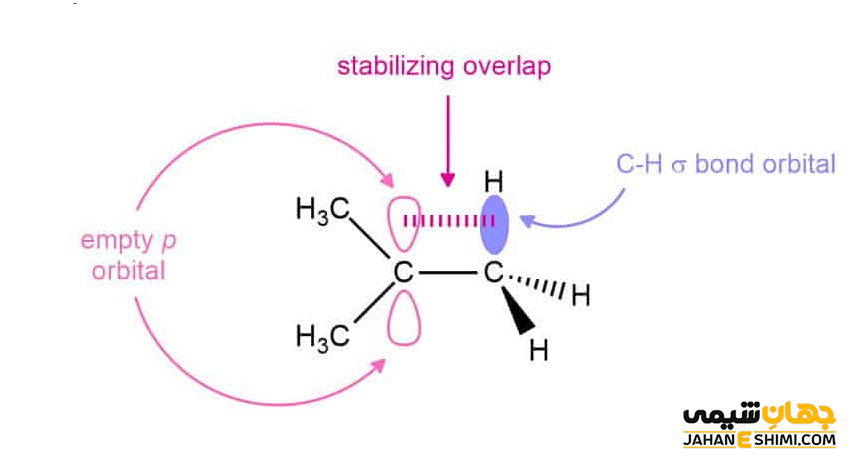
از طرفی دیگر، پایداری این دسته از ترکیبات آلی، به تعداد گروه های کربنی متصل به کربن با بار مثبت وابسته است. به عبارت دیگر، کربوکاتیون پر استخلاف تر از کربوکاتیون کم استخلاف تر، پایدار تر است. زیرا گروه های آلکیلی تمایل دارند که به اتم کربن مثبت الکترون بدهند. از این جهت، هرچه تعداد گروه های آلکیلی بیشتر باشد، دهش الکترون نیز بیشتر خواهد بود، بنابراین کربوکاتیون پایدارتر است. به طور کلی می توان گفت که گروه های الکترون دهنده کربوکاتیونها را پایدار می کنند، در حالیکه گروه های الکترون کشنده آنها را ناپایدار می کنند.
الکترونگاتیویته
الکترونگاتیویته اتم کربن با بار مثبت، به طور مستقیم بر روی پایداری کربوکاتیون ها اثر می گذارد. با افزایش الکترونگاتیوی اتم کربن، پایداری کربوکاتیون ها کاهش می یابد. همانطور که بیان شد، هیبریداسیون اتم کربن مثبت در کربوکاتیون های وینیلی به شکل sp می باشد. بنابراین، الکترونگاتیویته آن نسبت به هیبریداسیون sp۲ اتم کربن مثبت کربوکاتیون آلکیلی بیشتر است. پس کربوکاتیون های وینیلی نوع اول، پایداری کمتری نسبت به کربوکاتیون های آلکیلی نوع اول دارند. به همین ترتیب، کربوکاتیون های آریلی پایداری کمتری را در مقایسه با کربوکاتیون های آلکیلی نوع دوم نشان می دهند. لازم به ذکر است که به خاطر پایداری پایین کربوکاتیون های وینیلی و آریلی، این دو نوع را کمتر می توان پیدا کرد.
نحوه تشکیل کربوکاتیون ها
این ترکیبات از طریق شکستن پیوند کربن- اتم مجاور (شکاف هترولیتیک) و همچنین واکنش افزایشی الکترون دوستی بوجود می آیند.
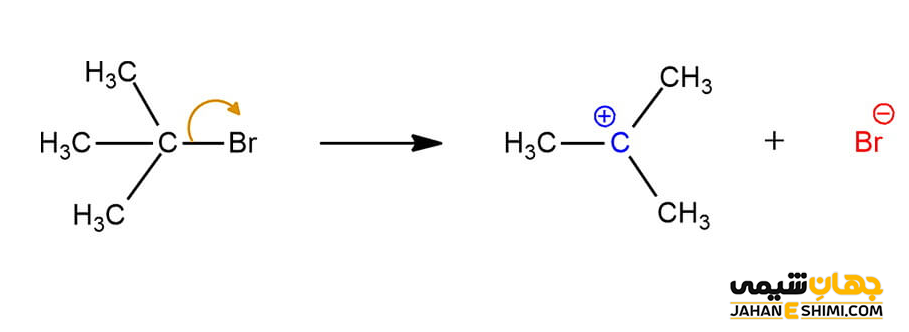
شکست پیوند کربن
زمانیکه پیوند بین کربن و اتم های متصل به آن شکسته شود، در این صورت گروه ترک کننده، الکترون های اشتراکی را با خود می برد و اتم کربن فقیر از الکترون باقی می گذارد. بنابراین، کربوکاتیون با بار مثبت تشکیل می شود. جالب است بدانید که در بسیاری از واکنش های آلی مانند مکانیسم های E1 و SN۱، کربوکاتیون به عنوان محصول فرعی واکنش، ایجاد می گردد.
واکنش افزایشی الکترون دوستی
در یک واکنش افزایشی الکترون دوستی، در حقیقت یک الکتروفیل به مرکز غیر اشباع مولکول (مانند پیوند دوگانه یا سه گانه) حمله می کند. در نتیجه این واکنش، پیوند دوگانه یا سهگانه شکسته شده و یک کربوکاتیون تشکیل می گردد. دقت داشته باشید که به دلیل پایداری، تشکیل کربوکاتیون نوع دوم بر تشکیل کربوکاتیون نوع اول، اولویت دارد. لازم به ذکر است که تشکیل کربوکاتیون پایدارتز از قانون مارکونیکوف نیز پیروی می کند. چنین واکنش های افزایشی الکتروفیلی را می توان در آلکن ها، آلکین ها و یا حلقه های بنزنی دید. از جمله رایج ترین آنها می توان به هیدروژنه شدن آلکن ها تبه وسیله یک اسید اشاره کرد.

واکنش های کربوکاتیون ها
کربوکاتیون به عنوان یک مرکز مثبت تمایل دارد تا با ترکیبات دارای الکترون یا بار منفی که ترکیبات هسته دوست یا نوکلئوفیل (Nucleophile) نامیده می شوند، واکنش دهد. در واقع، هیبریداسیون sp۲، آن را در مقابل حمله گروه های غنی از الکترون بسیار آسیب پذیر می کند. این ترکیب آلی یک گونه بسیار اسیدی است، زیرا وجود بار مثبت آن باعث می شود که برای رسیدن به حالت پایدار، الکترون ها یا اتم های هیدروژن را از خود جدا کند. از این جهت که کربوکاتیون یک گونه بسیار واکنش پذیر محسوب می شود، بنابراین بعد از مدت کوتاهی از تشکیلش (در عرض چند نانو ثانیه)، واکنش می دهد تا محصول واقعی آن واکنش شیمیایی ایجاد گردد.