خواص عنصر گادولینیم چیست؟ کاربرد گادولینیوم را می شناسید؟

عنصر گادولینیم از عناصر شیمیایی جدول تناوبی مندلیف بوده و با نشان شیمیایی Gd شناخته میشود. عدد اتمی عنصر گادولینیم ۶۴ و عدد جرمی آن ۱۵۷.۲۵ است. عنصر گادولینیم از عناصر واسطه داخلی بوده و در دسته لانتانید ها جای دارد. خواص عنصر گادولینیم موجب شده تا در گروه ۳ و تناوب ۶ جدول تناوبی عناصر جای بگیرد. از خواص عنصر گادولینیم می توان به مغناطیسی بودن آن در دما های پایین اشاره نمود. از کاربرد عنصر گادولینیم میتوان به کاربرد به عنوان کاتالیزور و ماده حاجب در MRI اشاره نمود. ترکیبات عنصر گادولینیم وجود داشته و هر کدام خصوصیات و کاربردهای خاصی دارند. ایزوتوپ عنصر گادولینیم نیز شناخته شده و در ادامه این مقاله بررسی خواهد شد. خصوصیات ابر رسانایی از دیگر خواص عنصر گادولینیم بشمار می آید. در ادامه با معرفی این ماده کمیاب همراه ما باشید.
نشریه علمی جهان شیمی فیزیک به بررسی عناصر شیمیایی جدول تناوبی پرداخته است. عناصری مانند: پرومتیم، ساماریم، یوروپیم، کربن، نیتروژن و… . با ما با شناخت بیشتر این عناصر باارزش همراه باشید.
پیشینه عنصر گادولینیم
در سال ۱۸۸۰ دانشمند و شیمیدانی سوئیسی برای مشاهده گادولینیم در نمونههای دیدیمیم و گادولینیت به بررسی خطوط طیف سنجی پرداخت. در سال ۱۸۸۶ دانشمندی فرانسوی گادولینیا را (اکسید گادولینیم) جداسازی نمود. خود این عنصر نیز اخیرا برای اولین بار تهیه شده است. نام عنصر گادولینیم مانند کانی گادولینیت از نام Johan Gadolin شیمیدان و زمین شناس فنلاندی گرفته شده است.
منابع گادولینیم
عنصر گادولینیم را هرگز نمی توان در طبیعت به صورت آزاد یافت. این ماده در بسیاری از کانی ها مانند گادولینیت، مونازیت و باستنازیت یافت می شود. امروزه با روش جابجایی یونی و جداسازی از حلال و با کاهش فلورید بی آب این ماده توسط کلسیم فلزی تهیه میکنند.
تولید گادولینیم
ابتدا مواد معدنی خرد شده و با اسید کلریدریک یا اسید سولفوریک استخراج می شوند. اکسید های محلول به کلرید های محلول یا سولفات تبدیل می شوند. سپس فیلتر های اسیدی با سود سوز آور به pH برابر با ۳ تا رسانده می شوند. توریم به شکل هیدروکسید خود رسوب کرده و سپس خارج می شود.
در مرحله بعد محلول باقیمانده با اگزالات آمونیوم آمیخته شده تا دانه های مواد نادر به اگزالات های محلول تبدیل شوند. اگزالات ها با حرارت دادن به اکسید تبدیل می شوند. سپس اکسید ها در اسید نیتریک حل و یکی از اجزای اصلی، سریم را که اکسید آن در HNO۳ نامحلول است، حذف می کند. این محلول با نیترات منیزیم تصفیه شده و مخلوط متبلوری از نمک های گادولینیم، ساماریوم و یوروپیم تولید می گردد. نمک های تولید شده توسط کروماتوگرافی تبادل یونی جدا می شوند.
در نهایت یون های کمیاب توسط یک ماده کمپلکس کننده مناسب و به طور انتخابی شسته می شوند.
فلز گادولینیم از طریق اکسید یا نمک هایش، با گرم کردن با کلسیم در ۱۴۵۰ درجه سانتی گراد در جو آرگون نیز به دست می آید.
عنصر گادولینیوم اسفنجی را با کاهش ترکیب GdCl۳ مذاب با یک فلز مناسب در دمای زیر ۱۳۱۲ درجه سانتی گراد و در فشار کاهش یافته تولید کرد.
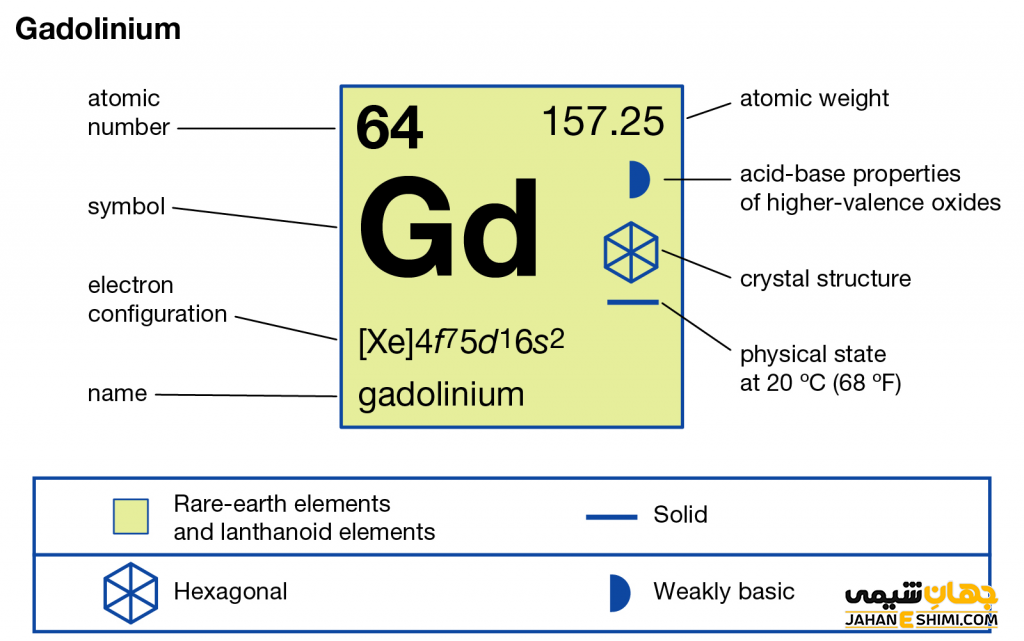
ویژگی عنصر گادولینیم عنصر شماره ۶۴ جدول تناوبی
- عدد اتمی: ۶۴
- عدد جرمی (جرم اتمی): ۱۵۷.۲۵
- گروه: ۳
- تناوب: ۶
- نقطه ذوب: ۱۳۱۲ درجه سانتی گراد
- نقطه جوش: ۳۲۷۳ درجه سانتی گراد
- چگالی: ۷.۹۰ گرم بر سانتی متر مکعب
- شعاع اتمی: ۱۸۰ pm
- رنگ: سفید نقره ای
- حالت استاندارد (شرایط STP): جامد
- شعاع کووالانسی: ۱۹۶
- الکترونگاتیویته: ۱.۲ مقیاس پائولینگ
- آنتالپی تبخیر: ۳۰۱٫۳ کیلوژول بر مول
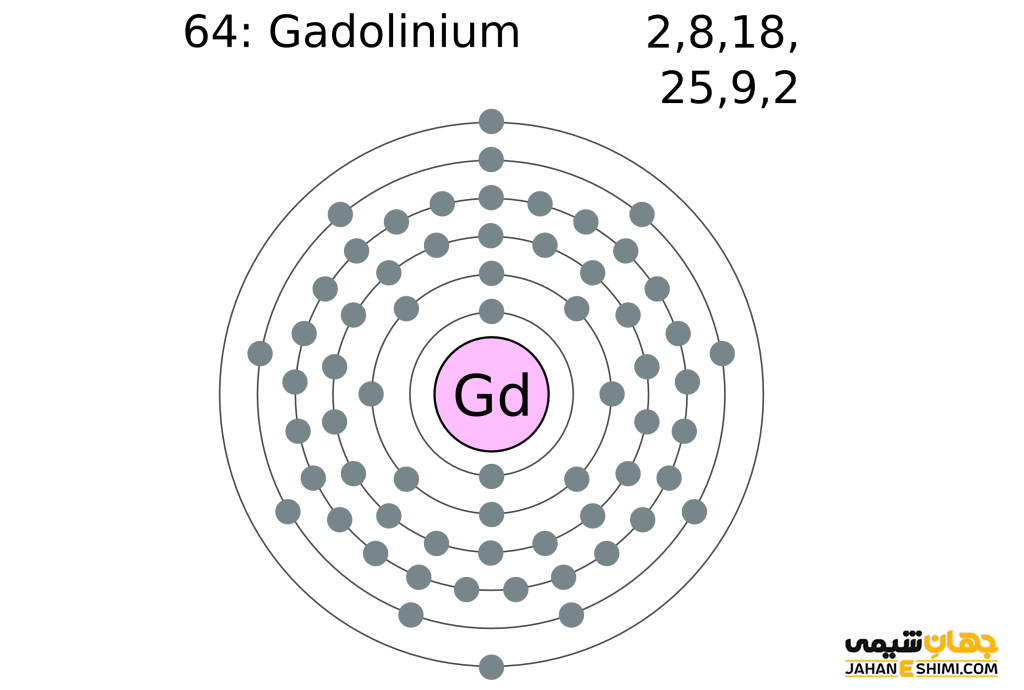
- آرایش الکترونی: [Xe] 4f۷ ۵d۱ ۶s۲
- دسته: لانتانید ها
لانتانید ها شامل ۱۴ عنصر فلزی هستند. این عناصر فلزاتی براق با واکنش پذیری بالا هستند. خواص این عناصر مشابه خواص لانتان ۵۷ است. این عناصر نمک های سه ظرفیتی محلول در آب با خواص شیمیایی یکسانی را ایجاد می کنند. این عناصر قابل احیا شدن هستند. با استفاده از اثر کلسیم و لیتیم بر هالید بدون آب این کار صورت می پذیرد. در مرحله بعد آن را در خلأ ذوب مجدد نموده تا باقیمانده مواد احیا کننده تبخیر شود. همچنین این مواد را می توان از حمام های نمک ذوب شده به صورت الکترولیتی نیز احیا کرد. همچنین لانتانید ها با برخی ترکیبات آلی نیز می توانند املاح آلی تشکیل دهند.
لانتانید ها با نام خاک های کمیاب نیز شناخته می شوند. علت این نام گذاری این است که اولین اعضای لانتانید ها که به صورت اکسید جمع آوری شد، شبیه به اکسید های کلسیم و منیزیم (بعد ها در گروه فلزات قلیایی خاکی قرار گرفتند) بودند. لانتانید ها را در کانی هایی چون مونازیت، زنوتیم و گادولینیت در طبیعت می توان یافت.
خواص عنصر گادولینیم
از خواص عنصر گادولینیوم این است که بر خلاف سایر عناصر خاکی کمیاب در هوای خشک پایدار است. اما این عنصر در هوای مرطوب به سرعت کدر شده و اکسید چسبنده و ناپایداری تولید می کند. این اکسید منتشر شده و در معرض سطح بیشتری برای اکسیداسیون قرار می گیرد. دیگر خواص گادولینیم این است که به آرامی با آب واکنش داده و در اسید های رقیق نیز محلول است.
این عنصر بالا ترین واکنش سنجی جذب حرارتی نوترون را در بین تمامی عناصر شناخته شده داراست. تنها سوخت سریع آن است که کاربرد عنصر گادولینیم را در میله کنترل هسته ای محدود می نماید.
لازم به ذکر است که عنصر گادولینیوم در شرایط خاصی می تواند به یک ابررسانا تبدیل شود. این ماده در دمای اتاق شدیداً مغناطیسی است. به جز فلزات واسطه دوره چهارم، این ماده تنها فلزی است که خصوصیات فرومغناطیسی را از خود بروز می دهد. گادولینیوم فلزی به رنگ سفید نقره ای، شکل پذیر و دارای خواص پارامغناطیس است. برای شناخت بیشتر این عنصر می توانید از مدل اتمی بور برای عنصر گادولینیم استفاده کنید.
ترکیبات
از ترکیبات این عنصر فلزی واسطه می توان به موارد زیر اشاره نمود:
- دی هیدرید گادولینیم GdH۲ و تری هیدرید گادولینیم GdH۳
- اکسید گادولینیم Gd۲O۳
- کلرید گادولینیم GdCl۳
ایزوتوپ عنصر گادولینیم
عنصر گادولینیم دارای ۵ ایزوتوپ پایدار طبیعی است. این ایزوتوپ ها شامل ایزوتوپ ۱۵۴Gd، ۱۵۵Gd، ۱۵۶Gd، ۱۵۷Gd و ۱۵۸Ga هستند. این ماده دو رادیو ایزوتوپ طبیعی نیز دارد. ایزوتوپ گادولینیوم-۱۵۲ و ایزوتوپ گادولینیوم -۱۶۰ رادیو ایزوتوپ طبیعی این ماده هستند. در بین این ایزوتوپ ها ۱۵۸Ga فراوان ترین آن هاست و فراوانی طبیعی برابر با ۲۴,۸۴ درصد دارد. از ۳۰ رادیو ایزوتوپ این عنصر که شناخته شده است، پایدارترین آن ها گادولینیم -۱۶۰، گادولینیم -۱۵۲ و گادولینیوم-۱۵۰ می باشد.
سایر ایزوتوپ های این ماده نیمه عمری کمتر از ۷/۷۴ سال دارند. بیشتر ایزوتوپ ها نیز دارای نیمه عمرهایی کمتر از ۲۴,۶ ثانیه هستند. همچنین این عنصر دارای چهار meta states است. حالت فروپاشی اولیه قبل از فراوان ترین ایزوتوپ پایدار گادولینیم-۱۵۸ جذب الکترون است. حالت اولیه پس از آن نیز فروپاشی منفی بتا است. محصولات فروپاشی اولیه قبل از گادولینیم-۱۵۸ ایزوتوپ های عنصر Eu (یوروپیم) است و محصولات اولیه پس از آن ایزوتوپ های عنصر Tb (تربیم) هستند.
کاربرد عنصر گادولینیم
کاربرد عنصر گادولینیم در ساخت سنگ های ایتریم گادولینیم در مایکروویو صورت می گیرد.
کاربرد ترکیبات عنصر گادولینیم نیز در ساخت مواد فروزنده لامپ تصویر تلویزیون های رنگی به کار می رود.
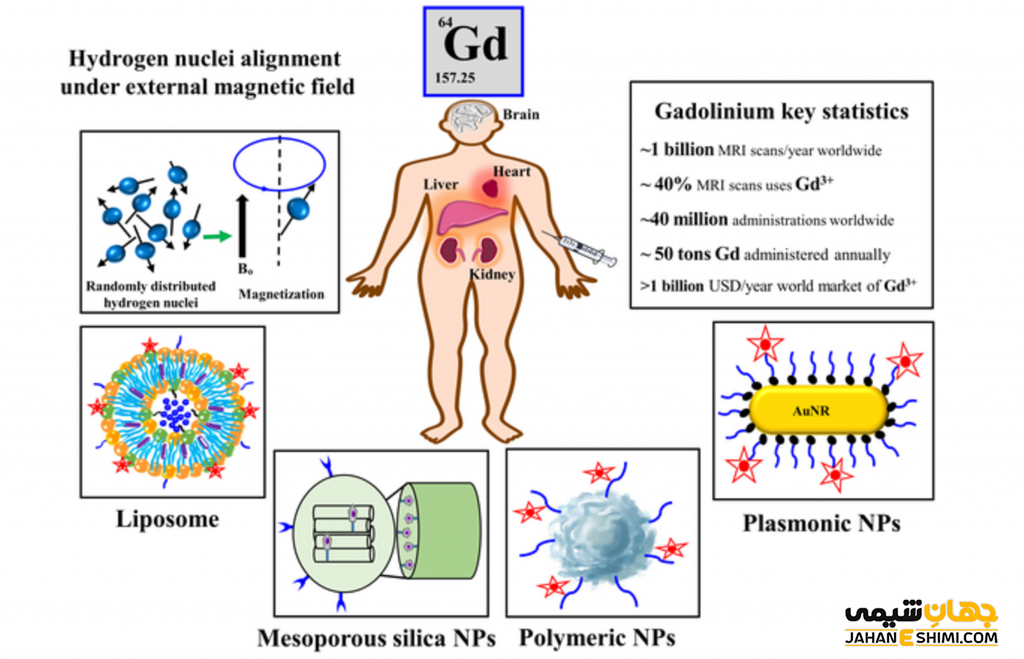
محلول ترکیبات گادولینیم به عنوان پاد نمای داخل وریدی جهت ارتقا تصاویر از بیماران تحت MRI مورد استفاده قرار می گیرد.
ترکیبات عنصر گادولینیم در تصویربرداری تشدید مغناطیسی (MRI)، به ویژه در تشخیص تومورهای سرطانی مفید است.
این ترکیبات در جذب نوترون نیز بسیار عالی هستند. بنابراین در هسته راکتور های هسته ای استفاده می شود.
کاربرد عنصر گادولینیوم در تولید انواع CD و حافظه کامپیوتر نیز وجود دارد.
از خواص عنصر گادولینیم خصوصیات ابررسانایی غیر عادی آن است. مقدار ۱% گادولینیوم، باعث افزایش کارآمدی و مقاومت آهن، کروم و آلیاژ های مربوط در دما های بالا و اکسیداسیون می شود.
احتمال استفاده از اتیل سولفات گادولینیوم که مشخصات پارازیت بسیار کمی دارد نیز در مایزرها وجود دارد.
جنبش مغناطیسی زیاد عنصر گادولینیوم و دمای کوری آن که تنها در حرارت اتاق وجود دارد، استفاده از آن را به عنوان جز مغناطیسی جهت حسگر گرما و سرما را مطرح می کند.
خطرات عنصر گادولینیم
یون عنصر گادولینیم به عنوان یون آزاد اغلب بسیار سمی خواهد بود. لازم به ذکر است که عوامل حاجب MRI ترکیبات کلاته هستند و ایمنی کافی برای آن ها در نظر گرفته شده است. سمیت یون های گادولینیوم آزاد در حیوانات به دلیل تداخل در تعدادی از فرآیند های وابسته به کانال یون کلسیم است.
دوز کشنده این ماده حدود ۱۰۰ تا ۲۰۰ میلی گرم در کیلوگرم است. به دنبال قرار گرفتن در معرض دوز کم یون گادولینیم (گادولینیوم) سمیت خاصی گزارش نشده است. مطالعات سمیت در جوندگان نشان می دهد که کلات گادولینیوم (که باعث بهبود حلالیت آن نیز می شود) سمیت آن را نسبت به یون آزاد حداقل تا ۱۰۰ برابر کاهش می دهد.
درواقع اعتقاد بر این است که سمیت بالینی عوامل کنتراست مبتنی بر گادولینیوم در انسان، به قدرت ماده شیمیایی وابسته است. البته تحقیقات همچنان ادامه دارد. بر اساس حدود دوازده عامل مختلف، کلاتور Gd به عنوان ماده حاجب MRI در سراسر جهان تایید شده است.
سخن آخر
عناصر مختلفی در جدول تناوبی مندلیف قرار گرفته اند که از هر کدام می توان استفاده خاصی نمود. توجه شود که این عناصر از لحاظ خواص فیزیکی و شیمیایی با یکدیگر متفاوتند. اغلب عناصری که در یک گروه از جدول تناوبی قرار گرفته اند خواص مشابهی دارند. برای شناخت بیشتر عناصر شیمیایی می توان به جدول تناوبی مندلیف مراجعه نمود. در جدول مندلیف تمام عناصر جایگاه مخصوص به خود را دارا هستند. با شناخت بهتر خواص عناصر جدول تناوبی می توان بهتر به کاربرد و ویژگی عناصر پی برد. درواقع با شناخت دقیق عناصر، کاربرد صنعتی و سلامت و پزشکی و کشاورزی و… آن ها امکان پذیر خواهد شد. دانشمندان از گذشته تا اکنون تلاش های بسیاری در شناخت هرچه بیشتر این عناصر داشته اند.
توجه شود که عناصر جدول تناوبی حالت های مختلفی را نیز دارند. برخی از عناصر این جدول فلز و برخی دیگر نافلز و برخی هم شبیه فلزند. برخی از عناصر گازی شکل و برخی دیگر جامدند. این خواص متفاوت، بررسی و شناسایی دقیق این عناصر را به امری بسیار ضروری مبدل ساخته است. البته عناصر شیمیایی ضمن فوایدی که برای بشر دارند، در صورت استفاده نادرست می توانند خطر آفرین نیز باشند.
نشریه علمی جهان شیمی فیزیک به دلیل اهمیت بالای شناخت عناصر در زندگی روزمره به توضیح و بررسی خواص و کاربرد عناصر پرداخته است. برای آشنایی با خواص و کاربرد و پیشینه عناصر شیمیایی جدول تناوبی می توان به سایت نشریه علمی جهان شیمی فیزیک مراجعه نموده و اطلاعات خود در این زمینه را افزایش دهید.




















very good excelent