
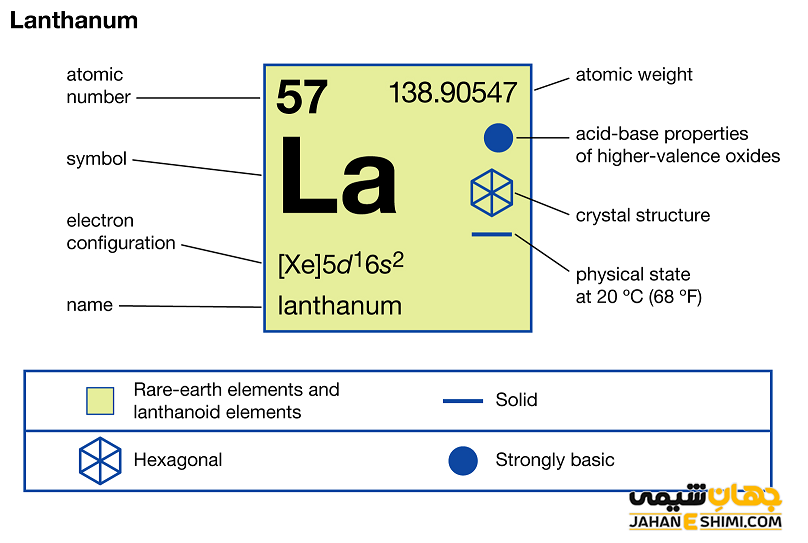
عنصر لانتان (Lanthanum) با نماد شیمیایی La، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۵۷ می باشد. این عنصر در حقیقت پنجاه و هفتمین عنصر از جدول تناوبی بوده که در گروه IIIB و دوره ششم جدول تناوبی قرار دارد. در واقع عنصر لانتان یک فلز واسطه (Transition Metals) نرم به رنگ سفید- نقره ای و از عناصر گروه لانتانید ها است. این فلز با عناصر اسکاندیم (Sc)، ایتریم (Y) و آکتینیوم (AC)، در گروه سوم واسطه جدول تناوبی قرار گرفته است. دقت داشته باشید که این عنصر با نام های لانتانم، لانتانیم و یا لانتانیوم نیز شناخته می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر لانتانم پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تاریخچه کشف عنصر لانتان
۲- پیدایش و منابع عنصر شماره ۵۷ جدول تناوبی
۳- ویژگی های فیزیکی و شیمیایی عنصر لانتان
۱-۳- لانتانید ها
۴- ایزوتوپ های عنصر لانتان
۵- کاربرد های عنصر لانتان
۶- ترکیبات عنصر لانتان
۷- خطرات لانتانیم بر روی سلامتی انسان
تاریخچه کشف عنصر لانتان
عنصر لانتان برای اولین بار در سال ۱۸۳۹ میلادی، توسط شیمیدان سوئدی کارل گوستاف موسندر (Carl Gustaf Mosander) به عنوان نا خالصی در نیترات سریم کشف شد. زمانیکه آقای موسندر، نمونه ای از نیترات سریم را به صورت جزئی تجزیه می کرد، به کمک گرم کردن و همچنین افزودن نمک حاصله به اسید نیتریک رقیق، موفق به کشف عنصر لانتانیم شد. در واقع وی توانست عنصر خاکی کمیابی را از محلول حاصله جداسازی کند. واژه لانتان از کلمه یونانی لانتانین (lanthanein) به معنی مخفی ماندن، دروغ پنهان و یا گمراه شدن گرفته شده است. لازم به ذکر است که این عنصر به شکل نسبتا خالص در سال ۱۹۲۳ میلادی تهیه شد.

پیدایش و منابع عنصر شماره ۵۷ جدول تناوبی
همانطور که بیان شد، این عنصر در گروه عناصر کمیاب زمین قرار دارد. با این وجود، عنصر لانتان بیست و هشتمین عنصر فراوان در پوسته زمین محسوب می شود. در واقع و به طور تقریبی چیزی حدود سه برابر عنصر سرب می باشد. این عنصر در کانی های کمیابی همچون سریت، مونازیت، آلانیت و باستنازیت پیدا می شود. توجه داشته باشید که کانی های مونازیت (Ce, La, Th, Nd, y, PO۴) و باستنازیت (Ce, La, Y, CO۳F) از مهمترین کانی ها محسوب می شوند که درصد وجود لانتانیوم در آنها به ترتیب ۲۵ و ۳۸ درصد است.
دسترسی به لانتان و دیگر عناصر کمیاب در سال های اخیر بسیار پیشرفت کرده است. این فلز را می توان با کاهش فلورید همراه کلسیم تهیه نمود. همانطور که بیان شد، این عنصر فراوان ترین عنصر خاکی کمیاب است که در کشور های برزیل، هند، استرالیا و آفریقا پیدا می شود.
ویژگی های فیزیکی و شیمیایی عنصر لانتان
عنصر لانتان، فلزی چکش خوار، نرم و انعطاف پذیر است که به راحتی با چاقو بریده می شود. این عنصر دارای قابلیت شکل پذیری بالایی است. از این رو، می تواند به راحتی به شکل های مختلف تغییر کند. از آنجاییکه قابلیت چکش خواری بالایی نیز دارد، پس می تواند به راحتی به ورقه هایی صاف تبدیل شود. به علاوه، لانتانیم رسانای خوبی از گرما و الکترسیته می باشد. این عنصر زمانیکه که در معرض هوا قرار می گیرد، به آرامی لکه دار می شود. از طرفی، در معرض هوا به سرعت اکسید می گردد. همچنین در هوای مرطوب خورده می شود. به علاوه، آب سرد به آهستگی، اما آب داغ به سرعت عنصر لانتانیم را مورد حمله قرار می دهند.
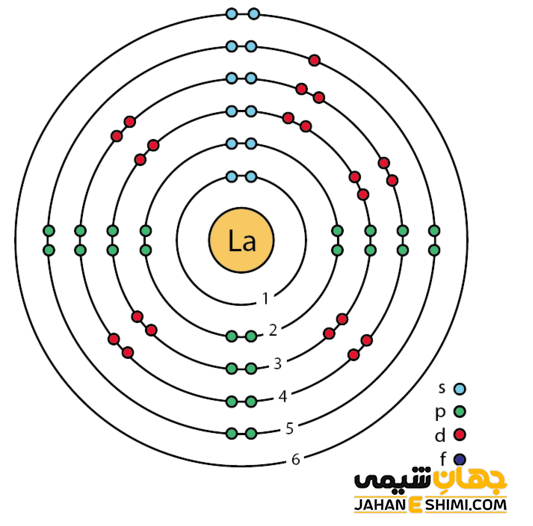
خصوصیات قابل توجه لانتان از ساختار اتمی آن ([Xe] 5d۱۶s۲) ناشی می شود. همانطور که مشخص است، اوربیتال d لایه ماقبل آخر در این عنصر در حال پر شدن است. این عنصر به واسطه آرایش الکترونی که دارد، در دسته فلزات واسطه قرار می گیرد. فلزات واسطه در حقیقت بین فلزات قلیایی خاکی (گروه دوم) و عناصر گروه بور در جدول تناوبی قرار گرفته اند. به عناصر واسطه، عناصر گروه B نیز گفته می شود. لازم به ذکر است که به لانتانید ها و اکتینید ها عناصر واسطه داخلی گفته می شود. با توجه به آرایش الکترونی مشخص است که سه الکترون در دورترین لایه الکترونی لانتانیوم وجود دارد. پس در بیشتر ترکیبات به صورت کاتیون سه بار مثبت (La۳+) ظاهر مي شود. در واقع، حالت اکسیداسیون آن بیشتر ۳+ است. از این رو می تواند در سه پیوند کووالانسی شرکت کند.
جالب است بدانید که
عنصر لانتانیوم یکی از واکنش پذیر ترین فلزات خاکی کمیاب محسوب می شود. بنابراین، با کربن، نیتروژن، بور، سیلیکون، سلنیوم، فسفر، گوگرد و هالوژن ها واکنش می دهد. این عنصر همچنین در اسید ها محلول است. در حالیکه در واکنش با آب، لانتان هیدروکسید و هیدروژن می دهد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۹۲۰ و ۳۴۶۴ درجه سانتی گراد است.
- عنصر لانتان پارا مغناطیس است.
- ساختار بلوری آن به شکل شش گوشه یا هگزاگونال (Hexagonal)است. توجه داشته باشید که لانتانیم در دمای ۳۱۰ درجه سانتی گراد از فرم هگزاگونال به کوبیک توپر تغییر فرم می دهد. اما در دمای ۸۶۵ درجه سانتی گراد دوباره به صورت کوبیک توخالی می شود.
- این عنصر آلوتروپ ندارد.
- جرم اتمی لانتان برابر با ۱۳۸.۹۰۵۵ g/mol است.
- چگالی آن نیز برابر با ۶.۱۶۲ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با ۲/۷۴ آنگستروم می باشد.
- یون های لانتان معمولا عدد اکسایش برابر با اعداد ۰، +۱،+۲ و +۳ دارند. در حقیقت یک اکسید بازی قوی محسوب می شود. اعداد اکسایش ۰ و +۳ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۵۳۸.۱ kJ/mol است.
لانتانید ها
واژه لانتانید (Lanthanide) به معنای شبیه لانتانیوم است که به طور کلی با نماد شیمیایی Ln نمایش داده می شود. همانطور که مشخص است، نام این دسته از عناصر، از فلز لانتان برگرفته شده است. لانتانید ها در واقع شامل ۱۵ عنصر با عدد های اتمی ۵۷ تا ۷۱ است. به دلیل کمبود جا در جدول تناوبی و برای اینکه نظم و ترتیب جدول حفظ شود، این گروه از عناصر در یک ردیف ۱۴ تایی در پایین جدول قرار گرفته اند. تمامی لانتانید ها به جز لانتان جز بلوک f هستند. لانتانیم جز بلوک d جدول تناوبی محسوب می شود، اما خواص آن شبیه به چهارده لانتانید دیگر خواهد بود.
۴f، اولین زیر لایه ای است که در بلوک f پر می شود. این زیر لایه در حقیقت بعد از زیر لایه ۶s شروع به پر شدن می کند. همانطور که می دانید ۷ اوربیتال بلوک f می توانند تا چهارده الکترون را در خود جای دهند. از این رو، این بلوک میتواند شامل ۱۴ عنصر است. بنابراین این گروه با فلز لانتانیوم (۴f۰۵d۱۶s۲) آغاز و به فلز لوتتیم (۴f۱۴۵d۱۶s۲) ختم می شود.
توجه داشته باشید که عملا نمی توان عنصر لانتانیم را یک لانتانید دانست. اما آیوپاک به دلیل استفاده رایج آن، این عنصر را نیز در دسته لانتانید ها قرار داده است. لانتان در واقع سومین ماده فراوان در بین لانتانید ها است که در واقع ۳۹ میلی گرم در کیلوگرم از پوسته زمین را تشکیل می دهد. لانتان را می توان یک فلز خاکی کمیاب در نظر گرفت، چون فرآیند استخراج آن دشوار، وقت گیر و بسیار گران است.
ایزوتوپ های عنصر لانتان
همانطور که می دانید، ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر لانتان ایزوتوپ های فراوانی دارد. لانتانیمی که در طبیعت وجود دارد دارای دو ایزوتوپ ۱۳۹La (99.91 %) پایدار و ۱۳۸La (0.09 %) رادیواکتیو می باشد. همانطور که مشاهده می کنید، ۱۳۹La به تنهایی ۹۹.۹۱ درصد فراوانی طبیعی این عنصر را شامل شده است.
علاوه بر آن، ۳۱ ایزوتوپ پرتوزای لانتان نیز شناخته شده است. پایدارترین رادیوایزوتوپ های لانتان ۱۳۸La با نیمه عمر ×۱۰۱۱ ۱.۰۵سال و ۱۳۷La با نیمه عمر ۶۰۰۰۰ می باشند. بقیه رادیو ایزوتوپ های آن، نیمه عمری کمتر از ۲۴ ساعت دارند. لازم به ذکر است که حتی نیمه عمر بیشتر آنها کمتر از یک دقیقه است. عنصر شماره ۵۷ جدول تناوبی دارای سه حالت متا (m) نیز می باشد. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های ۱۲۰ تا ۱۵۲ می باشند.
کاربرد های عنصر لانتان
اولین کاربرد تاریخی عنصر لانتان در فانوس های گازی بوده است. از استفاده های مدرن آن می توان به موارد سوخت محرک موشک ها، ساخت سوخت هواپیما، قطار و اتومبیل ها اشاره کرد. ترکیبات لانتانیم به طور وسیع در لامپ های کربنی به ویژه در صنعت تصویر های متحرک، چراغ های مربوط به فیلم ها، نور استودیو ها و پروژکتور ها بکار می رود. زیرکونیوم تثبیت شده با لانتانیوم، به خاطر خواص الکتریکی و مکانیکی، کاربرد دارد. از آنجاییکه لانتانیم توانایی ترکیب با ترکیبات فسفری در آب را دارد، بنابراین جهت تصفیه آب، مورد استفاده قرار می گیرد. علاوه بر آن، نمک های لانتانیوم در دستگاه های الکترونیک آلیاژ های آتشزنه، عامل احیا کننده و کاتالیزور برای تبدیل اکسید های نیتروژن در گازهای خروجی کاربرد دارد. به عبارت دیگر، به عنوان کاتالیزور جهت تولید محصولات سنتزی و فرآورده های نفتی کاربرد دارد.
یکی از کاربرد های لانتانیم، تهیه آلياژ است. اضافه کردن مقدار کمی از فلز لانتان به فولاد، می تواند قابلیت انعطاف پذیری، مقاومت در برابر ضربه و شکل پذیری فولاد را بهبود بخشد. همچنین افزودن لانتانیوم به مولیبدن، می تواند سختی و حساسیت مولیبدن را نسبت به تغییرات دما کاهش دهد. از طرف دیگر، آلیاژ های اسفنج هیدروژن به آلیاژ هایی گفته می شود که بتوانند تا بیش از ۴۰۰ برابر وزن خود، هیدروژن ذخیره کنند. به بیان دیگر، لانتانیم فلز مورد استفاده به منظور ساخت چنین آلیاژ هایی برای ذخیره هیدروژن است. لانتان همچنین در ساخت آهن ریخته ای، برای بهبود قابلیت انعطاف پذیری و چکش خواری آهن استفاده شود.

جالب است بدانید که
این عنصر برای استفاده در باطری های اتومبیل ها مورد عالی و مناسبی است. در واقع خودرو های هیبریدی و یا الکتریکی از باطری های قابل شارژ لانتانیم نیکل- فلزی هیدرید (NiMH) بهره می برند. این باطری ها همچنین در ابزار های قدرتی، اسباب بازی ها، لپ تاپ ها، تلفن ها و دوربین ها مورد استفاده قرار می گیرند. اکسید لانتان و بور قابلیت انتشار شدید الکترون ها را دارند. این توانایی باعش می شود که آنها به عنوان مواد کاتدی داغ در لوله های خلأ الکتریکی ارزشمند باشند به علاوه، فلورید لانتانیوم در فیبر های نوری به منظور بالا بردن سرعت انتقال اطلاعات بکار می رود. به علاوه از لانتانیم در تولید فندک و کبریت استفاده می کنند.
لانتانیوم در صنایع شیشه نیز کاربرد دارد. این عنصر مقاومت قلیایی شیشه ها را بالا می برد. بنابراین در ساخت شیشه های اپتیکی کاربرد دارد. به علاوه، از اکسید لانتانیوم برای بالا بردن وضوح تصویر در لنز های دوربین های پایه بلند، میکروسکوپ ها، تلسکوپ ها، عینک ها، حوزه های تفنگ و دوربین دو چشمی استفاده می شود. همچنین اکسید لانتانیم در تولید شیشه های جاذب اشعه زیر قرمز (در عینک های حفاظ دار دید شب) استفاده می شود. اضافه کردن اکسید لانتانیوم به تنگستن در الکترود های جوشکاری قوس تنگستن گازی، باعث می شود که این الکترود ها به عنوان جایگزینی برای توریم رادیواکتیو باشند. لازم به ذکر است که لانتان کربنات می تواند در درمان بیماران کلیوی استفاده شود.
ترکیبات عنصر لانتان
اکسید لانتان (اکسید لانتانیوم) که با عنوان لانتانا نیز شناخته می شود، یکی از مهمترین ترکیبات غیر آلی کاربردی فلز لانتان است. عنصر شماره ۵۷ جدول تناوبی همچنین می تواند به راحتی با هالوژن ها و فلزات واکنش دهد. از دیگر ترکیبات آن می توان به موارد زیر اشاره کرد.
- کربنات لانتان (La۲(CO۳)۳)
- لانتانیم هگزابورید (LaB۶)
- برمید لانتان (III) (LaBr۳)
- لانتان کاربید (LaC۲)
- لانتان (III) کلرید (LaCl۳)
- اکسید لانتان (La۲O۳)
- دکا هیدرید لانتان (LaH۱۰)
- تری فلورید لانتان (LaF۳)
- هیدروکسید لانتان (La(OH)۳)
- لانتانوم آلومینات (LaAlO۳)

خطرات لانتانیم بر روی سلامتی انسان
عنصر لانتان به روش های مختلف و اغلب در اثر صنایع تولید کننده نفت، در محیط اطراف ما پراکنده می شود. همچنین زمانیکه لوازم منزل (مثل تلویزیون های رنگی، شیشه ها، لامپ های فلورسنت و لامپ های ذخیره انرژی) دور ریخته می شوند، لانتانیوم می تواند وارد محیط زیست گردد. این عنصر به تدریج در خاک جمع می شود. در نتیجه به تدریج غلظت آن در بدن انسان و جانوران و ذرات خاک افزایش پیدا می کند. لانتانیم در جانوران آبزی می تواند سبب آسیب غشای سلولی گردد که بر روی تولید مثل و عملکرد سیستم عصبی اثر منفی خواهد داشت.
سمیت لانتانیم کم تا متوسط گزارش شده است. اما مصرف آن باید با احتیاط باشد. وجود لانتانیم در محیط کار بسیار خطرناک است. زیرا گاز آن می تواند با هوا استنشاق گردد و در نتیجه باعث انسداد ریه شود. حال اگر برای مدتی طولانی استنشاق شود، احتمال بروز سرطان در انسان را افزایش خواهد داد. تزریق محلول های لانتان باعث ایجاد قند خون بالا، فشار خون پایین، تحلیل رفتن طحال و تغییرات کبدی خواهد شد. لازم به ذکر است که برای عنصر لانتانیم هیچ نقش بیولوژی شناسایی نشده است.




















