عنصر فلوئور چیست؟ کاربرد و ویژگی فلوئور را می شناسید؟

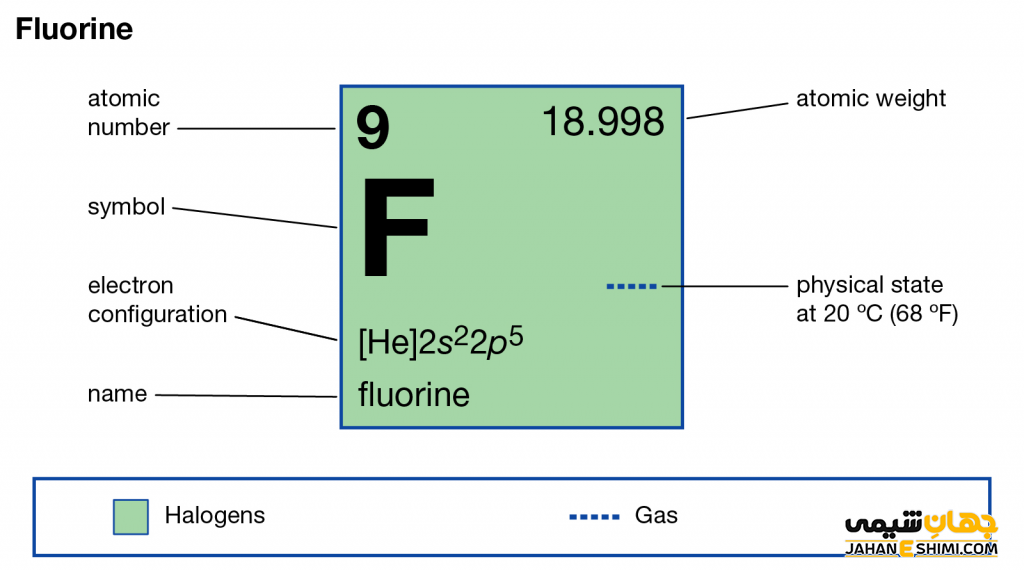
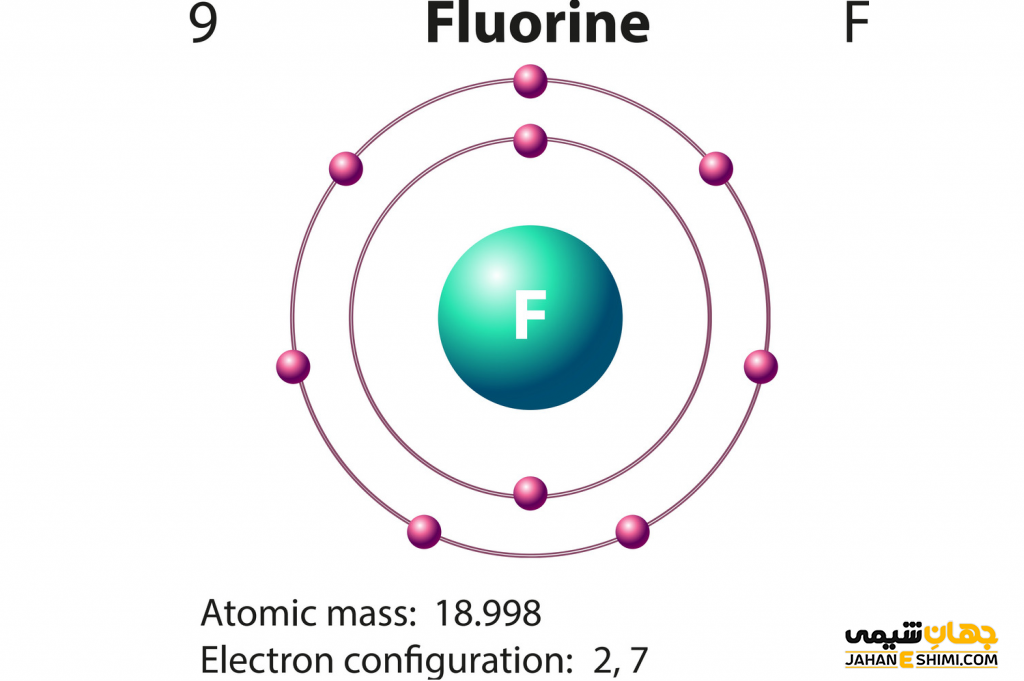
عنصر فلوئور عنصر شماره ۹ از عناصر شیمیایی جدول تناوبی بده و با نماد شیمیایی F شناخته می شود. عدد اتمی عنصر فلوئور ۹ و عدد جرمی آن ۱۸.۹۹۸ است.

عنصر فلوئور در گروه ۱۷ و تناوب دوم جدول مندلیف قرار گرفته است. عنصر فلوئور تک ظرفیتی بوده و در بین عناصر جدول تناوبی بالاترین الکترونگاتیویته را دارد. واکنش پذیری عنصر فلوئور بسیار زیاد بوده و با بسیاری از عناصر دیگر تشکیل پیوند میدهد. عنصر فلوئور در گروه هالوژن ها جای گرفته است. عوارض و خطرات عنصر فلوئور در صورت خالص بودن بسیار زیاد است. به طوری که در تماس با پوست می تواند به سوختگی های شدید منجر شود. ایزوتوپ عنصر فلوئور نیز شناسایی شده و در ادامه مقاله بررسی خواهد شد. توجه شود که عنصر فلوئور در محلول های آبی به صورت یون فلوئور –F (فلوئورید) وجود دارد.
نشریه علمی جهان شیمی فیزیک به بررسی بسیاری از عناصر جدول تناوبی و کاربرد و خواص عناصر پرداخته است. عناصری مانند: هیدروژن، هلیم، بریلیوم، کربن، نیتروژن و… . در ادامه این مقاله با بررسی خواص فیزیکی و شیمیایی عنصر فلوئور با ما همراه باشید.
پیشینه عنصر فلوئور
فلوئور در سال ۱۵۲۹ توسط Georigius Agricola به شکل فلورسپار و به دلیل کاربردش به عنوان یک گدازآور (ماده ای که جهت بهبود جوشکاری فلزات یا کانی ها استفاده می شود) شناسایی شد. نام فلوئور از واژه لاتین fluere گرفته شده است. در سال ۱۶۷۰ دانشمندی به نام Schwandhard متوجه شد که اگر سطح شیشه در معرض فلورسپار همراه با اسید قرار گیرد نقش هایی روی آن حک می شود. کارل ویلهلم شیله و بسیاری از محققان بعد از او مانند: هامفری دیوی، ژوزف لویی گیلوساک، آنتوان لاوازیه همگی با اسید هیدرو فلوریک آزمایشاتی انجام دادند که برخی از این آزمایشات به فاجعه ختم شد.
دانشمندان سال های زیادی پس از کشف این ماده نتوانستند آن را به دست آورند. درواقع هنگامی که این عنصر را از یکی از ترکیباتش جدا می کردند، بلافاصله به باقیمانده مواد آن ترکیب حمله می کرد. در سال ۱۸۸۶ پس از تقریبا ۷۴ سال تلاش مداوم دانشمندی به نامHenri Moissan موفق به تهیه فلورین شد.
در ساخت بمب هسته ای (اتمی) منهتن، اولین تولید تجاری فلورین صورت گرفت. در جنگ جهانی دوم ترکیب هگزا فلوئورید اورانیم برای جدا سازی ایزوتوپ های اورانیوم بکار رفت. در تجهیزات نیروی هسته ای هنوز هم از این ترکیب استفاده می شود.
خواص و ویژگی عنصر فلوئور
این ماده از عناصر گروه ۱۷ جدول تناوبی و صدرنشین این گروه است. عنصر فلوئور الکترونگاتیو ترین و واکنش پذیرترین عنصر جدول مندلیف بشمار می آید. این عنصر در حالت STP به صورت گاز بوده و رنگ آن نیز زرد کمرنگ است. این عنصر تک ظرفیتی بوده و عدد اتمی ۹ و نشان شیمیایی F برایش تعریف شده است. جرم اتمی این عنصر برابر با ۱۸.۹۹۴ است. این گاز خورنده خاصیت واکنش پذیری بالا با بیشتر مواد آلی و غیر آلی را داراست. همه فلزات، شیشه، سرامیک، کربن و حتی آب در عنصر فلوئور با شعله روشن می سوزند. عنصر فلوئور و یون فلوئورید بسیار سمی هستند.
این عنصر به حالت آزاد در طبیعت وجود دارد و دارای بوی بد و تیزی است. این عنصر به دلیل خورندگی بالا در واکنش با شیشه تترافلوئورید سیلیسیم تولید می کند. بنابراین برای نگهداری آن باید از ظروف تفلون استفاده نمود. پیوند F-F از ضعیف ترین پیوندهاست. به همین دلیل است که زود شکسته شده و واکنش پذیری بالایی دارد. مدل اتمی بور عنصر فلوئور نیز تعریف و شناخته شده است.
کاربرد گاز فلوئور
از ترکیبات حاوی فلوئور می توان در بسیاری از صنایع استفاده نمود. کاربرد عنصر فلوئور در موارد زیر شناخته شده است.
- ساخت تفلون
- صنایع نیمه هادی
- تهویه و سرد سازی
- خمیر دندان
- تولید پلاستیک های کم اصطکاک
- در فریون ها
- قلم زنی شیشه
اسید هیدروفلوریک که با HFنشان داده می شو، برای حکاکی روی شیشه، در لامپ و محصولات دیگر بکار می رود. فلوئور تک اتمی نیز در تولید نیمه هادی برای Plasma ashing استفاده میگردد.
در تولید اورانیوم نیز از فلوئور و ترکیباتش (هگزا فلوراید) استفاده می شود. کاربرد ترکیبات فلوئور دار در تولید بیش از صد نوع ماده شیمیایی فلوئور دار تجاری وجود دارد. مثلا تعداد زیادی از پلاستیک های مقاوم در برابر گرما به کمک ترکیبات این عنصر تولید می شوند.
در الکترولیز آلومینیوم نیز از ترکیبات فلوئوردار (آلومینیات هگزا فلوئورید پتاسیم) استفاده میشود.
فلوئورید سدیم به عنوان یک حشره کش و بهویژه سوسک کش استفاده میشود.
محققین امکان استفاده از گاز فلوئور خالص به عنوان سوخت موشک را بررسی نموده اند. چون این گاز دارای ضربه مخصوص بالایی است.
خواص برخی از فلوئورید ها در جلوگیری از پوسیدگی دندان ثابت شده است. این مواد به خمیر دندان و گاهی به منابع آب شهری جهت کنترل پوسیدگی دندان افزوده میشوند. ترکیبات حاوی فلوراید در دندانپزشکی به صورت دهانشویه نیز به کار می روند. درواقع فلوراید از دو طریق از پوسیدگی دندان ها جلوگیری میکند.
- فلوراید با تجمع در استخوان ها و دندان های در حال رشد کودکان به سفت شدن مینای دندان ها قبل از پیدایش آن ها کمک میکند.
- این ماده در سفت شدن مینای دندان بزرگ سالان نیز مؤثر عمل می کند.
کاربرد عنصر فلوئور در سلامتی
در آب، هوا، گیاهان و جانوران مقادیری از فلوئور وجود دارد. ما می توانیم از طریق غذا و آب آشامیدنی و حتی تنفس، این عنصر را وارد بدنمان کنیم. درواقع فلوئورین با نسبت های مختلفی در انواع مختلف غذا وجود دارد. ترکیباتی مانند چای و پوسته صدف ها مقدار زیادی فلوئور دارند.
کاربرد و مصرف عنصر فلوئور برای مقاوم شدن استخوان ها از عناصر اساسی است. اثر مصرف عنصر فلوئور در خمیر دندان روی دندان ها مفید بوده و مانع پوسیدگی دندان می شود. اما باید توجه شود که این عنصر مضراتی را نیز دارد. کاربرد و مصرف بیش از حد عنصر فلوئور باعث پوسیدگی دندان، پوکی استخوان، ایجاد عوارضی در کلیه ها، سیستم عصبی و ماهیچه ها می گردد.
این ماده بسیار خطرناک است و در غلظت های بالا می تواند باعث مرگ شود. جالب است بدانید که در صورت پایین بودن غلظت گاز فلوئور ممکن است آسیب هایی به گوش و چشم وارد شود.
اثرات فلوئور بر محیط زیست
عنصر فلوئور در پوسته زمین یعنی مکانی که سنگ ها، زغال سنگ و خاک رس وجود دارد، به طور طبیعی پیدا می شود. این ماده در خاکی که توسط باد جا به جا شده رها می شود. فلوئورید هیدروژن که از ترکیبات این عنصر است نیز از طریق فرآیند احتراق در صنعت ایجاد شده و سپس وارد هوا می شود. فلوئورید هایی که وارد هوا شده اند، وارد زمین و آب می شوند. فلوئور به ذرات بسیار ریز می چسبد و برای مدت زمان طولانی می تواند در هوا بماند.
فلوئور از هوا وارد آب شده و در رسوبات ته نشین میگردد. وقتی فلوئور وارد خاک شود به ذرات خاک متصل می شود. درواقع عنصر فلوئور در طبیعت از بین نمی رود و تنها از شکلی به شکل دیگر در می آید.
این ماده در خاک جمع شده و وارد گیاهان می شود. مقدار فلوئوری که توسط گیاه جذب می شود به عواملی مختلفی وابسته است. مانند: نوع گیاه، نوع خاک و مقدار و نوع فلوئوری که در خاک موجود است. حتی غلظت های پایین فلوئور هم در گیاهان حساس به فلوئور باعث کند شدن رشد گیاه و آسیب به برگ آنان می شود.
ایزوتوپ عنصر فلوئور
از عنصر فلوئور تاکنون ۱۸ ایزوتوپ (از F-14 تا F-31) و یک ایزومر (Mf-18) شناسایی شده است. از میان این ایزوتوپ ها درصد فراوانی ایزوتوپ فلوئور ۱۹(f-19) به طور طبیعی پایدار است. تعداد نوترون این ایزوتوپ عنصر فلوئور ۱۰ می باشد.
واکنش عنصر فلوئور با سایر عناصر
واکنش با کربن: پیوند بین کربن-فلوئور، پیوند کووالانسی بین یک اتم کربن و یک اتم فلوئور است. این پیوند خاصیت قطبی داشته و قوی ترین و کوتاه ترین پیوند شیمیایی در شیمی آلی است. این پیوند در تمامی ترکیبات آلی فلوئور دار مشاهده میشود.
واکنش با نافلزات: عنصر فلوئور به دلیل واکنش پذیری بالایی که دارد، می تواند با تمام نا فلزات واکنش دهد. البته نیتروژن، هلیم، نئون و آرگون استثنا هستند. فلوئور با گاز بی اثر (نجیب) زنون تحت حرارت و گرما واکنش می دهد. فلوئور در مقابل گرما با الماس و سیلیس واکنش داده و CF۴ و SiF۴ را تشکیل می دهد.
واکنش با آب: عنصر فلوئور با آب وارد واکنش شده و اکسیژن و فلوئورید هیدروژن می دهد.
خواص هیدروژن فلوئورید از ترکیبات این عنصر
هیدروژن فلوئورید با فرمول (HF) ترکیبی شیمیایی و گازی شکل است که سبکتر از هوا است. این ترکیب در دمای کمی کمتر از دمای معمولی اتاق (همانند بسیاری از هیدروژن هالیدها) در ۱۹.۵ درجه سانتیگراد میجوشد و در دمای پایینتر از -۸۴ درجه سانتیگراد به صورت جامد در میآید. این ترکیب از منابع اصلی فلوئور است که با حل شدن در آب هیدروفلوریک اسید را به وجود میآورد که اثرات خورندگی بسیاری دارد و در صنایع پتروشیمی کاربرد زیادی دارد. این ماده بسیار سمی بوده و میتواند به ریهها آسیب بزند.
روش تهیه و تولید عنصر فلوئور
عنصر فلوئور یک اکسنده بسیار قوی است. بنابراین نمی توان آن را از راه اکسیداسیون تهیه نمود. این مولکول از طریق الکترولیز محلول الکترولیتی شامل پتاسیم فلوئورید حل شده در هیدروژن فلوئورید مایع تولید می شود.
فلوئوریت
کانی فلورین یا فلوئوریت به فرمول شیمیایی (CAF2) از مهم ترین کانی فلوئور در طبیعت است. از این کانی می توان عنصر فلوئور را به دست آورد. رنگ های زرد، سبز، صورتی، آبی، بنفش، بی رنگ و گاه سیاه برای این کانی ثبت شده است. این کانی در سیستم کوبیک (مکعبی) متبلور شده، نیمه شفاف بوده و دارای جلای شیشهای است. وزن مخصوص این کانی ۱۸/۳ و سختی آن ۴ است.
این کانی اغلب فضای خالی بین سایر کانی ها را پر کرده و در طبیعت بیشتر بهصورت رگه ای مشاهده می شود. فلوئوریت با کانی های کلسیت، کوارتز، باریت و سولفید های گوناگون همراه است. میزان ذخایر فلوئوریت کشور مکزیک با ۳۲ میلیون تن در رتبه اول ذخایر جهان قرار دارد. کشور های آفریقای جنوبی و چین به ترتیب با ۳۰ و ۲۳ میلیون تن رتبه های دوم و سوم و فرانسه با ۱۰ میلیون تن و اسپانیا با ۶ میلیون تن در رتبه های چهارم و پنجم جهان قرار گرفته اند. بر اساس اطلاعات وزارت صنایع و معادن ایران، در سال ۲۰۰۱ میلادی در مجموع بیش از ۱/۳ میلیون تن ذخیره احتمالی و بالغ بر ۵/۱ میلیون تن ذخیره قطعی فلورین در کشور ما ایران وجود داشته است.

هشدارها و خطرات مصرف عنصر فلوئور
در مصرف و کاربرد عنصر فلوئور و HF باید دقت زیادی داشت.
از هرگونه تماس این مواد با پوست و چشم جداً اجتناب گردد.
یون های فلوئورید و فلوئور خالص هر دو بسیار سمی هستند.
فلوئور وقتی عنصر آزاد است دارای بوی تندی بوده و در غلظتی به کمی ppm 20نیز قابل شناسایی است.
بیشینه غلظت مجاز برای تماس ۸ ساعته روزانه با این ماده PPM ۱ پیشنهاد میشود.
البته روش های ایمن جابجایی این عنصر، امکان ترابری فلوئور مایع را در مقادیر زیاد امکانپذیر می کند.
نکته: مسمومیت با عنصر فلوئور
نگرانی هایی در مورد امکان مسمومیت در نتیجه مصرف آب حاوی ترکیبات فلوئوری وجود دارد. اما شواهدی که دلالت بر ایجاد چنین مسمومیتی کند در دست نیست. میزان زیاد فلوئور باعث لکه دار شدن استخوان، باقی ماندن کلسیم زیاد و اختلال در تشکیل بافت پیوندی خواهد شد. این اثرات در شرایط کمبود ویتامین سی، پروتئین و کلسیم تشدید هم می گردد.
تجمع لکه ها بیشتر بر روی دندان های پیشین آرواره بالا می باشند. کارگران کارخانجاتی که به نحوی با املاح حاوی فلوئورید در ارتباط هستند بیشتر در خطر مسمومیت قرار دارند. مانند کارخانجات ذوب آلومینیوم.
علایم مسمومیت با این ماده: بی اشتهایی و متراکم شدن توده های استخوانی (اسکلروز) در استخوان های ستون فقرات، لگن و ران ها همراه با اختلالات عصبی.
مولکول فلوئور
فلوئور از نظر شیمیایی واکنش پذیرترین و الکترونگاتیوترین عنصر در بین تمام عناصر است. الکترونگاتیوی بالای فلوئور به این معنی است که پیوندهای تشکیل شده با فلوئور بسیار قوی هستند. مواد غیر فعال شامل الیاف آزبست، شیشه، فولاد پودر شده به سرعت تحت حضور گاز فلوئور سرد واکنش نشان می دهند. چوب و آب به طور خود به خود تحت حضور جت فلوئور می سوزد. واکنش فلوئور با فلزات قلیایی خاکی فعالیت شدیدی را نشان می دهد و واکنش فلوئور با فلزات قلیایی باعث انفجار می شود.
روش موسان: رایج ترین روش صنعتی مورد استفاده برای تولید فلوئور، الکترولیز مخلوط فلوراید پتاسیم/ هیدروژن فلوراید است. این بر اساس آثار هنری مویسان است. یون های هیدروژن و فلوراید در کاتد ظرف فولادی و آند بلوک کربن احیا و اکسید می شوند تا هیدروژن و گاز فلوئور تولید کنند. این ترکیب در صنایع شیمیایی زیر نیز مورد استفاده قرار می گیرد:
صنایع آلیاژی: یون های فلوراید به آلیاژهای آهن اضافه می شوند تا نقطه ذوب و ویسکوزیته آن کاهش یابد.
تبرید: گازهای فریون حاوی فلوئور هستند. آنها برای تبرید و تهویه مطبوع استفاده می شوند.
صنایع پلیمری: پلی تترا فلوئورواتیلن که با نام تفلون نیز شناخته می شود ۶۰ تا ۸۰ درصد از کل فلورو پلیمرهای تولید شده را تشکیل می دهد. در صنایع الکترونیک استفاده می شود زیرا به عنوان یک دی الکتریک عالی عمل می کند و همچنین در صنایع شیمیایی که مقاومت در برابر خوردگی بالا مورد نیاز است استفاده می شود. تفلون ماده ای بسیار محبوب برای ساخت ظروف پخت و پز نچسب است.
چرخه سوخت هسته ای: فلوئور برای فلوئور کردن تترا فلوراید اورانیوم و تشکیل هگزافلوورید اورانیوم استفاده می شود.
صنایع برق: فلوئور برای تولید هگزا فلوراید گوگرد دی الکتریک بی اثر برای ترانسفورماتورهای ولتاژ بالا و قطع کننده مدار استفاده می شود.
صنایع الکترونیک: تترافلورومتان برای اچ پلاسما و نیتروژن تری فلوراید برای تمیز کردن تجهیزات استفاده می شود.



















