الکترون خواهی یا الکترون افینیتی (Electron Affinity) به مقدار انرژی آزاد شده در هنگام اضافه شدن الكترون به اتم یا مولکول خنثی گازی شكل و تشکیل یون منفی گفته می شود. به عبارت دیگر، به میزان تمایل یک اتم برای جذب یک الکترون، الکترون خواهی می گویند که با نماد Eea یا EA نشان داده می شود. انرژی الكترون خواهی معمولا با واحد الکترون ولت یا واحد کیلو ژول بر مول به ازای یک اتم، مولکول یا یون گزارش می شود. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با الکترون خواهی ارائه شده است. لطفا همراهی بفرمایید.
فهرست مطالب این مقاله
۱- مقدمه
۲- علامت قراردادی الکترون خواهی
۳- دومین انرژی الکترون خواهی
۴- انرژی الکترون افینیته در فرآیند تولید یون
۵- عوامل موثر بر علامت و مقدار انرژی الکترون خواهی
۶- روند تغییرات انرژی الکترون خواهی
۱-۶- تغییرات الکترون افینیتی عناصر در یک دوره
۲-۶- تغییرات الکترون افینیتی عناصر در یک گروه
۷- الکترون افینیتی فلزات در برابر نافلزات
۸- کمترین و بیشترین میزان الکترون خواهی
۹- کاربردهای الکترون خواهی
۱۰- فرق الکترون خواهی و الکترونگاتیویته
مقدمه
به دلیل اینکه سطح انرژی اتم ها و مولکول ها در حالت جامد و مایع، تحت تاثیر اتم ها و مولکول های مجاور قرار می گیرد، بنابراین میل ترکیبی جذب الکترون فقط در فاز گازی تعریف می شود. انرژی الكترون خواهی اول برای یک گونه خنثی به صورت زیر نمایش داده می شود (EA۱).
M (g) + 1e– –> M– (g)
به همین ترتیب روند ادامه پیدا می کند. به عنوان مثال، انرژی الكترون خواهی nام (EAn) برای یک گونه در فاز گازی بیانگر انرژی آزاد شده هنگام اضافه شدن n امین الكترون به آن گونه می باشد. بنابراین داریم :
M– (g) + 1e– –> M۲- (g)
.
.
.
M (n-1) – (g) + 1e– –> Mn- (g)
لازم به ذکر است که می توان برای مولکول ها نیز انرژی الكترون افینیتی در نظر گرفت. در واقع انرژی آزاد شده در هنگام اضافه شدن الکترون جدید به مولکول در فاز گازی محسوب می شود. مثلا انرژی الكترون افینیتی اول مولکول اکسیژن به صورت زیر می باشد :
O۲ (g) + 1e– –> O۲– (g)
علامت قراردادی الکترون خواهی
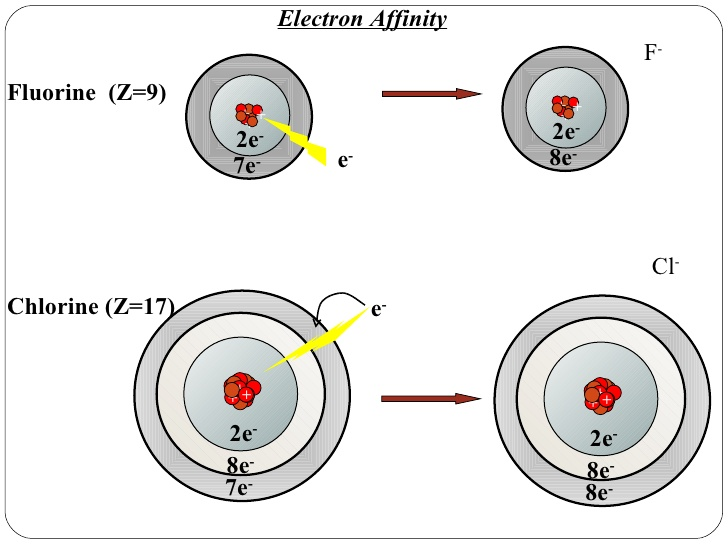
هنگامیکه الکترون به یک اتم خنثی نزدیک می شود، از یک طرف به وسیله هسته با بار مثبت جذب می گردد. اما از طرفی دیگر به وسیله سایر الکترون های منفی همان اتم دفع می شود. در حقیقت الکترون جدید اضافه شده به اتم، با هسته اتم جاذبه الکتریکی و با سایر الکترون های همان اتم دافعه های الکتریکی برقرار می کند.
حال اگر نیروی جاذبه بیشتر از نیروی دافعه باشد، زمانیکه یون منفی تشکیل می شود، انرژی آزاد می گردد. بنابراین علامت انرژی الکترون خواهی منفی خواهد بود. در حالیکه اگر نیروی دافعه بیشتر از نیروی جاذبه باشد، برای تشکیل آنیون باید به سیستم انرژی داده شود، بنابراین علامت Eea مثبت خواهد شد.
به طور کلی می توان گفت که در فرآیند الکترون افینیتی معمولا انرژی آزاد می شود. بنابراین علامت اولین افینیتی بیشتر عناصر منفی می باشد. حال هرچه میزان انرژی الکترون خواهی یک اتم، منفی تر باشد، نشان دهنده تمایل بیشتر اتم برای جذب الکترون می باشد.
به عبارت دیگر می توان گفت، علامت منفی و در نتیجه آزاد شدن انرژی بیانگر قدرت بیشتر جاذبه الکترون اضافه شده با هسته می باشد. در حالیکه علامت مثبت و در نتیجه صرف کردن انرژی بیانگر قدرت بیشتر دافعه الکترون اضافه شده با دیگر الکترون ها است.
دومین انرژی الکترون خواهی
در واکنش الكترون افینیتی دوم، الکترون جدید به یک یون منفی اضافه می گردد. از آنجایی که الکترون و آنیون هر دو بار منفی دارند، بنابراین یکدیگر را دفع می نمایند. در واقع در این حالت نیروهای دافعه قوی تر بوده و از این رو واکنش الكترون خواهی دوم همواره نیازمند صرف انرژی است، بنابراین مقداری مثبت دارد. به عنوان مثال دومین الکترون افینیتی اتم اکسیژن برابر با ۸۴۵ کیلو ژول بر مول می باشد.
انرژی الکترون افینیته در فرآیند تولید یون
انرژی الکترون افینیتی در فرآیند تولید یون که از دو یا چند بار منفی تشکیل شده است، از حاصل جمع تمام الکترون افینیتی های مربوطه بدست می آید. لازم به ذکر است که این حاصل جمع برای تمام یون های دارای چند بار منفی همیشه دارای علامت مثبت است، بنابراین فرآیند انرژی گیر می باشد.
عوامل موثر بر علامت و مقدار انرژی الکترون خواهی
یک اتم برای گرفتن یک الکترون اضافه باید شرایط زیر را داشته باشد :
۱- الکترونگاتیویته و همچنین بار موثر هسته آن اتم زیاد باشد. به عنوان مثال، گروه هالوژن ها به دلیل داشتن الکترونگاتیویته بالا، انرژی الکترون خواهی بالایی را نیز نشان می دهند.
۲- آرایش الکترونی آن اتم با گرفتن یک الکترون اضافه، ناپایدار نشود. به عنوان مثال، عناصر گروه فلزات قلیایی خاکی آرایش الکترونی ns۲ را نشان می دهند و در نتیجه پایدارند. گرفتن الکترون اضافه سبب ناپایداری سیستم می شود، بنابراین تمایلی به گرفتن الکترون جدید ندارند و انرژی الکترون افینیتی آنها یا مثبت است یا اندازه آن کوچک می باشد.
۳- شعاع اتم به اندازه کافی بزرگ باشد تا بتواند الکترون اضافه شده را در لایه والانس خود جای دهد. در حقیقت دافعه الکترون های قبلی اتم بر روی الکترون جدید کم باشد. به عنوان نمونه، انرژی الکترون افینیتی گوگرد (۲۰۰-) بیشتر از اکسیژن (۱۴۱-) می باشد، به دلیل آنکه شعاع عناصر دوره سوم نسبت به دوره دوم بزرگتر می باشد.
روند تغییرات انرژی الکترون خواهی
به طور کلی می توان گفت که الکترون افینیتی عناصر با افزایش تعداد الکترون های لایه والانس و در نتیجه افزايش بار موثر هسته و همچنین کاهش اندازه اتم افزایش می یابد.
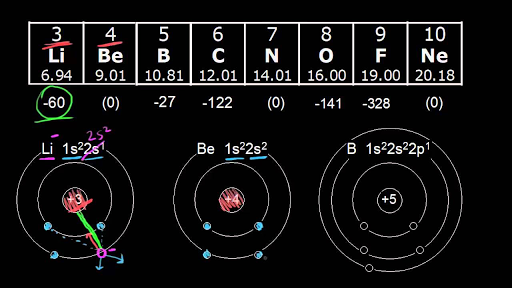
تغییرات الکترون افینیتی عناصر در یک دوره
در یک دوره از جدول تناوبی و با افزايش عدد اتمی، اندازه شعاع كووالانسی اتم به تدريج كاهش يافته، بنابراین مقدار بار موثر هسته و الکترونگاتیویته آن عناصر به تدريج افزایش مي یابد. هر دو عامل ذکر شده سبب بیشتر شدن الكترون افینیتی عناصر می شود. در نتیجه در طول هر دوره و با حرکت از سمت چپ جدول به سمت راست، الكترون افینیتی اتم ها به تدريج افزايش مي يابد. این روند در گروه های ۲، ۱۵ و ۱۸ معکوس می باشد.
عناصر گروه فلزات قلیایی خاکی، گروه نیتروژن و گروه گازهای نجیب به ترتیب دارای آرایش های الکترونی ns۲، np۳ و ns۲ np۶را نشان می دهند. در واقع عناصر گروه ۲ و ۱۸ دارای آزایش الکترونی پر و عناصر گروه ۱۵ آرایش الکترونی نیمه پر دارند. این عناصر پایدارند، بنابراین به آسانی الکترون اضافی نمی پذیرند.
تغییرات الکترون افینیتی عناصر در یک گروه
در یک گروه از جدول تناوبی و با افزايش عدد اتمی، به طور همزمان اندازه شعاع كووالانسی و مقدار بار موثر هسته افزايش می يابد. همانطور که می دانید در یک گروه از بالا به پایین، الکترونگاتیویته کاهش می یابد. بنابراین می توان گفت که در یک گروه از بالا به پایین با کاهش الکترونگاتیویته، انرژی الکترون افینیتی نیز با شیب ملایم کاهش می یابد.
در واقع الکترون جدید به اوربیتال بزرگتر اضافه می شود، پس زمان کمتری را در اطراف هسته اتم می گذراند. از طرفی دیگر با افزايش عدد اتمی و قاعدتا افزایش الکترون های عناصر در یک گروه، نیروهای دافعه بین الکترون جدید اضافه شده و الکترون های قبلی نیز افزایش می یابد. بنابراین، الکترون خواهی از بالا به پایین در حال کاهش می باشد.
روند تغییرات برای الكترون افینیتی اول در گروه ها پر از استثنا می باشد. به عنوان نمونه، با توجه به شعاع اتمی کوچکتر فلوئور نسبت به کلر، انتظار می رود که الكترون خواهی اول فلوئور بزرگتر از کلر باشد. اما انرژی الكترون افینیتی اول برای فلوئور و کلر به ترتیب برابر با ۳۲۸ و ۳۴۹ کیلوژول بر مول می باشد. بنابراین همانطور که مشخص است، الكترون افینیتی اول کلر بزرگتر از فلوئور است.
به دلیل اندازه كوچك فلوئور، با اضافه شدن یك الكترون، دافعه بین الكترون ها به شدت افزایش می یابد. به خاطر این دافعه و ناپایداری ناشی از آن، انرژی الكترون خواهی اول در فلوئور در مقایسه با کلر کمتر می باشد.
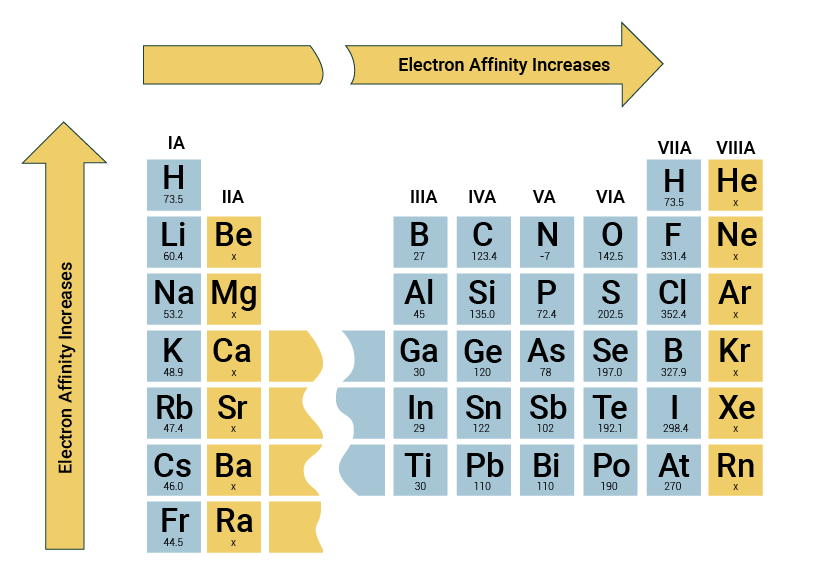
الکترون افینیتی فلزات در برابر نافلزات
فلزات برای دستیابی به آرایش گاز نجیب (آرایش اکتت) تمایل دارند که الکترون از دست بدهند. اما نافلزات تمایل به گرفتن الکترون، تبدیل شدن به آنیون و در نهایت رسیدن به آرایش گاز نجیب را دارند. بنابراین الکترون افینیته در غیر فلزات، بیشتر از فلزات می باشد. در شکل زیر، تغییرات تناوبی الکترون افینیته اول عناصر را بر حسب عدد اتمی برای ۶ ردیف از جدول تناوبی نشان داده شده است.

کمترین و بیشترین میزان الکترون خواهی
به طور کلی در جدول تناوبی، در هر دوره از چپ به راست، الکترون افینیته افزایش و در هر گروه از بالا به پایین کاهش پیدا میکند. بنابراين، الكترون خواه ترین عناصر، در گوشه بالای سمت راست جدول تناوبی و كمترين میزان آن مربوط به عناصری است که در گوشه پايين سمت چپ جدول قرار گرفته اند. از این رو بیشترین تمایل پذیرش الکترون در جدول تناوبی متعلق به گروه هالوژن ها می باشد.
کاربردهای الکترون خواهی
از انرژی الکترون خواهی برای مفاهیم الکترونگاتیویته، انرژی یونش، پتانسیل شیمیایی الکترونی و سختی شیمیایی استفاده می کنند. علاوه بر آن، با توجه به علامت الکترون افینیته می توان الکترون گیرنده یا الکترون دهنده بودن یک اتم یا مولکول را تشخیص داد. به عنوان مثال هر چه میزان الکترون افینیته منفی تر باشد، اتم یا مولکول به عنوان الکترون دهنده در نظر گرفته می شود.
فرق الکترون خواهی و الکترونگاتیویته
الکترون خواهی اتم یا مولکول یکی از خواص بنیادی آن اتم یا مولکول در حالت آزاد و گازی می باشد. در حالیکه الکترونگاتیویته عبارت است از میزان تمایل اتم به جذب الکترون های پیوندی و اشتراکی به سمت خود. در واقع الکترون خواهی یک مفهوم مطلق می باشد، اما الکترونگاتیوی اتم ها، یک مفهوم نسبی است. علاوه بر آن، الکترون افینیته واحدی از نوع انرژی دارد، اما در مقابل الکترونگاتیوی واحد ندارد.