اصل طرد پائولی چیست؟ – تعریف و ویژگی آن

اصل طرد پائولی بیان می کند که هیچ گاه دو الکترون در یک اتم نمی توانند چهار عدد کوانتومی یکسانی داشته باشند و حداقل یک عدد کوانتومی آن ها باهم فرق می کند. این اصل یکی از مهم ترین اصول در مکانیک کوانتومی است. در این مقاله نشریه جهان شیمی فیزیک به بررسی ویژگی های این اصل و نقش مهمی که در مدل اتمی دارد می پردازیم.
فهرست مطالب :
۱- تعریف اصل طرد پائولی
۲- درک مفهوم اصل طرد پائولی با مثال
۳- نمایش الکترون ها در اوربیتال بر طبق اصل طرد پائولی
۴- ویژگی اصل طرد پائولی
۵- اصل طرد پائولی در هسته
۶- مشخص کردن تراز نوار رسانش توسط اصل طرد پائولی
۷- اهمیت اصل طرد پائولی
۱- تعریف اصل طرد پائولی :
این اصل را در سال ۱۹۲۵ یک فیزیکدان اتریشی- سوئیسی به نام ولفانگ پائولی ارائه کرد. پائولی بیان کرد هیچ وقت دو الکترون (دو فرمیون مشابه) نمی توانند حالت کوانتومی یکسانی داشته باشند و هم زمان در یک مکان حضور داشته باشند. به طور کلی هیچ دو الکترونی نمی توانند کل اعداد کوانتومی در آن ها (n, L, mL, mS) یکی باشد و مجموعه این اعداد کوانتومی برای هر الکترون منحصر به فرد است. اصل پائولی بعد از این که مدل اتمی بور ارائه شد، بیان شد. چون بعد از مدل اتمی بور هیچ پاسخی برای این پرسش که الکترون ها چگونه در اتم ها قرار می گیرند نبود. چون انتظار بر این بود که نزدیک به دمای صفر مطلق تمام الکترون ها به سطح انرژی پایین n = 1 منتقل شود. اما طیف های اتم ها با این فرضیه ها قابل توصیف نبود.
نکته :
گفته شد دو الکترون با عدد کوانتومی یکسان در یک لایه قرار نمی گیرد، اگر الکترونی برعکس این رفتار کند طبق این اصل رانده می شود. یعنی به لایه ای دیگر طرد می شود و به این ترتیب از فروپاشی ساختار پوسته های الکترونی محافظت می کند. به همین دلیل این اصل به اصل طرد پائولی معروف است.
۲- درک مفهوم اصل طرد پائولی با مثال :
وقتی گفته می شود هیچ دو الکترونی نمی تواند در مجموعه چهار عدد کوانتومی یکی باشد، با توضیحات زیر مفهوم این جمله را متوجه می شویم. یک تراز فرعی در اعداد کوانتومی n و L یکی، اما در عدد کوانتومی mL متفاوت است. مثلا در تراز ۳p سه اوربیتال دارای n = 3 و L = 1 هستند، اما mL در سه اوربیتال متفاوت و عددهای ۱+، ۰ و ۱- می باشد. پس طبق اصل پائولی چون یک عدد کوانتومی در آن ها متفاوت است، الکترون هایی که در سه اوربیتال px، py و pz قرار می گیرند می توانند به صورت تکی و با اسپین یکسان (ms یکسان) باشند.
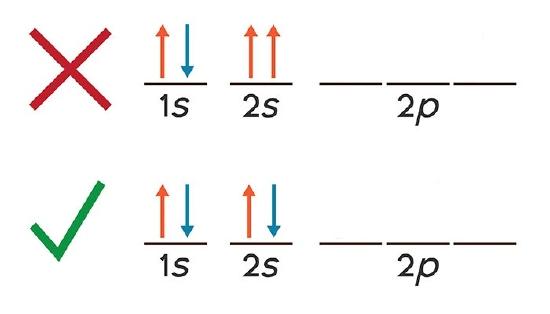
نکته :
هر اوربیتال فقط می تواند دو الکترون در خود جای دهد، به عنوان مثال در اوربیتال ۳px سه عدد کوانتومی n، L و mL یکی است. وقتی دو الکترون در این اوربیتال قرار می گیرد برای این که اصل طرد پائولی رعایت شود، باید عدد کوانتومی چهارم آن ها متفاوت باشد. پس همان طور که در بالا گفته شد باید ms مختلف داشته باشند و با اسپین های مخالف کنار هم قرار گیرند.
اگر در یک اوربیتال سه الکترون قرار داده شود، اصل پائولی رعایت نشده است. چون عدد کوانتومی اسپین الکترون سوم باید با یکی از دو الکترون قبلی یکی باشد و این امکان پذیر نیست.
۳- نمایش الکترون ها در اوربیتال بر طبق اصل طرد پائولی :
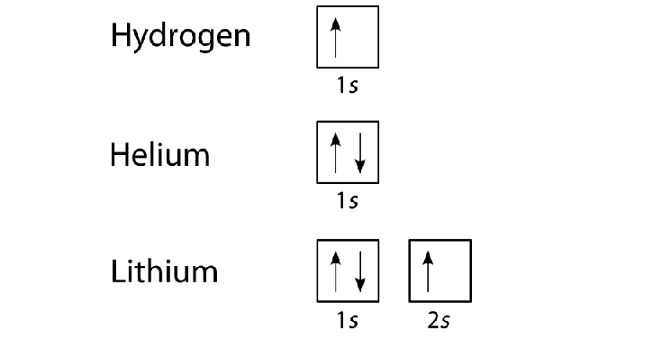
وقتی الکترون ها در یک تراز انرژی قرار می گیرند تمام عددهای کوانتومی آن که مربوط به آن تراز و سطح انرژی است، به جز عدد کوانتومی mS، یکسان هستند. چون mS برای هر الکترون می تواند دو مقدار متفاوت داشته باشد، پس در هر اوربیتال حداکثر دو الکترون، آن هم با mS های مختلف می تواند قرار گیرد. در هنگام نوشتن، اوربیتال را با یک خط کوچک و الکترون های آن را با فلش های رو به بالا نشان دهنده mS = + ½ و فلش های رو به پایین نشان دهنده mS = _ ½ نمایش می دهند.
وقتی دو الکترون در یک اوربیتال با اسپین های مخالف قرار بگیرد، الکترون های جفت شده و اگر به صورت تکی با اسپین مثبت قرار گیرد، الکترون جفت نشده گویند.
۴- ویژگی اصل طرد پائولی :
در صورت عدم وجود اصل پائولی، تمامی اتم ها دارای یک ساختار الکترونی و به صورت یک لایه از الکترون ها می شدند. به عنوان مثال هیدروژن و هلیم با اعداد اتمی یک و دو، دارای یک لایه هستند و در هلیم دو الکترون ها با اسپین مخالف در این لایه قرار می گیرند. در اتم لیتیم با عدد اتمی سه، الکترون بعدی اگر در اوربیتال بعدی قرار گیرد، اصل پائولی رعایت شده است. وگرنه اگر الکترون سوم را در همان لایه اتم هیدروژن و هلیم بگذاریم، سه الکترون در یک اوربیتال می شوند که این متناقض با این اصل می باشد.
۵- اصل طرد پائولی در هسته :
در هسته چون دو ذره پروتون و نوترون با واکنش ضعیف می توانند به یکدیگر تبدیل شوند و به یک اندازه از نیروهای هسته اثر پذیری داشته باشند، آن ها دو حالت مختلف از یک نوکلئون در نظر گرفته می شود. این دو ذره از لحاظ عدد کوانتومی اسپین ایزوتوپی (ایزوسپین) باهم تفاوت دارند. طبق این اصل این دو نوکلئون هیچ وقت نمی توانند اعداد کوانتومی فضایی، اسپینی و ایزواسپینی یکسانی داشته باشند.
۶- مشخص کردن تراز نوار رسانش توسط اصل طرد پائولی :
بر طبق این اصل و قرار گیری الکترون ها در اوربیتال ها در ترازهای انرژی، می توان رسانایی الکتریکی جامدات را مشخص کرد. اگر در جامدی بالاترین تراز انرژی کاملا از الکترون پر شده باشد، بر اثر میدان الکتریکی، الکترون ها راحت نمی توانند جابه جا شوند و نارسانا هستند. اگر فقط قسمتی از تراز انرژی بالا از الکترون اشغال شود، جسم جامد رسانا خواهد بود. در نیم رسانا ها طبق این اصل هر اوربیتال فقط می تواند یک الکترون داشته باشد.
۷- اهمیت اصل پائولی :
اصل پائولی در فیزیک هسته ای و ذرات بنیادی یکی از شاهکارهای نمونه است. به طوری که اگر این اصل وجود نداشت همه الکترون های یک اتم به پایین ترین تراز از نظر انرژی منتقل می شد. بدون این اصل شیمی اتم ها و مولکول ها بی معنا می شد و تمام اتم ها دارای یک آرایش مولکولی می شدند و زیست شیمی در کل حذف می شد. این اصل اساس نظری جدول تناوبی را تشکیل می دهد و آرایش الکترونی اتم ها با این اصل نهادینه می شود. پائولی به خاطر بیان کردن این اصل جایزه نوبل فیزیک در سال ۱۹۴۵ را از آن خود کرد.