شیمیدانان متوجه شدند که در برخی از ترکیبات هیدروژن دار، جاذبه بین مولکولی به طور غیر عادی قوی می باشد. تحقیقات نشان داد که در این ترکیبات بین اتم هیدروژن و اتم دیگری که اندازه ای کوچک اما الکترونگاتیویته زیاد دارد یک پیوند تشکیل شده است که آن پیوند را پیوند هیدروژنی (Hydrogen bond) نامیدند. قدرت این پیوند نسبت به نیروهای واندروالسی بیشتر اما نسبت به پیوندهای کووالانسی و یونی ضعیف تر می باشد. برای آشنایی با پیوند هیدروژنی و انواع آن در ادامه مقاله با ما در نشریه جهان شیمی فیزیک همراه باشید
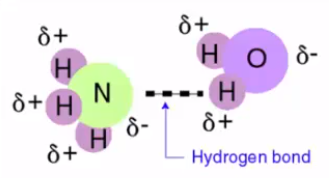
پيوند هيدروژنی در واقع يک برهمکنش غير کووالانسی و جاذبه ای بين يک دهنده پروتون (X-H) و يک پذيرنده پروتون (Y) در همان مولکول يا مولکول ديگر مي باشد که به صورت X-H···Y نمايش داده می شود. بر اساس تعريف مرسوم، اتم H متصل به اتم های الکترونگاتيو مانند نیتروژن، اکسیژن و فلوئور می باشد، و اتم Y يک گروه الکترونگاتيو يا يک گروه دارای الکترون اضافی است. توجه داشته باشید که این پیوند، پیوندی جدا از پیوند های دوقطبی – دو قطبی نیست، بلکه یکی از انواع آن می باشد.
نحوه تشکیل
به طور کلی پيوند هيدروژنی در اثر نيرو های جاذبه بين بار های الکتريکي مخالف کوچک بوجود می آيد. در پیوند X-H، اتم الکترونگاتیوتر X الکترون های پیوندی را به سمت خود کشیده و آنها را از اتم هیدروژن دور میکند. بنابراین سبب ایجاد بار مثبت قابل توجه بر روی اتم هیدروژن می گردد.
اتم هیدروژن این مولکول و زوج الکترون غیر پیوندی مولکول دیگر، همدیگر را جذب کرده و پیوند هیدرژنی تشکیل می شود. اگر اختلاف الکترونگاتیویته بین دو اتم زیاد نباشد، پیوند تشکیل نمی شود. به عنوان مثال به دلیل اختلاف الکترونگاتیویته کم بین دو اتم فسفر و هیدروژن، مولکول PH۳ برخلاف مولکول NH۳ توانایی تشکیل پیوند هیدروژنی را ندارد.
توجه داشته باشید که به دلیل کوچک بودن اتم هیدروژن، تنها قادر است یک پیوند هیدروژنی تشکیل دهد. علاوه بر آن، جا به جا شدن الکترون های پیوندی به سمت عنصر الکترونگاتیوتر (X) باعث میشود که این اتم دارای بار جزئی منفی شود. بنابراین خود اتم X نیز می تواند درگیر این پیوند شود.
اگر بخواهیم این پیوند را توصیف کنیم، می توان گفت که در این پیوند، هیدروژن همانند پلی به دو اتم الکترونگاتیو متصل شده است. به عنوان مثال همان حالت X-H···Y را در نظر بگیرید. در این ساختار اتم هیدروژن از یک سمت به طور کوالانسی با اتم الکترونگاتیو X و از طرف دیگر به طور الکترواستاتیکی (جاذبه مثبت – منفی) با اتم الکترونگاتیو دیگر (Y) پیوند داده است.
عوامل موثر بر قدرت پیوند هیدروژنی
شناخت عوامل موثر بر قدرت پیوند هیدروژنی در زمینه های مختلف اهمیت زیادی دارد. هرچه الکترونگاتیویته اتم متصل به اتم هیدروژن بالاتر باشد، پیوند حاصله قوی تر می باشد. زیرا هرچه الکترونگاتیویته اتم متصل به هیدروژن بیشتر باشد، سبب می شود که بار مثبت بر روی اتم هیدروژن زیادتر گردد. بنابراین زوج الکترون مولکول دیگر را با شدت بیشتری جذب می کند.
به عنوان مثال الکترونگاتیویته اتم اکسیژن بالاتر از اتم نیتروژن می باشد، بنابراین پیوند تشکیل شده به وسیله اتم اکسیژن در مقایسه با اتم نیتروژن قوی تر است. بر همین اساس اتم فلوئور که الکترونگاتیوترین عنصر شناخته شده می باشد، قویترین پیوند هیدروژنی را تشکیل می دهد.
کوچک بودن اتم های متصل به هیدروژن نیز در قدرت پیوند تاثیر گذار است. به عنوان مثال، الکترونگاتیویته اتم های نیتروژن و کلر نزدیک به هم می باشد، اما به دلیل بزرگ تر بودن اتم کلر نسبت به اتم نیتروژن، کلر پیوند ضعیف تری را تشکیل میدهد. البته کوچک بودن اندازه اتم هیدروژن نیز بی تاثیر نیست. زیرا باعث می شود که ملکول دوم بتواند راحت تر به هیدروژن نزدیک شود.
عوامل دیگری از جمله شکل هندسی مولکول، فاصله دو اتم الکترونگاتیو از یکدیگر، طول پیوند X-H، طول پیوند هیدروژنی H···Y، زاویه پیوندی XHY و همچنین قدرت اسیدی و بازی گروه های پروتون دهنده و پروتون گیرنده بر قدرت پیوند هیدروژنی تاثیر گذار هستند.
انواع پیوند هیدروژنی
به طور کلی دهنده و پذيرنده پيوند هيدروژنی می توانند از يک مولکول يا دو مولکول باشند. در حالت اول پيوند هيدروژنی درون مولکولی و حالت دوم پيوند هيدروژنی بين مولکولی تشکیل می شود. یک دسته دیگر از پیوند داریم که به پیوند هیدروژنی نا متداول معروفند. در ادامه به بررسی این نوع پیوند هم خواهیم پرداخت.
پیوند هیدروژنی درون مولکولی
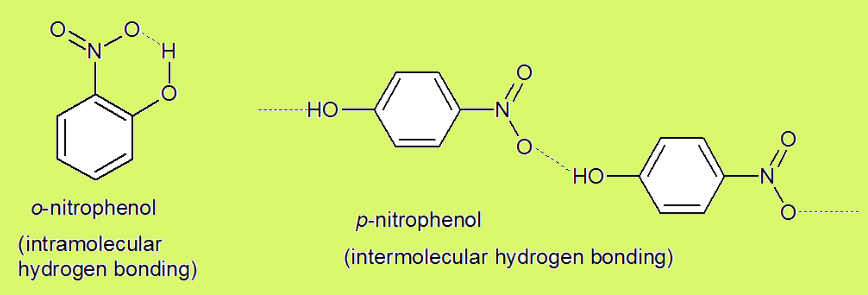
در پیوند های هیدروژنی درون مولکولی (Intramolecular Hydrogen Bonds)، دهنده و پذيرنده پيوند در یک مولکول واحد و در نزدیکی هم وجود دارند. این مولکول باید به قدر کافی بزرگ باشد که بتواند روی خود خم شده تا پیوند تشکیل شود. بنابراین مشخص است که پيوند هيدروژنی درون مولکولی يک پيوند خميده خواهد بود. این پیوند، نقش بسیار مهمی در شکل گیری و پایداری مولکول دارد.
به طور مثال، در مولکول اورتو نیترو فنول (ortho nitrophenol)، به دلیل نزدیکی گروه های دهنده و پذيرنده پيوند، پیوند هیدروژنی درون مولکولی تشکیل می شود، اما در مولکول پارا نیترو فنول (para nitrophenol) همچین امکانی وجود ندارد.
پیوند هیدروژنی بین مولکولی
در پیوندهای هیدروژنی بین مولکولی (Intermolecular Hydrogen Bonds)، دهنده و پذيرنده پيوند در دو مولکول شبیه به هم و یا در دو مولکول متفاوت وجود دارند. برای تشکیل پیوند باید شرایط گفته شده در بخش نحوه تشکیل پیوند وجود داشته باشد. پیوند تشکیل شده خطی يا تقريبا خطی است.
به عنوان نمونه از دو مولکولی که شبیه هم هستند می توان به پیوند بین دو مولکول آب، بین دو مولکول مولکول پارا نیترو فنول و یا بین دو مولکول آمونیاک اشاره کرد. پیوند بین مولکول های آب و آمونیاک و یا پیوند بین مولکول های آب و الکل، بین مولکول های غیر شبیه تشکیل شده است.
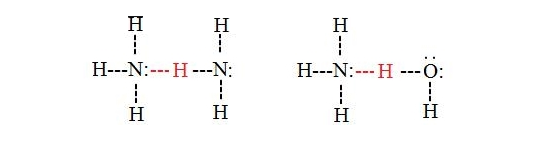
پیوند هیدروژنی نا متداول
در این نوع پیوند، گروه های دهنده و پذيرنده پيوند با گروه های شرکت کننده در پل های هيدروژنی کلاسيک کاملا تفاوت دارند. در واقع، سه دسته از پیوند های هيدروژنی نامتداول (unusual hydrogen bonds) پيشنهاد شده است که عبارتند از:
۱- ترکيباتی که دارای گروه هاي دهنده غير متداول هستند، مانند گروه C-H و غیره.
۲- گروهی که پذيرنده غير متداول دارند مانند يک اتم کربن يا يک سيستم π .
۳- ترکيباتی که هم دهنده و هم پذيرنده گروه های غير متداول باشند.
خواص ترکیبات دارای پیوند هیدروژنی
ترکیباتی که در آنها مولکول ها از طریق این پیوند به یکدیگر متصل اند، نقطه جوش، نقطه ذوب آنتالپی تبخیر، آنتالپی ذوب وگرانروی (ویسکوزیته) بالایی دارند.
تاثیر پیوند هیدروژنی بر نقطه جوش
اگر ترکیبات هیدروژن دار عناصر گروه چهارم (CH۴ ،SiH۴ ،GeH۴ و SnH۴) را در نظر بگیرید، مشخص می شود که نقاط جوش با افزایش اندازه مولکولی زیاد می شود. این ترکیبات غیر قطبی اند، بنابراین تغییرات نقاط جوش بر طبق روال پیش بینی شده برای ترکیبات با نیرو های بین مولکولی لاندن مطابق است.
در ترکیبات هیدروژن دار عناصر گروه های پنجم، ششم و هفتم نقطه جوش نخستین عضو هر گروه به طور غیر عادی بالاتر از سایر ترکیبات آن گروه است. وجود پیوند هیدروژنی در ترکیبات NH۳، H۲O و HF باعث گردیده که مولکول ها از مایع سخت تر جدا شوند، بنابراین نقطه جوش بالاتر رود. در ترکیب آب به دلیل تعداد بیشتر پیوند هیدروژنی نسبت به HF، نقطه جوش بیشتر می باشد.
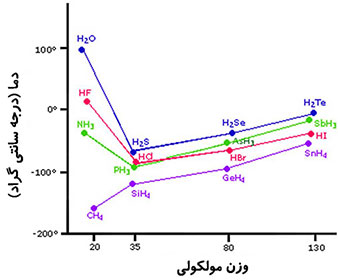
تاثیر پیوند هیدروژنی بر نقطه ذوب
همان تاثیری که این پیوند بر نقطه جوش دارد را می توان به طور مشابه بر روی نقطه ذوب نیز دید. در واقع وجود نیروی جاذبه قوی تر از نیروی جاذبه دوقطبی-دوقطبی سبب بالاتر رفتن نقطه ذوب این ترکیبات نسبت به سایر ترکیبات می شود.
تاثیر پیوند هیدروژنی بر گرانروی
ترکیباتی که پیوند هیدروژنی تشکیل می دهند، گرانروی بیشتری نسبت به سایر ترکیبات دارند. همچنین، با افزایش تعداد این پیوندهای تشکیل شده، گرانروی بیشتری خواهند داشت.
اهمیت و کاربرد پیوند هیدروژنی
پیوند هیدروژنی يکي از برهمکنش هايی است که بطور گسترده در علوم فيزيک، شيمي، بیو شیمی و زيست مورد مطالعه قرار گرفته است و در بسیاری از فرآیند های مهم طبیعی نقش و اهمیت فوق العاده ای دارد. در این بخش به اهمیت و کاربرد این پیوند می پردازیم.
این پیوند در ساختار سه بعدی مولکول هایی نظیر DNA، RNA، قند ها، پروتئین ها و و لیپیدها نقش اساسی دارد. همچنین در سیستم انتقال آب در گیاهان نیز می توان حضور آن را دید. از طرفی برخی از خواص منحصر به فرد آب به دلیل وجود پیوند هیدروژنی بین مولکول های آب می باشد. در ادامه به توضیحی مختصر درباره این موارد می پردازیم.
پیوند هیدروژنی در مولکول های DNA و RNA
پيوند هيدروژنی يکی از مهمترين عوامل پايداری مارپيچ دوگانه مولکول های DNA و RNA می باشد. مولکول بزرگ DNA از چهار نوکلئوتید تیمین (T)، گوانین (G)، سیتوزین (C) و آدنین (A) تشکیل شده است. در ساختار RNA نوکلئوتید یوراسیل (U) به جای نوکلئوتید تیمین قرار دارد.
برای تشکیل ساختمان مارپیچ DNA، دو رشته مکمل به گونه ای رو به روی هم قرار می گیرند که نوکلئوتید C با G و نوکلئوتید A با T بتوانند پیوند هیدروژنی تشکیل دهند. در واقع آنچه که سبب می شود دو رشته DNA متصل و در هم تنیده باقی بمانند این پیوند است.
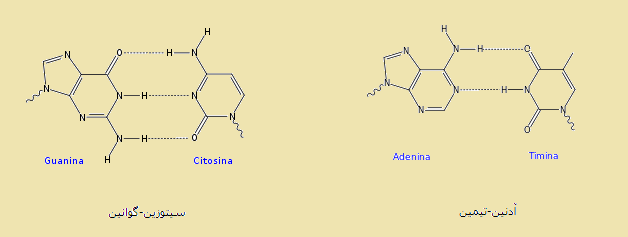
پیوند هیدروژنی در پروتئین ها
پروتئین ها از روی DNA سنتز می شوند. گروه های C=O و NH در ساختار پروتئین، پیوند هیدروژنی تشکیل می دهند و سبب پايداری پروتئين می گردند. در واقع می توان گفت که این پيوند کنترل ساختار پروتئين، پيچ خوردن، صفحه ای شدن، خاصيت کاتاليزوری آنزيم ها و خواص ديگر آنها را بر عهده دارد.
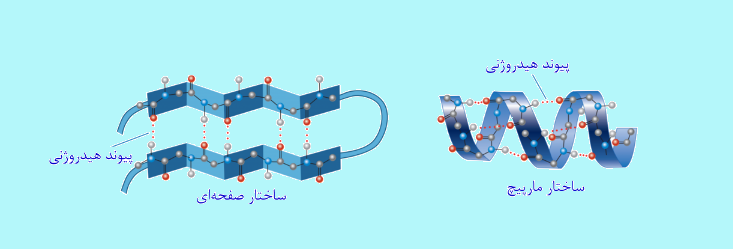
پیوند هیدروژنی در آب
یک نمونه بسیار خوب از پیوند های هیدروژنی، مولکول آب می باشد. در واقع تمام خواص شگفت انگیز و غیر عادی آب، از این پیوند های میان مولکول های آن سرچشمه می گیرد. زمانیکه مولکول های آب در کنار هم قرار می گیرند، میان اتم هیدروژن از یک مولکول و اتم اکسیژن از مولکول دیگر پیوند هیدروژنی تشکیل می شود.
اتم اكسيژن در مولکول آب، دو الكترون ناپیوندی لايه ظرفيت خود را با دو اتم هيدروژن از دو مولکول آب دیگر به اشتراك می گذارد. از طرفی دیگر، همین مولکول آب، دو اتم هیدروژن با بار جزئی مثبت دارد که می توانند با اتم های اکسیژن دو مولکول آب دیگر که در اطرافش وجود دارند پیوند تشکیل دهند. بنابراین، هر مولکول آب توانایی تشکیل ۴ پیوند هیدروژنی با مولکول های آب اطراف خود را دارد.
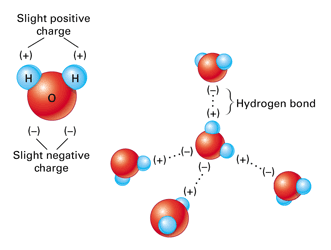
همان طور که بیان شد، پيوندهای هيدروژنی بين مولكول های آب، خواص ويژه ای به آن می بخشند، تاثیر این پیوند بر نقطه جوش، نقطه ذوب و ویسکوزیته در بخش قبلی بررسی شد. در این قسمت بعضی دیگر از خواص ویژه آب بررسی می شوند.
شناور بودن یخ
در حالت مایع، مولكول های آب دائما در حال حرکت می باشند، بنابراین پيوند های هيدروژنی بين آن ها مرتبا در حال تغيير و تبديل اند. در واقع این پیوند ها، شکسته شده و دوباره تشکیل می شوند. با افزايش دما، انرژی جنبشی مولكول ها نیز افزایش می یابد، پس تعداد پيوند های هيدروژنی كم می شود. فقط در حالت جامد (يخ) است كه انرژی جنبشی مولكول ها به حداقل خود رسیده، بنابراین چهار پيوند هيدروژنی بين مولكول هاي آب تشکیل می شود.
چگالی آب با دما تغيير می کند كه اين تغيير در ۴ درجه به حداكثر میزان خود می رسد. به علت تشكيل حفره های تو خالي در شبكه كريستالی يخ، حجم یخ بیشتر می شود. بنابراین با كمتر بودن چگالی يخ نسبت به آب، يخ در سطح آب شناور می شود. تصور کنید که چگالی يخ بیشتر از آب بود، در این صورت آب كف دريا ها و رودخانه ها يكپارچه منجمد مي شد. بنابراین تمام موجودات کف آب از بین می رفتند.

ظرفيت گرمايی آب
به دلیل تشکیل پيوند های هيدروژنی، آب ظرفيت گرمايی بسیار بالايی دارد. در واقع می تواند بدون اینکه درجه حرارتش تغيير كند گرمای زيادی را جذب كند و يا از دست بدهد. گرمای ویژه آب سبب می شود که دمای کره زمین در محدوده قابل حیات تنظیم شود.
گرماي نهان آب
به دلیل تشکیل پيوند های هيدروژنی، آب گرماي نهان بالايی دارد. گرمای نهان به انرژيی گفته می شود كه مقدار معينی از جسم (مثلا يك گرم و يا يك مول) می گيرد و بدون تغيير دما از حالتی به حالت ديگر تبديل می شود .
آب به عنوان حلال
همان طور که می دانید آب يك حلال بسیار مناسب برای تركيب های قطبی و يونی است. همچنین تعدادی از مواد را به كمك این پيوند ها در خود حل می کند. نکته جالب توجه اینجاست که در نتیجه حفره های به وجود آمده از پيوند های هيدروژنی می تواند گازهايی نظير اكسيژن و دی اكسيد كربن را نیز گیر بیاندازد.
قابلیت انحلال پذیری در آب همچنین در برخی آنیون های اکسیژن دار (مثلا –SO۴۲) نیز دیده می شود. قضیه در مورد کاتیون ها کمی متفاوت است. شرط تشکیل این پیوند، بین یک کاتیون و آب اینست که کاتیون دارای اتم های هیدروژن باشد (مانند کاتون +NH۴).
كشش سطحی آب
بین مولکول های آب سطح رودخانه پیوند های هیدروژنی تشکیل می شود، بنابراین یک لایه به هم پیوسته و نسبتا محكم در سطح آب ایجاد می گردد. این پدیده به نام كشش سطحی شناخته شده است. این خاصیت باعث ایستادن حشرات در روی سطح آب و همچنین بالا رفتن آب از لوله های موئین می شود. توجه داشته باشید که با افزایش دمای آب به دلیل كم شدن تعداد این پیوند ها، کشش سطحی آب كاهش می یابد.

پیوند هیدروژنی و انحلال پذیری
بعضی از ترکیبات حاوی اتم های اکسیژن، نیتروژن و فلور (به عنوان مثال آمونیاک و متانول) به دلیل تشکیل پیوندهای هیدروژنی در برخی حلال های هیدروژن دار از جمله آب، به راحتی حل می شوند.
دیگر کاربرد های پیوند هیدروژنی
پیوندهای هیدروژنی در بسیاری از مواد دیگر نیز یافت می شوند. به عنوان مثال در هیدروژن فلوراید (HF)، کلروفرم (CH۳Cl)، استیلاستون (C۵H۸O۲)، مولکول اوره (CH₄N₂O) پلیمرها و نایلون ها این پیوند تشکیل می شود.
مقایسه انرژی پیوند هیدروژنی با سایر پیوند ها
همان طور که قبلا بیان شد قدرت پیوندهای هیدروژنی از پیوند های یونی و کووالانسی ضعیف تر و از برهمکنش های واندروالس قوی تر می باشد. به عنوان مثال انرژی پیوند در پیوند های هیدروژنی در محدوده ۵۰-۵ کیلو ژول بر مول است. درحالیکه انرژی پیوند پیوند های کووالانسی در حدود ۱۰۰-۱۱۰۰ کیلو ژول بر مول و در نیروهای واندروالس تقریبا ۴ کیلو ژول بر مول می باشد.
تفاوت پیوند هیدروژنی و کووالانسی
پیوندهای کووالانسی نوعی پیوند شیمیایی هستند که وقتی دو اتم یک جفت الکترون به اشتراک می گذارند تشکیل می شود. این اشتراک الکترون ها به هر دو اتم اجازه می دهد تا به پیکربندی الکترونی پایدارتری دست یابند. پیوندهای کووالانسی قوی هستند و عموماً شامل پیوند عناصر غیرفلزی با یکدیگر هستند.
پیوندهای هیدروژنی نوعی برهمکنش ضعیف الکترواستاتیکی هستند که بین یک اتم هیدروژن (H) و یک اتم بسیار الکترونگاتیو مانند نیتروژن (N)، اکسیژن (O) یا فلوئور (F) رخ می دهد. اتم هیدروژن معمولاً به یک اتم الکترونگاتیو پیوند کووالانسی دارد، در حالی که اتم الکترونگاتیو دیگر از طریق پیوند هیدروژنی با اتم هیدروژن تعامل دارد. پیوندهای هیدروژنی ضعیفتر از پیوندهای کووالانسی هستند، اما نقش اساسی در ساختار و عملکرد مولکولهای زیستی مانند DNA و پروتئین دارند.
تفاوت عمده بین پیوندهای کووالانسی و هیدروژنی به شرح زیر استپیوندهای کووالانسی شامل اشتراک جفت الکترون بین اتم ها است، در حالی که پیوندهای هیدروژنی برهمکنش های الکترواستاتیکی بین یک اتم هیدروژن و یک اتم بسیار الکترونگاتیو هستند. ۲. پیوندهای کووالانسی قویتر و پایدارتر از پیوندهای هیدروژنی هستند. ۳. پیوندهای کووالانسی شامل عناصر غیر فلزی هستند، در حالی که پیوندهای هیدروژنی به طور خاص شامل هیدروژن و یک عنصر بسیار الکترونگاتیو (معمولاً N، O یا F) هستند. ۴. پیوندهای کووالانسی ساختار اصلی مولکول ها را تشکیل می دهند، در حالی که پیوندهای هیدروژنی به ساختارها و عملکردهای سه بعدی زیست مولکول ها کمک می کنند.



















