مدل اتمی بور – تعریف و محدودیت ها

در راستای تکمیل ارایه نظریه اتمی، دانشمندان زیادی برای توجیه رابطه موجود بین طیف نشری خطی هیدروژن و ساختار اتم نظریه های مختلفی بیان کردند. نیلز بور دانشمند دانمارکی در سال ۱۹۱۳ بعد از ارایه مدل اتمی رادرفورد در راستای تصحیح آن مدل اتمی را مطرح کرد که به مدل اتمی بور معروف است و امروزه این مدل اتمی مورداستفاده و تایید همگان است. این مقاله نشریه جهان شیمی فیزیک به چگونگی ارایه این نظریه می پردازد.
فرضیات بور
۱- الکترون ها در مسیر دایره ای شکلی در اطراف هسته که مدار (اوربیتال) نامیده می شود در حال حرکت هستند.
۲- این الکترون ها در اطراف هسته در فاصله های ثابت و معینی که مقادیر انرژی مشخصی دارند می توانند حرکت کنند. به هر کدام از این مقادیر انرژی تراز انرژی می گویند و تا زمانی که الکترون ها در مسیر خودشان حرکت می کنند هیچ تابش انرژی نخواهیم داشت. چندین اوربیتال یک پوسته را تشکیل می دهد.
۳- پوسته ها و سطوح انرژی در اتم را با اعداد n (عدد کوانتومی اصلی) نشان می دهند که از n = 1 شروع می شود و اعداد صحیحی است.
۴- الکترون ها در حالت پایه در نزدیک ترین تراز انرژی به هسته با کمترین سطح انرژی قرار دارند، اما می توانند با گرفتن انرژی به تراز انرژی بالاتر رفته و برانگیخته شوند. یعنی از تراز انرژی با n کمتر به تراز انرژی با n بیشتر می روند. همچنین الکترون ها چون در حالت برانگیخته ناپایدار هستند با نشر و از دست دادن انرژی به تراز پایه برمی گردد. مقدار این انرژی با اختلاف انرژی دو سطح برابر است. بور با کوانتومی در نظر گرفتن مقدار این انرژی توانست طیف نشری خطی هیدروژن را توجیه کند.
۵- همچنین هر کدام از این پوسته ها از چند زیر پوسته تشکیل شده است.
تعریف مدل اتمی بور
در مدل اتمی رادرفورد بیان شد که هسته ای با بار مثبت در مرکز اتم قرار دارد و بارهای منفی (الکترون ها) در اطراف آن قرار دارند. اما بور با تکمیل این نظریه مدل اتمی خودش را این طور مطرح کرد که اتم از هسته ای با بار الکتریکی مثبت در مرکز تشکیل شده و الکترون ها با بارالکتریکی منفی در ترازهای انرژی ثابتی در اطراف آن در حرکت هستند (مانند حرکت سیارات به دور خورشید). هر کدام از این ترازها که در بالا نیز گفته شد، از تراز n = 1 تا ترازهای بالاتر با حروف الفبایی K, L, M, N, O,… مشخص می شوند. الکترون ها در این مدارها به مدت طولانی می تواند حرکت کند ولی بین دو مدار هرگز نمی تواند باشد. حداکثر تعداد الکترون هایی که می تواند در این ترازهای انرژی قرار بگیرد به ترتیب از تراز n = 1 برابر با ۲، ۸، ۱۸و در تراز چهارم ۳۲ خواهد بود. در کل تعداد این الکترون ها با فرمول کلی ۲n۲ تعیین می شود.
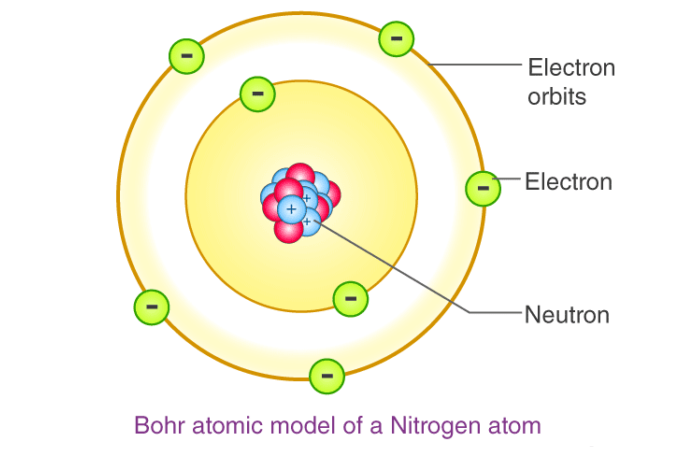
توجه :
الکترون ها درترازهای دورتر از هسته دارای سطح انرژی بیشتری نسبت به ترازهای انرژی نزدیک هسته هستند. بر اثر انتقال الکترون از سطح انرژی بالاتر به تراز پایین، انرژی به صورت گرما و نور آزاد می شود که وقتی از منشور عبور داده می شود طیف نشری آن مشخص می شود. بور آزمایشات خود را روی اتم های هیدروژن و هلیم انجام داد و دانشمندان دیگری چون پلانک و شرودینگر نظریه های زیادی برای تکمیل این مدل اتمی ارائه دادند که در نهایت به مدل اتمی کوانتومی رسیدند که الان قابل قبول است. مدل اتمی بور برای اتم های سنگین قابل توجیه نبود.
طیف های اتمی و مدل بور
وقتی اتم در حالت برانگیخته انرژی خود را به صورت نشر نور (فوتون) آزاد می کند به طول موج های نشر شده طیف نشری می گویند که به صورت خطوط طیفی روشن در زمینه ی سیاه ظاهر می شود. برعکس وقتی یک اتم انرژی معادل اختلاف انرژی بین دو تراز را جذب کرده و برانگیخته می شود به این طول موج های جذب شده، طیف جذبی می گویند که به صورت خطوط طیفی تیره در زمینه ی روشن ظاهر می شود. هر خط طیفی نمایشگر یک اختلاف انرژی بین دو سطح انرژی است. هر اتم ترازهای انرژی مخصوصی دارد، پس به دنبال آن می توان گفت هر اتم خط طیف جذبی و نشری مخصوصی دارد.
نکته :
بور با مطالعه طیف نشری هیدروژن (طیف های اتمی خطی هستند) اطلاعات زیادی راجع به ساختار اتم به دست آورد. به هر دسته از خطوط طیفی طیف نشری هیدروژن یک سری گفته می شود. سری های مربوط به طیف نشری اتم هیدروژن به صورت زیر است :
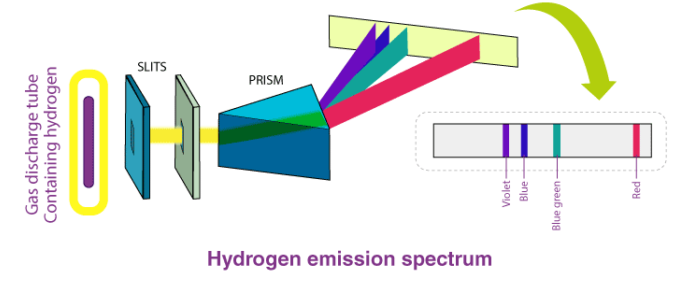
سری لیمان :
در طیف نشری اتم هیدروژن خطوط طیفی که مربوط به انتقال الکترون از ترازهای بالاتر (ترازهای بالاتر از تراز اول) به تراز انرژی n = 1 است را سری لیمان (نام دانشمندی که روی این خطوط مطالعه کرده است) می گویند که در ناحیه فرابنفش قرار دارد.
سری بالمر :
به خطوط طیفی که مربوط به انتقال الکترون از ترازهای بالاتر از تراز دوم به تراز n = 2 است را سری بالمر گویند که خط اول آن در ناحیه مرئی و بقیه خط های آن در ناحیه فرابنفش است.
سری پاشن :
به خطوط طیفی که مربوط به انتقال الکترون از ترازهای بالاتر از تراز سوم به تراز n = 3 است را سری پاشن می گویند که در ناحیه زیر قرمز قرار دارد.
سری براکت و فوند :
همچنین به دسته خطوط طیفی که در آن انتقال الکترون از ترازهای بالاتر از تراز چهارم به n = 4 صورت می گیرد سری براکت و به دسته خطوط طیفی که الکترون از ترازهای بالاتر از تراز پنجم به n = 5 می رود را سری فوند می گویند که هر دوی این سری ها در ناحیه زیر قرمز قرار دارد.
محدودیت های مدل اتمی بور
۱- اول اینکه این مدل فقط روی هیدروژن قابل توجیه و موفقیت آمیز است و برای اتم های پیچیده تر قابل توضیح نیست.
۲- مدل اتمی بور خطوط اضافه ایجاد شده و علت شدید بودن برخی خطوط در حضور میدان الکترومغناطیسی برای اتم های غیر از هیدروژن را نمی توانست توضیح دهد (اثر زیمان و استارک). یعنی طیف نشری اتم های دیگر را نمی توانست توصیف کند.
۳- در مدل اتمی بور وضعیت و موقعیت مدارها که آیا زاویه دار یا در یک صفحه هستند، مشخص نبود. اما بعدها معلوم شد که چرخش الکترون ها سه بعدی است.
۴- این مدل اتمی با اصل عدم قطعیت هایزنبرگ مطابقت نداشت.
با وجود این محدودیت ها مدل اتمی بور در زمان خود بی نظیر بود و بیشترین کمک را به توجیه ساختار اتم ها کرد و به تدریج با کشف پروتون ها و نوترون ها کامل و کامل تر شد و این مدل به بیان موضوعاتی پرداخت که زمینه ی مکانیک کوانتوم را مهیا کرد.
مدل اتمی بور برای عناصر جدول تناوبی
شما می توانید تصویر یک اتم را در اینترنت جستجو کنید و آن را پیدا خواهید کرد، حتی اگر قبلاً هیچ کس واقعاً یک اتم را ندیده باشد. اما ما به دلیل کار گروهی از دانشمندان مختلف مانند نیلز بور، فیزیکدان دانمارکی اکنون تخمینی از ظاهر یک اتم داریم.
اتم ها بلوک های سازنده ماده هستند – یک اتم منفرد از هر عنصر منفرد اساسی ترین موجود در طبیعت است که هنوز از قوانین فیزیک پیروی می کند که می توانیم در زندگی روزمره مشاهده کنیم (ذرات زیر اتمی که اتم ها را می سازند قوانین خاص خود را دارند) . دانشمندان قبل از اینکه بتوانند ساختار خود را مفهومی کنند، گمان می کردند که اتمها برای مدت طولانی وجود داشته اند – حتی یونانیان باستان تصور می کردند که ماده جهان از اجزای بسیار کوچکی تشکیل شده است که نمی توان آنها را به چیز کوچک تر تجزیه کرد و آنها این واحدهای بنیادی را اتم نامیدند که به معنای “تقسیم نشده” است. در پایان قرن نوزدهم، مشخص شد که مواد شیمیایی را می توان به اتم هایی که بسیار کوچک بودند و اتم های عناصر مختلف وزن قابل پیش بینی داشتند، تجزیه کرد.
مدل اتم بور یا مدل اتم بور سیستمی است که در آن الکترون در مداری ثابت به دور هسته حرکت می کند. برای ۲۰ عنصر اول جدول تناوبی، مدل بور ساختار اصلی اتمهای آنها مانند عدد اتمی، عدد جرمی، تعداد پروتون ها، تعداد الکترون ها، پیکربندی الکترونیکی و ظرفیت را نشان می دهد.
هیدروژن: عدد اتمی-۱، جرم عدد-۱، تعداد پروتون-۱، تعداد الکترون-۱، پیکربندی الکترونیکی- ۱s1، ظرفیت-۱.
هلیوم: عدد اتمی-۲، عدد جرمی-۴، تعداد پروتون-۲، تعداد الکترون-۲، پیکربندی الکترونیکی-۱s2، ظرفیت-۰.
کلسیم: عدد اتمی-۲۰، عدد جرمی-۴۰، تعداد پروتون-۲۰، تعداد الکترون-۲۰، پیکربندی الکترونیکی- ۱s2 2s2 2p6 3s2 3p6 4s2، ظرفیت-۲.
توجه داشته باشید که عدد اتمی با تعداد پروتون ها و الکترون ها مطابقت دارد و ظرفیت با تعداد الکترون ها در بیرونی ترین مدار تعیین می شود.
مدل اتمی بور علوم هشتم
مدل اتمی بور یکی از مدل های مهم در تاریخ علم است که ساختار اتمها و نحوه حرکت الکترون ها در اطراف هسته را نشان می دهد. این مدل توسط نلسن بور، فیزیکدان دانمارکی، ارائه شد.
بور فرض کرد که الکترون ها در مدارهایی با اندازه و انرژی خاص به دور هسته حرکت می کنند. این مدارها به نام مدارهای انرژی یا لایه های انرژی شناخته شده و یک سطح انرژی خاصی دارد. یکی از مهمترین ویژگیهای مدل بور این است که الکترون ها در مدارهای ثابت حرکت می کنند و تغییری در سطح انرژی آنها ایجاد نمی شود.
وقتی الکترونی از یک مدار به مدار دیگر منتقل می شود، انرژی مشخصی جذب یا آزاد میکند که به شکل پرتوهای نوری ظاهر می شوند که به عنوان طیف های نوری شناخته می شوند و برای هر اتمی منحصر به فرد است.
مدل اتمی بور به ویژه در توضیح طیف های نوری اتم ها بسیار مؤثر بود با اینحال به دلیل امکانات محدود آن زمان مدل بور محدودیت هایی داشت که با پیشرفت علم فیزیک و مدل های بعدی مانند مدل کوانتومی، اصلاح شد. با اینحال مدل بور پایه گذار بسیاری از مفاهیم مهم در فیزیک و شیمی امروز است.



















