انواع نیروی واندروالسی و خواص آن در یگ نگاه
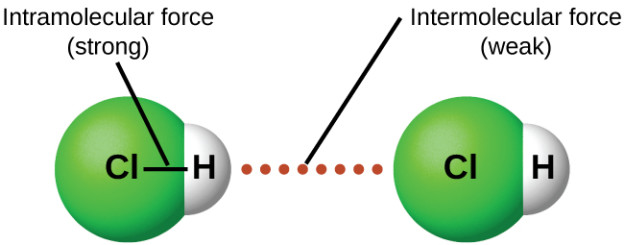
اتم ها با نیرویی به نام پیوند کووالانسی مولکول ها را تشکیل می دهند. اما در یک ماده به حالت های مختلف مولکول ها با نیرویی به نام نیروی واندروالسی کنار هم قرار می گیرند. این نیروهای بین مولکولی حالت های مختلف جامد و مایع بودن را تعریف می کنند. مثلا وقتی یک جامد ذوب می شود باید بر نیروی بین مولکول های آن غلبه شود و برای این کار انرژی مصرف می شود و مولکول ها به شکل مایع در می آیند. این مقاله نشریه جهان شیمی فیزیک به بیان انواع نیروهای واندروالسی می پردازد.
تاریخچه و تعریف
در سال ۱۸۷۳ واندروالس اولین کسی بود که گفت بین مولکول های گاز نیروی کششی وجود دارد که همین نیروها میزان انحراف یک گاز حقیقی از گاز ایده آل را تعیین می کند. تا اینکه لاندون این نیروها را به طور دقیق معرفی کرد. در کل نیروهای واندروالسی نوعی نیروی الکتروستاتیک بین بارهای مثبت و منفی است که در جامدات و مایعات اهمیت بیشتری نسبت به گازها دارد. در گازها فاصله بین مولکول ها زیاد است و نیروی بین مولکولی ضعیف تر است. اما در فشار بالا در گازها نیروی بین مولکولی قابل توجه و بررسی است.
انواع نیروهای واندروالسی
نیروهای بین مولکولی را می توان در چهار گروه زیر دسته بندی کرد.
۱- نیروهای دوقطبی – دوقطبی
۲- نیروهای دوقطبی – دوقطبی القایی
۳- نیروهای لاندون (پراکندگی)
۴- پیوند هیدروژنی
نیروهای دوقطبی – دو قطبی
وقتی یک مولکول تشکیل می شود اتم های تشکیل دهنده آن در یک پیوند با توجه به اختلاف الکترونگاتیوی که دارند، با بار جزئی برابر و مخالف هم یک دو قطبی ایجاد می کند. اگر بارهای جزئی برابر نباشد یک مولکول قطبی ایجاد می شود. این مولکول های قطبی دارای دوقطبی های دایمی (قطب های مثبت و منفی) هستند. وقتی قطب مثبت یک مولکول به قطب منفی مولکول دیگر نزدیک می شود بین آن ها جاذبه الکتروستاتیکی قوی برقرار می شود که به آن نیروی دوقطبی گفته می شود. از نظر ریاضی به حاصل ضرب بار یک دو قطبی مساوی با علامت مخالف، در فاصله بارهای آن ممان دوقطبی گفته می شود.
μ = δ ₓ r
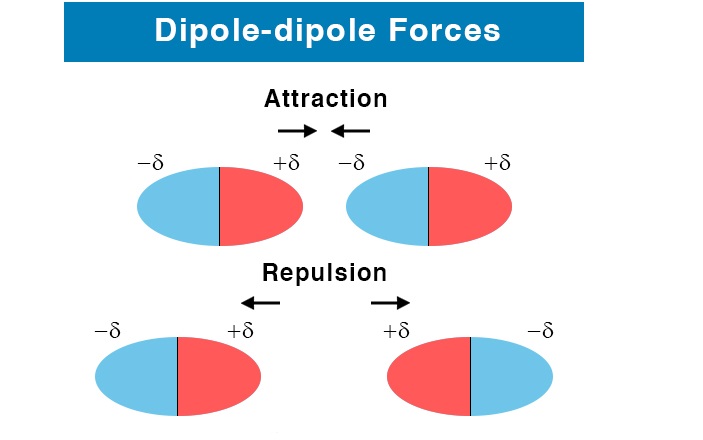
چون در یک مولکول همان طور که گفته شد بارهای جزئی مثبت و منفی وجود دارد (و به نیروی به وجود آمده بین این بارهای جزئی مخالف از دو مولکول نیروی دوقطبی گفتیم)، قدرت آن از پیوندهای یونی کمتر خواهد بود. چون در یون ها بار کامل مثبت و منفی وجود دارد. همچنین نیروهای دو قطبی از برهمکنش های یون _ دوقطبی ضعیف تر است، چون در این مولکول ها یکی از بارها کامل است. وقتی فاصله بین بارهای جزئی مثبت و منفی زیاد شود نیروی دوقطبی – دوقطبی از بین خواهد رفت.
نیروهای دوقطبی – دوقطبی القایی
این نیرو بین یک مولکول قطبی و یک مولکول خنثی یا غیرقطبی ایجاد می شود. وقتی مولکول غیر قطبی در مقابل میدان الکتریکی مولکول قطبی با سرهای مثبت و منفی قرار می گیرد، به طور القائی دارای بار جزئی منفی و مثبت می شود. در نتیجه به یک دوقطبی القائی تبدیل می شود که تحت تاثیر قطبش پذیری مولکول ها و فاصله بین آن ها است.
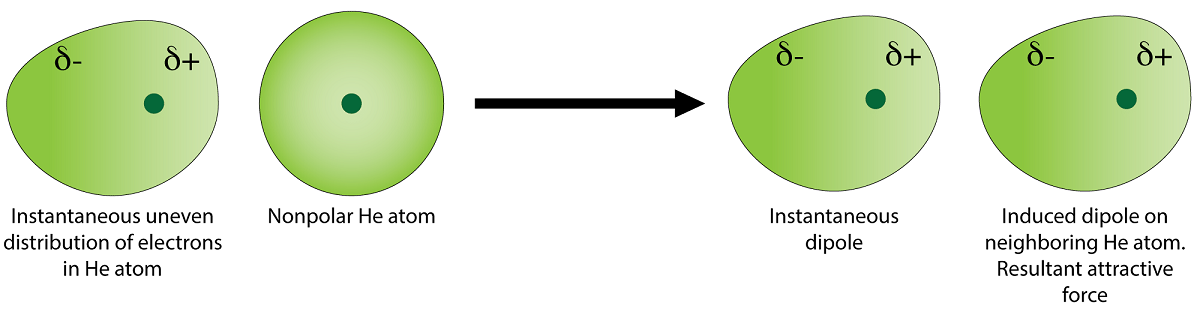
نیروهای لاندون (پراکندگی)
مهمترین نیروی واندروالسی نیروی لاندون می باشد. به غیر از مولکول های قطبی در بین مولکول های غیر قطبی مثل بنزن ، هگزان و ید نیز حالت های مایع و جامد دیده می شود. پس بین این مولکول ها باید نیرویی وجود داشته باشد که بتواند آن ها را کنار هم نگه دارد. دلیل ایجاد این نیرو حرکت و نوسان های کوتاه الکترون ها در اوربیتال های اتم ها و مولکول های غیرقطبی و ایجاد دوقطبی لحظه ای است که در سال ۱۹۳۰ اولین بار فیزیکدان آلمانی به نام فریتز لاندون به بیان آن پرداخت. به افتخار این دانشمند بزرگ نام این نیرو لاندون نامیده می شود.
تشکیل این نیرو :
در یک لحظه ابر الکترونی یک مولکول طوری تغییر شکل پیدا می کند که یک سمت آن نسبت به قسمت دیگر منفی تر می شود، پس یک دوقطبی به وجود می آید. اما در لحظه بعد ممکن است جهت این دوقطبی تغییر کند. دوقطبی ایجاد شده در مولکول مجاور خود، یک دوقطبی دیگر القا می کند. وقتی در یک مولکول دوقطبی ها به وجود آمدند، قطب های با بار جزئی مخالف همدیگر را جذب کرده و بین آن ها نیروی جاذبه لاندون برقرار می شود.
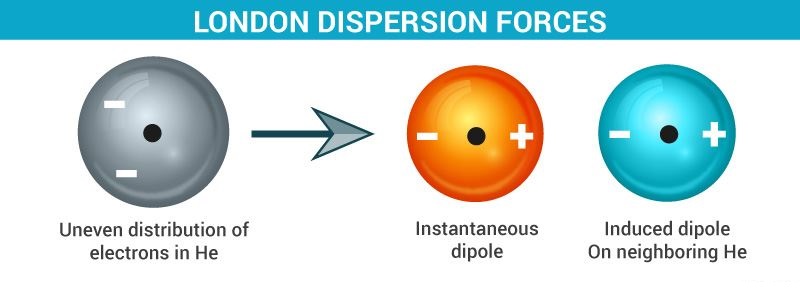
اهمیت نیروی لاندون
همان طور که گفته شد نیروی لاندون مهمترین نیروی واندروالسی است. نیروی لاندون در مولکول های قطبی نیز وجود دارد مثلا مولکول های آب که پیوند هیدروژنی دارند به میزان کمی نیروی لاندون بین مولکول های آن وجود دارد. حتی در مولکول قطبی HCl 85٪ نیروهای بین مولکولی نیروی لاندون می باشد. اما در مولکول های غیرقطبی تنها نیروی واندروالسی بین مولکول ها نیروی لاندون است. کمپلکس ها که مولکول های بزرگی هستند و ابر الکترونی آن ها راحت تر دوقطبی لحظه ای ایجاد می کند، بزرگ ترین نیروی لاندون را دارند و نقاط ذوب و جوش بالایی دارند. در کل نیروی لاندون از نظر قدرت نسبت به نیروهای واندروالسی دیگر، ضعیف می باشد.
عوامل موثر در ایجاد نیروی لاندون (اندازه و شکل مولکول)
یکی از عوامل موثر در ایجاد نیروی لاندون اندازه مولکول هاست. هرچه مولکول ها بزرگتر باشند و فاصله الکترون ها از هسته بیشتر باشد و از طرف هسته کمتر جذب می شوند، توزیع تغییر چگالی الکترون راحت تر انجام شده و دوقطبی لحظه ای به سادگی ایجاد می شود و قدرت نیروی لاندون بیشتر می شود. به عنوان مثال بین پروپان، بوتان و پنتان، نیروی بین مولکولی پنتان بیشترین و پروپان کمترین است.
همچنین عامل شکل و اندازه مولکول نسبت به عامل وزن مولکول بیشتر اثرگذار است. به عنوان مثال اگر دو مولکول هم وزن اندازه مختلفی داشته باشند، مولکول کوچکتر و فشرده تر آزادی حرکت الکترون هایش کمتر بوده و نیروی لاندون ضعیف تری ایجاد می کند. در نتیجه ضعیف بودن نیروی واندروالسی بین آن ها نقاط ذوب و جوش کمتر خواهد بود، چون به انرژی کمتری برای غلبه بر نیروهای بین مولکولی و جدا کردن آن ها نیاز است. مثلا بین ایزومرهای پنتان با توجه به ساختار آن ها نئوپنتان کمترین نقطه جوش را دارد. پس هرچه مولکول سنگین تر باشد و در همولوگ ها اندازه مولکول بیشتر باشد نقطه جوش بالاتر خواهد بود.
پیوند هیدروژنی
به نیروی جاذبه ای که بین اتم هیدروژن و یک اتم با الکترونگاتیوی بالا مثل فلوئور (F)، اکسیژن (O) و نیتروژن (N) برقرار می شود و اتم هیدروژن دارای بار جزئی مثبت و اتم الکترونگاتیو دارای بار جزئی منفی می شود، پیوند هیدروژنی می گویند. به دلیل اختلاف الکترو نگاتیوی زیاد بارهای جزئی منفی و مثبت ایجاد شده و پل هیدروژنی بین آن ها تشکیل می شود. پیوندهای هیدروژنی که می تواند بین اتم ها و یا حتی مولکول ها برقرار شود، از پیوندهای کووالانسی و یونی ضعیف تر ولی از تمام نیروهای واندروالسی قوی تر می باشد. میزان انرژی مورد نیاز برای شکستن یک پیوند هیدروژنی بین ۱ تا ۱۰ کیلوکالری می باشد.
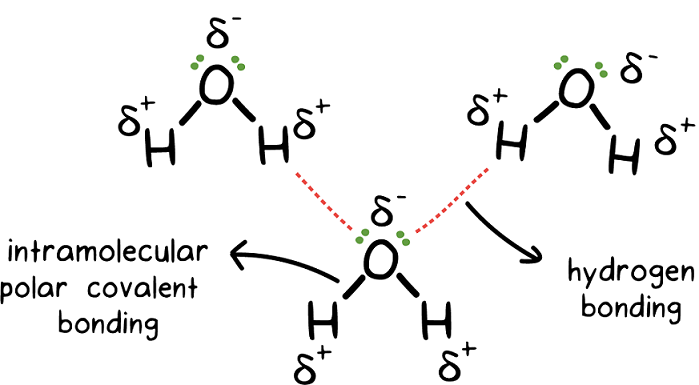
در مولکول های آلی مثل پروتئین ها و اسیدهای نوکلئیک بین گروه های N-H و C=O در دو زنجیر از این مولکول ها، پیوند هیدروژنی وجود دارد که این موضوع نقش مهم بیولوژیکی آن ها را کاملا نشان می دهد.
نیروی واندروالسی یعنی چه
نیروهای واندروالسی مجموعه ای از نیروهای بین مولکولی هستند که از برهمکنش بین مولکول ها ناشی می شوند. برخلاف پیوندهای کووالانسی و یونی قویتر که شامل اشتراک یا انتقال الکترونها بین اتمها است، نیروهای واندروالسی ضعیف تر هستند و ناشی از بارهای الکتریکی گذرا هستند که حتی در مولکولهای خنثی نیز رخ می دهند. قدرت این نیروها از ۰.۴ KJ.mol-1 تا ۴ KJ.mol-1 است. وقتی فاصله بین اتم ها بزرگتر از ۰.۶ نانومتر باشد، نیرو بسیار ضعیف است. ویژگی های نیروهای ون دروالس عبارتند از:
- نیروهای واندروالس در مقایسه با پیوندهای کووالانسی و یونی به طور قابل توجهی ضعیف تر هستند.
- این نیروها از فعل و انفعالات جزئی متعددی تشکیل شده اند که افزایشی هستند.
- بر خلاف سایر انواع پیوند، نیروهای واندروالس اشباع را نشان نمی دهند.
- این نیروها فاقد ویژگی های جهت دار هستند.
- تغییرات دما عموماً بر نیروهای واندروالس تأثیر نمی گذارد، مگر در مورد برهمکنش های دوقطبی-دوقطبی.
با کاهش فاصله بین اتمها یا مولکولها، که در محدودههای کوتاه مؤثر است، قدرت نیروهای واندروالس افزایش مییابد. برخی از کاربردهای نیروهای ون دروالس عبارتند از:
چسبندگی گکو: گکوها می توانند از سطوح صاف بالا رفته و از سقف آویزان شوند. این به دلیل استثمار نیروهای ون دروالس است. این نیروها به آنها اجازه میدهند تا به سطوحی با جاذبه ضعیف بچسبند.
برهمکنش های بین مولکولی: نیروهای واندروالس نقش مهمی در برهمکنش های بین مولکولی بین مولکول ها و اتم ها در گازها، مایعات آلی و جامدات ایفا می کنند و به خواص این مواد کمک می کنند.
معادله واندروالس: معادله واندروالس رفتار گازهای غیر ایده آل (واقعی) را با در نظر گرفتن نیروهای جاذبه بین مولکولی محاسبه می کند و به تعیین مقادیر واقعی برای چنین گازهایی کمک می کند.
ویسکوزیته: نیروهای واندروالس می توانند با افزایش جاذبه بین مولکول ها بر ویسکوزیته یک ماده تأثیر بگذارند و حرکت آنها از کنار یکدیگر را دشوارتر کند.



















