
ساختار لوويس یا لوئیس (Lewis structure) ساختاری است كه در آن عناصر را به وسيله نماد اتمی آن عنصر، پيوند های كووالانسی را به وسيله خط و الکترونهای ظرفیتی غیر پیوندی را با نقطه در كنار نماد شيميايی عنصر نشان می دهند.

در واقع این ساختار نموداری است كه آرايش الكترون های والانس را در اطراف اتم های يك مولكول نمایش می دهد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی ساختار لوويس و نحوه رسم آن پرداخته می شود. با ما همراه باشید.
مقدمه ای بر در ساختار لوويس
ساختار لوويس به پاس زحمات دانشمند آمریکایی، گیلبرت نیوتن لوویس (Gilbert Newton Lewis) که نظریه پیوند های شیمیایی (پیوند کووالانسی) را بیان کرد به این نام نامیده شد. در حقیقت او پیشنهاد داد که اتم ها به کمک اشتراک الکترون می توانند به آرایش اکتت در لایه والانس خود دست یابند و در نتیجه پایدار شوند.
ساختار لوئیس در واقع موقعیت اتم های یک مولکول نسبت به یکدیگر، تعداد و جایگاه پیوند های سیگما (یگانه) و همچنین پیوندهای پای (دوگانه و سه گانه) و در نهایت تعداد و موقعیت الکترون های غیر پیوندی را نشان می دهد. این ساختار به نام های ساختار الکترون نقطه (electron dot structure) و ساختار پیوند ظرفیتی (Valence-bond structure) نیز مشهور می باشد. لازم به ذکر است که در این ساختار بار قراردادی نیز نمایش داده میشود.
برای رسم ساختار لوویس روش های مختلفی وجود دارد. اما ذکر این نکته مهم می باشد که تمام این روش ها بر این اساس استوارند که عناصر نافلزی بر طبق قاعده هشتایی تمایل دارند که تعداد هشت الکترون در لایه ظرفیت خود داشته باشند.

نمایش پیوندهای کووالانسی در ساختار لوويس
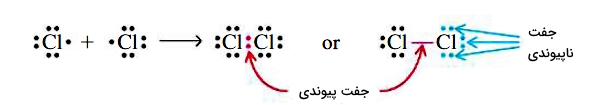
در ساختار لوویس، هر الکترون لایه ظرفیت در ترکیب را با یک نقطه نشان می دهند. زمانیکه دو اتم در پیوند کووالانسی درگیر شوند، الکترون هایی که پیوند کووالانسی تشکیل می دهند (الکترون های اشتراکی) دیگر به یک اتم تنها تعلق ندارند و متعلق به دو هسته می باشند. بنابراین در میان دو اتم نوشته می شوند. به عنوان مثال به ترکیب Cl۲ توجه نمایید.
زمانیکه مولکول بزرگتر شود، رسم تمام الکترون های لایه والانس در اطراف همه اتم های ترکیب دشوار و غیر ممکن خواهد بود. بنابراین برای راحتی بیشتر، جفت الکترون های پیوندی را با یک خط نشان می دهند. حال اگر اتم ها در هنگام تشکیل پیوند دو یا سه الکترون به اشتراک بگذارند به ترتیب پیوند های دو گانه و سه گانه تشکیل می شود. در نتیجه پیوند های دو گانه را به کمک دو خط و پیوند های سه گانه را با سه خط که بین دو اتم کشیده می شود نشان می دهند. به مثال های زیر توجه کنید.
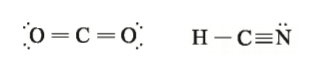
در برخی عناصر، جفت الکترون هایی وجود دارند که در تشکیل پیوند کووالانسی نقشی ندارند، بنابراین متعلق به یک هسته می باشند. این جفت الکترون ها که به الکترون های ناپیوندی (Lone Pairs) مشهورند را به صورت دو نقطه در ساختار لوویس نشان داده می شوند.
مراحل رسم ساختار لوویس
برای رسم ساختار لوویس بهتر است که مراحل زیر به ترتیب طی شوند.
تعیین اتم مرکزی
در قدم اول به کمک فرمول شیمیایی تركيب، اتم مركزی مشخص می شود. اتم مرکزی اتمی است که تعداد آن در فرمول کمتر از تعداد بقیه اتم ها باشد. حال اگر دو اتم با تعداد کمتر و مساوی در فرمول وجود داشته باشد، اتمی به عنوان اتم مرکزی در نظر گرفته می شود که ظرفیت (عدد اکسایش) آن اتم بیشتر و از طرفی الکترونگاتیویته آن کمتر باشد. به عنوان مثال در ترکیب CH۳OH، تعداد اتم های كربن و اكسيژن در ترکیب مساوی و هر كدام برابر با يك می باشد. به دلیل الكترونگاتيويته كمتر اتم كربن نسبت به اتم اكسيژن، کربن به عنوان اتم مرکزی در نظر گرفته می شود. توجه داشته باشید که اتم هيدروژن هیچ زمان نمی تواند به عنوان اتم مركزي انتخاب شود.
شمارش کل الکترون های ظرفیت
در قدم دوم تعداد الكترون های لايه والانس هر يك از اتم های موجود در تركيب مورد نظر مشخص می شود. توجه داشته باشید که بار مولکول در ترکیبات باردار نیز لحاظ شود. در این صورت اگر تركيب بار مثبت داشته باشد به تعداد بارهای مثبت، از كل الكترون های لايه والانس كم می شود .درحالیکه اگر تركيب دارای بار منفی باشد، به تعداد بارهای منفی به تعداد کل الكترون های لايه والانس اضافه می شود.
لازم به ذکر است که برای عناصر اصلی در جدول تناوبی، تعداد الکترون های ظرفیت برابر با شماره گروه عنصر مورد نظر می باشد. به عنوان مثال یون نیتریت را در نظر گرفته و تعداد کل الکترون های ظرفیتی محاسبه شده است.
NO۲– → ۵ + ۲(۶) + (+۱) =۱۸
تعیین تعداد الکترون های لازم برای آرایش هشتایی
در این مرحله، جفت الكترون های ناپیوندی را در اطراف هر يك از اتم های تركيب قرار می دهند تا همه اتم ها به آرايش هشتايی پايدار برسند. توجه داشته باشید که اتم هيدروژن با تشكيل پيوند كووالانسی ساده با سایر اتم ها به آرايش گاز هليم می رسد (برای هیدروژن دو الکترون در نظر گرفته می شود). بنابراین با در نظر گرفتن دو الکترون برای اتم های هیدروژن و هشت الکترون برای اتم های غیر هیدروژن، تعداد الکترون های لازم برای هشتایی شدن بدست می آید.
NO۲– → ۳(۸) =۲۴
تعیین تعداد الکترون های پیوندی
اگر تعداد کل الکترون های ظرفیت را منهای تعداد کل الکترون های لازم برای آرایش هشتایی شود تعداد الکترون های پیوندی بدست می آید. مثلا همان یون نیتریت را در نظر بگیرید.
تعیین تعداد الکترون های پیوندی : ۶ = ۱۸ – ۲۴
تعیین تعداد پیوند
اگر تعداد الکترون های پیوندی که در مرحله قبل بدست آمده است، تقسیم بر دو شود تعداد پیوند ها مشخص می شود. همانطور که مشخص است تعداد پیوندها در یون نیتریت برابر با سه (۳ = ۶/۲) می باشد.
تعیین تعداد الکترون های ناپیوندی
اگر تعداد کل الکترون های والانس منهای تعداد الکترون های پیوندی شود، تعداد الکترون های غیر پیوندی محاسبه می شود. این الکترون های ناپیوندی را به صورت نقطه در اطراف اتم های ترکیب قرار می دهند تا تمام اتم ها هشتایی شوند.
تعیین تعداد الکترون های ناپیوندی : ۱۲ = ۶ – ۱۸
رسم ساختار اولیه مولکول
ابتدا باید ساختاری ساده با پیوند های یگانه رسم کرد. برای رسم ساختار اولیه از راهنمایی مسئله، اطلاعات شخصی و یا حدس زدن کمک می گیرند. در ساختار اولیه، اتم مرکزی در مرکز قرار می گیرد و سایر اتم ها در اطراف آن نوشته می شوند. بین اتم مرکزی با اتم های اطراف يک خط تيره که نشان دهنده جفت الکترون اشتراکی است کشیده می شود. ساختار اولیه یون نیترات به شکل زیر می باشد.
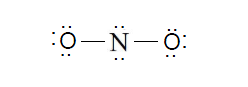
نکته
قبل از اینکه سراغ مرحله بعد برویم، به مقایسه تعداد الکترون های باقی مانده و تعداد الکترون های لازم در ترکیب پرداخته می شود. در این قسمت سه حالت ممکن ایجاد می شود :
۱- تعداد الکترون های باقی مانده برابر با تعداد الکترون های لازم باشد. در این حالت با قرار دادن تعداد جفت الکترون های نا پیوندی در ترکیب، ساختار تکمیل می شود.
۲- تعداد الکترون های باقی مانده کمتر از تعداد الکترون های لازم باشد. در این حالت ابتدا به اندازه نصف الکترون های (باقی مانده – لازم) پیوند پای در مولکول قرار داده می شود و بعد از آن، اتم ها به قاعده هشتایی می رسند.
۳- تعداد الکترون های باقی مانده بیشتر از تعداد الکترون های لازم باشد. در این حالت ابتدا تمام اتم های ترکیب به قاعده هشتایی رسیده و سپس به اندازه نصف الکترون های (باقی مانده – لازم) پیوند پای در مولکول قرار داده می شود.
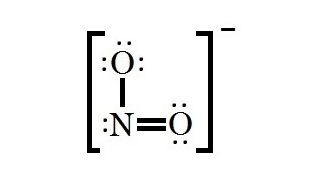
با توجه به الکترون های یون نیتریت مشخص می شود که تعداد الکترون های باقی مانده بیشتر از تعداد الکترون های لازم است. با محاسبه مشخص می شود که اختلاف آنها برابر با دو می باشد، بنابراین یک پیوند پای در ساختار قرار داده و بعد از آن تمام اتم ها را به هشتایی می رسند. بنابراین ساختار نهایی لوویس یون نیتریت به شکل زیر است.
تعیین بار قراردادی
براي محاسبه بار قراردادی هر اتم در يك ترکیب می توان از معادله زير استفاده نمود :
بار قراردادی اتم = تعداد الكترون هاي لايه ظرفيت اتم در حالت آزاد – (تعداد الكترون هاي غير مشترك + نصف تعداد الكترون های مشترك).
به عنوان نمونه با استفاده از فرمول، بار قراردادی اتم های یون نیتیریت را در نظر بگیرید.
بار قراردادی اتم نیتروژن : ۰ = ( (۶)۱/۲ + ۲) – ۵
بار قراردادی اتم اکسیژن سمت بالا : ۱- = ( (۲)۱/۲ + ۶) – ۶
بار قراردادی اتم اکسیژن سمت راست : ۰ = ( (۴)۱/۲ + ۴) – ۶
بنابراین ساختار نهایی لوویس یون نیتریت به شکل زیر است. هر دو ساختار، ساختار لوويس یون نیتریت را نشان می دهند. تنها تفاوت دو ساختار در محل قرار گرفتن پیوند دوگانه می باشد. اما در واقع احتمال دو ساختار با يكديگر برابر می باشد و قابل تبدیل به یکدیگر می باشند. لازم به ذکر است که هیچ کدام از دو ساختار (ساختار هاي رزونانسی) شكل واقعي یون نیتریت را ارائه نمی دهند. در نتیجه حالت واقعی به صورت يك هيبريد رزونانس می باشد كه ميانگين دو شكل رزونانسی است.
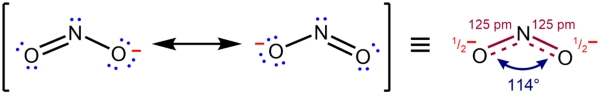
توجه داشته باشید که جمع ریاضی بارهای قراردادی اتم ها در يك تركيب خنثي برابر با صفر و در يك يون برابر با بار آن یون می باشد. لازم به ذکر است که توزيع بار قراردادی مثبت و منفی با الكترونگاتيويته اتم ها باید هماهنگ باشد. در نتیجه بار قراردادی مثبت به اتم با الكترونگاتيويته كمتر و بار قراردادی منفی به اتم با الكترونگاتيویته بيشتر نسبت داده می شود.
نکاتی برای رسم ساختار لوویس
در هنگام رسم ساختار لوویس ترکیبی که در آن بار قراردادی وجود ندارد انتخاب می شود. از طرفی ساختار لوويسی كه بارهای قراردادی كوچكتری دارد نسبت به ساختاری که بارهای قراردادی آن بزرگ است مناسب تر می باشد. همچنین اتم هايی كه با یکدیگر پيوند دارند (دو اتم مجاور هم) نبايد بار قراردادی همنام داشته باشند.
لازم به ذکر است که تعداد الكترون های پيوندی و نا پيوندی موجود در ساختار لوويس رسم شده بايد با تعداد الكترون های ظرفيت محاسبه شده در مراحل قبل برابر باشد. علاوه بر آن اتم های هیدروژن و فلوئور فقط با یک اتم پیوند می دهند و در بخش انتهایی (یا بیرونی) ترکیب قرار می گیرند.
سایر هالوژن ها یعنی کلر، برم و ید نیز با برقراری تنها یک پیوند در بخش انتهایی ترکیب قرار می گیرند. اما اگر این اتم ها نقش اتم مرکزی را داشته باشند، بنابراین بیش از یک پیوند تشکیل خواهند داد. یون های –H–، F–، Cl– و +H همیشه پیوند داتیو می دهند. در مورد ترکیبات باردار، کل ساختار رسم شده درون کروشه قرار گرفته و بار آن ترکیب در گوشه بالا و سمت راست کروشه نوشته می شود.
مثال
ساختار لوویس ترکیب COCl۲ را رسم کنید.
با توجه به قواعد گفته شده در انتخاب اتم مرکزی، در این ترکیب اتم کربن به عنوان اتم مرکزی در نظر گرفته می شود.
تعداد الكترون هاي لايه والانس : ۲۴ =(۷)۲ + ۶ + ۴
تعیین تعداد الکترون های لازم برای آرایش هشتایی : ۳۲ = (۸)۴
تعیین تعداد الکترون های پیوندی: ۸ = ۲۴ – ۳۲
تعیین تعداد پیوند ها : ۴ = ۸/۲
تعیین تعداد الکترون های ناپیوندی : ۱۶ = ۸ – ۲۴
تعیین بار قراردادی :
بار قراردادی اتم کربن : ۰ = ( (۸)۱/۲ + ۰) – ۴
بار قراردادی اتم اکسیژن : ۰ = ( (۴)۱/۲ + ۴) – ۶
بار قراردادی اتم کلر سمت چپ : ۰ = ( (۲)۱/۲ + ۶) – ۷
بار قراردادی اتم کلر سمت بالا : ۰ = ( (۲)۱/۲ + ۶) – ۷
بر طبق محاسبات انجام شده، ساختار لوویس مولکول COCl۲ به شکل زیر می باشد.
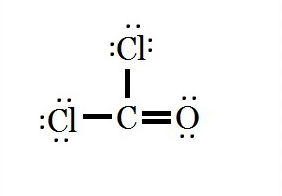
راه حل سریع رسم ساختار لوویس
لوویس یک راه ساده برای نشان دادن پیوند بین اتم ها در یک مولکول از طریق نمودارهای نقطه الکترونی لوئیس معرفی کرد. ایجاد نمودارهای لوئیس نسبتاً ساده است و فقط به چند مرحله و مقداری محاسبه الکترون های ظرفیت روی هر اتم نیاز دارد. الکترون های ظرفیت به صورت نقطه نشان داده می شوند. هنگامی که دو الکترون جفت می شوند (جفت تک)، آنها با دو نقطه مجاور که روی یک اتم قرار دارند نشان داده می شوند و وقتی دو الکترون جفت شده بین اتم ها (پیوندها) به اشتراک گذاشته می شوند، به صورت خطوط نشان داده می شوند.
اکنون اپلیکشن هایی وجود دارد که می توانید یک عنصر یا فرمول شیمیایی را برای محاسبه و ترسیم ساختار نقطه لوئیس وارد آن کنید. مطمئن شوید که از حروف بزرگ مناسب برای همه نمادهای عناصر استفاده کنید. برای ساختار لوئیس تک تک عناصر، از ماشین حساب الکترون ظرفیت استفاده کنید. ماشین حساب ساختار لوئیس را برای ایزومرهای شناخته شده به همراه پیوندها، بار یونی، بار رسمی، اعداد اکسیداسیون و الکترون های ظرفیت برای هر اتم تولید می کند.
ما از نمادهای لوئیس برای توصیف پیکربندی الکترون های ظرفیت اتم ها و یون های تک اتمی استفاده می کنیم. ما همچنین از نمادهای لوئیس برای نشان دادن تشکیل پیوند کووالانسی استفاده می کنیم، نقشه هایی که پیوند در مولکول ها و یونهای چند اتمی را توصیف می کنند. به عنوان مثال، هنگامی که دو اتم کلر یک مولکول کلر را تشکیل می دهند، آنها یک جفت الکترون را به اشتراک می گذارند.
تعداد پیوندی که یک اتم می تواند تشکیل دهد اغلب از تعداد الکترون های مورد نیاز برای رسیدن به یک اکتت (هشت الکترون Valence) پیش بینی می شود. این امر به ویژه در مورد غیر متال های دوره دوم جدول تناوبی (C ، N ، O و F) صادق است. به عنوان مثال، هر اتم یک عنصر گروه ۱۴ دارای چهار الکترون در بیرونی ترین پوسته خود است و بنابراین برای رسیدن به یک اکتت به چهار الکترون دیگر نیاز دارد. این چهار الکترون را می توان با تشکیل چهار پیوند کووالانسی به دست آورد.



















