گرافیت و الماس – شباهت ها و تفاوت های گرافیت و الماس

یکی از آلوتروپ های کربن که از لایه هایی از اتم های کربن که به راحتی می توانند روی هم بلغزند، تشکیل شده است،

گرافیت نام دارد. اما الماس دارای ساختار مکعبی شکننده است. گرافیت عنصری بسیار فراوان است اما الماس گرانترین سنگ و بسیار کمیاب است. این مقاله نشریه جهان شیمی فیزیک به بیان شباهت ها و تفاوت های این دو ماده می پردازد.
تفاوت های خواص گرافیت و الماس
شناخت این ماده به هزاران سال پیش برمی گردد ولی نمی توان گفت از چه سالی بشر از آن استفاده کرده است. در مورد کشف اولین الماس، در هند بوده و بشر از اهمیت این سنگ گرانبها بی اطلاع بود.
الماس سخت، شکننده، شفاف، نارسانای الکتریسیته و رسانای گرماست. اما گرافیت نرم، سیاه رنگ، نارسانای گرما و رسانای الکتریسیته است. این رسانایی به دلیل وجود الکترون بین لایه هاست. درجه سختی گرافیت در مقیاس موس ۱ تا۲ و درجه سختی الماس ۱۰ است.
گرافیت ضد زنگ و مقاوم در برابر حرارت است. دارای اصطکاک کم و مقاومت فشاری بالاست. در دما و فشارهای خیلی بالا به الماس تبدیل می شود. تفاوت اصلی در ساختار آن هاست که در زیر توضیح داده می شود.
ساختار الماس و گرافیت
مهمترین و جالب ترین آلوتروپی را می توان به الماس و گرافیت، دو شکل مختلف کربن در دنیا نسبت داد. هر دو از کربن ساخته شده اند ولی گرافیت نرم و سیاه و الماس سخت و شفاف است. علت اصلی این تفاوت، اختلاف در ساختار و چگونگی اتصال و پیوندهای بین آن هاست.
ساختار گرافیت
اتم های کربن در ساختار مسطح و با زوایای ۱۲۰ درجه ساتیگراد قرار گرفتند. نوع هیبریداسیون آن ها SP۲ بوده و واحدهای شش گوشه ای شبیه یک لانه زنبور عسل دارند که در هر لایه قرار گرفتند. این لایه ها و صفحات روی هم این ماده را تشکیل می دهند. پیوند بین اتم های کربن در هر ساختار شش گوشه ای کووالانسی است. اما اتصال بین صفحات، ضعیف تر از پیوند کووالانسی و پیوند وان دروالسی است و تک الکترونی که در اوربیتال Pz است بین این صفحات حرکت می کند. پس استحکام گرافیت در جهت صفحات لانه زنبوری (دارای پیوند کووالانسی) بالا بوده اما در جهت عمود بر این صفحات (دارای نیروی وان دروالسی) ضعیف بوده و این صفحات به راحتی با اعمال نیرو روی هم حرکت می کنند.
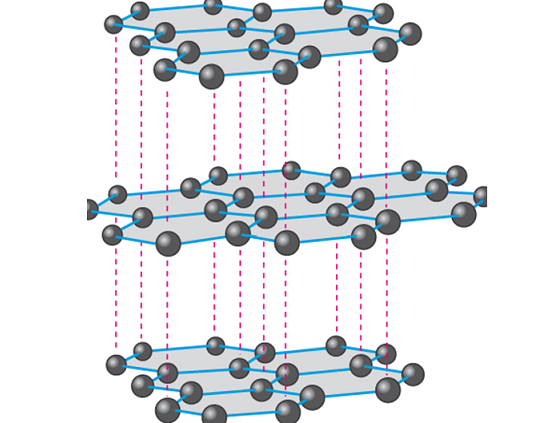
ساختار الماس
اتم های کربن در الماس در ساختار چهاروجهی منتظم با زوایای پیوندی ۱۰۹ درجه سانتیگراد قرار گرفته و دارای هیبریداسیون SP۳ هستند. این چهاروجهی ها در ساختار شبکه ای سه بعدی غول آسا قرار گرفته اند که در بعضی از اتم ها باهم مشترک هستند. پیوند در ساختار الماس کووالانسی با یون الکترون آزاد است.
نکته :
در ساختار گرافیت هر اتم کربن پیوند کووالانسی با سه اتم دیگر دارد، اما در ساختار الماس هر اتم کربن با چهار اتم کربن دیگر پیوند کووالانسی دارد.
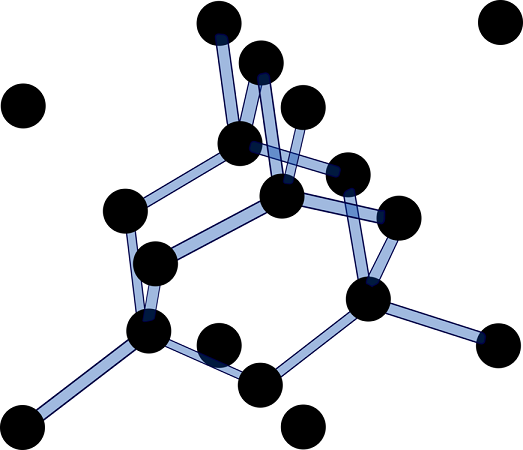
گرافیت
گرافیت از کلمه گرافین به معنای نوشتن (رد سیاه مداد روی کاغذ) گرفته شده است. نماد شیمیایی آن C است و به رنگ خاکستری تیره تا سیاه مات است. این ماده غیرسمی در شرایط جوی پایدار و ماندگار است. گرافیت چگالی ویژه کمی داشته و در مقابل گرما مقاوم است. الماس و گرافیت از کربن باقیمانده از بقایای موجودات زنده به دست می آیند.
تهیه و تولید گرافیت
عمده گرافیت از دگرگونی رسوبات کربن دار در مجاورت دما و فشار تولید می شود. در این روش تولید که از مواد ارگانیک و سنگ آهک به دست می آید، محصول، گرافیت ورقه ای خواهد بود. از نوع ورقه ای گرافیت در صنایع متالوژی، رنگ، ساخت لنت، مداد و… استفاده می شود. اما گرافیت بی شکل (آمورف)، از دگرگونی رگه های زغال سنگ به دست می آید. گرمای حاصل از دگرگونی باعث تبخیر اکسیژن و هیدروژن و.. موجود در زغال سنگ شده و مواد ارگانیک آن را از بین برده و کربن خالص (به شکل گرافیت بی شکل) باقی می ماند.
اما نوع مصنوعی را با گرما دادن کک نفتی تا دمای ۲۵۰۰ تا ۳۰۰۰ درجه سانتیگراد می سازند. گرافیت حاصل با درجه خلوص ۹۹% کربن به صفحه بلوری می چسبد.
تشکیل الماس
در ۱۶۰ کیلومتری زیر پوسته زمین اندازه فشار و حرارت به حدی است که فرآیند تبدیل الماس انجام می شود (دما ۴۰۰درجه سانتیگراد و فشار ۳۰۰۰۰ اتمسفر). الماس های تشکیل شده با جریان های قوی گدازه ای به سطح زمین آمده و مجراهای کیمبرلیت (مکانی در آفریقا) را به وجود می آورند. داخل این مجراها که در فاصله یک میلیارد تا ۲۰ میلیون سال پیش اتفاق افتاده با سرد شدن، رگه های مخروطی که دارای الماس هستند تشکیل می شود.
تهیه الماس در آزمایشگاه :
در آزمایشگاه از دو طریق الماس تهیه می شود. یک روش در دما و فشار بالا با تقلید از روش طبیعی است. اما روش دیگر برعکس روش اول اتم های کربن آزاد گذاشته می شود تا به یکدیگر متصل شده و به ساختار الماس تبدیل شوند. این روش به رسوب گیری بخار شیمیایی (CVD) معروف است و با قرار دادن تکه الماس کوچک در خلأ و وارد کردن هیدروژن و متان به آن انجام می شود. در این فرآیند رادیکال متیل تولید شده با چسبیدن به ذره الماس، الماس بزرگتر ایجاد می کند. هر دوی این روش ها الماس هایی با کیفیت و با سرعت بالا تولید می کنند اما روش CVD چون محصول زیادی تولید می کند بسیار مورد توجه است.
علت سختی الماس
همان طور که گفته شد در ساختار الماس چهار اتم کربن با پیوندهای قوی کووالانسی، یک مولکول بسیار قوی متشکل از ۵ اتم و ساختار چهار وجهی تشکیل می دهند. همین ساختار شبکه ای قوی، الماس را بسیار سخت کرده است.
علت درخشندگی الماس
الماس ساختار بسیار فشرده ای دارد و از این جهت اولین ماده در جهان است. سرعت نور داخل الماس با ضریب شکست ۲̸۱۲ نصف سرعت معمولی آن است. ساختار فشرده الماس و تشکیل زوایه روی سطح الماس باعث می شود پرتو نور هنگام عبور از آن، چندین بازتاب داشته باشد. همین دلایل باعث درخشندگی الماس است.

کاربردهای الماس و گرافیت
از گرافیت به دلیل خاصیت رسانایی بالا در تولید باتری های پیشرفته، صنایع الکتریکی و الکترودهای کوره استفاده می شود.

ساختار ورقه ای گرافیت باعث استفاده از آن در صنعت رنگ سازی شده است. این ساختار با گستردگی زیاد در سطوح و چسبندگیش به فلزات، روی سطح را می پوشاند و همچنین در مقابل آب نفوذناپذیر است. از گرافیت به عنوان روان کننده و جلوگیری از اصطکاک در دستگاه های صنعتی البته در ترکیب با روغن استفاده می شود. به صورت ترکیب با خاک رس در ساخت مداد، که با هم خاصیتی را پدید می آورند که می تواند روی کاغذ اثر بگذارد، استفاده می کنند.
گرافیت به عنوان ماده ای نسوز در ساخت بوته آهنگری و به عنوان آند در ساخت الکترودها در باتری کاربرد دارد.
از الماس در ساخت ترن های سریع السیر و رادارهای پرقدرت استفاده می شود. به عنوان آشکار ساز در پرتو سنج های پزشکی و ساخت ساعت های نانو کاربرد دارد.
قیمت گرافیت
گرافیت یک کانی غیر فلزی، یکی از دو شکل طبیعی کربن (دیگر الماس) است. گرافیت با بالاترین استحکام و سختی طبیعی نسبت به هر ماده، رسانای عالی گرما و الکتریسیته است. در طیف وسیعی از دماها پایدار است. گرافیت یک ماده بسیار نسوز با نقطه ذوب بالا (۳۶۵۰ درجه سانتیگراد) است. گرافیت روانکاری طبیعی بالایی دارد و یکی از سبک ترین مواد تقویت کننده است. گرافیت در حالی که از نظر شیمیایی بی اثر است، مقاومت بالایی در برابر خوردگی دارد.
گرافیت، به طور خاص، گرافیت کروی پوشش داده شده – یا “CSPG” – برای تولید آند در باتری لیتیوم یون (Li-ion) استفاده می شود. تولیدکنندگان عمده گرافیت طبیعی عبارتند از: چین (۷۰%)، کره شمالی (۱۰%) و برزیل (۸%). گرافیت پولکی با کیفیت بالا احتمالاً در سال های آینده شاهد افزایش تقاضا خواهد بود. گرافیت یک ماده معدنی استراتژیک حیاتی است (ایالات متحده گرافیت را یک ماده معدنی حیاتی برای عرضه اعلام کرده است؛ اتحادیه اروپا گرافیت را یک ماده خام حیاتی اعلام کرده است).
اگرچه حدود ۲۰۰ کاربرد گرافیت وجود دارد، باتریهای لیتیوم یونی هستند که بیشترین تقاضا را در آینده دارند (گرافیت برای تولید آند در باتریهای لیتیوم یون استفاده میشود). هر خودروی الکتریکی حاوی بیش از ۲۰۰ پوند گرافیت کروی پوشش داده شده (CSPG) است. برای ساخت باتری لیتیوم یونی ۱۰ تا ۳۰ برابر گرافیت بیشتر از لیتیوم نیاز است – حداقل خلوص گرافیت مورد نیاز ۹۹.۹۵٪ Cg است. تقاضای آتی گرافیت عمدتاً ناشی از گسترش بازارهای باتری لیتیوم یونی (بازارهای حمل و نقل و باتری ثابت) است.
ویژگی های منحصر به فرد گرافیت آن را به ماده آند ایده آل برای باتری های لیتیوم یون تبدیل می کند. با این حال، مشتریان به گرافیت CSPG نیاز دارند – نه گرافیت معمولی. چین که حدود ۷۵ درصد از تولید جهانی گرافیت را کنترل می کند، سیاست ملی کردن منابع از جمله عوارض صادراتی، مجوزها و محدودیت های زیست محیطی را بر معادن جدید و موجود اعمال کرده است.
دو نوع گرافیت CSPG مورد استفاده در باتریهای لیتیوم یونی وجود دارد مصنوعی و طبیعی. قیمت گرافیک طبیعی بالاتر از مصنوعی است. به دلیل هزینه و کارایی، بسیاری از تولیدکنندگان باتری در حال گذار به گرافیت طبیعی هستند.



















