
یکی از نتایج مهم مکانیک کوانتوم اصل عدم قطعیت هایزنبرگ (Heisenberg Uncertainty Principle) می باشد. در این اصل بیان می شود که جفت هایی از ویژگی های فیزیکی یک سیستم وجود دارند که مقدار دقیق آنها را به طور همزمان نمی توان محاسبه کرد. مشهورترین این جفت ها عبارتند از اندازه حرکت و موقعیت. اصل عدم قطعیت هایزنبرگ در واقع به مفهومی اشاره میکند که مکانیک کلاسیک قادر به توجیه آن نمی باشد. بنابراین دلیل اینکه چرا یک فیزیکدان نمی تواند کمیت های مرتبط با یک الکترون را به طور دقیق اندازهگیری کند به این اصل بر می گردد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی اصل عدم قطعیت هایزنبرگ پرداخته می شود. لطفا با ما در ادامه مقاله همراه باشید.
فهرست مطالب این مقاله
۱- معرفی اصل عدم قطعیت
۲- مفهوم عدم قطعیت هایزنبرگ
۳- بیان ریاضی اصل عدم قطعیت هایزنبرگ
۱-۳- اصل عدم قطعیت هایزنبرگ به شرط ثابت بودن جرم جسم
۲-۳- رابطه عدم قطعیت هایزنبرگ در مورد انرژی و زمان
معرفی اصل عدم قطعیت
در فیزیک کلاسیک، با داشتن اطلاعات از شرایط اولیه یک سیستم و نیروهایی که بر آن وارد می شوند می توان رفتار بعدی این سیستم فیزیکی را به طور دقیق مشخص کرد. در واقع اگر مکان اولیه، سرعت اولیه و تمام نیروهای وارد بر ذره مشخص باشند، با کمک گرفتن از قانون دوم نیوتن، می توان مکان و سرعت را در لحظه ای بعد تعیین کرد. در حقیقت فیزیک کلاسیک کاملا قابل تعیین می باشد.
در فیزیک کوانتوم، به دلیل خواص دوگانگی موج- ذره، یک ذره به وسیله یک تابع موج متناظر با موج ذره نمایش داده می شود. در واقع تمام پدیده های کوانتومی با موج ها توصیف می شوند. بنابراین یک ذره میکروسکوپی تا حدی در فضا گسترده می باشد و برخلاف ذرات ماکروسکوپی کلاسیکی نمی توانند در فضا جای مشخصی داشته باشند. در حقیقت مفاهیم فیزیک کلاسیک از جمله مکان دقیق، اندازه حرکت دقیق و مسیر یکتای ذره در مقیاس میکروسکوپی و فیزیک کوانتومی معنایی ندارند.
اصل عدم قطعیت از تفاوت موج و ذره بوجود می آید. همانطور که می دانید، مکان یک ذره مشخص و معین می باشد، در حالیکه موج، یک پدیده پخش شده در فضا است. بنابراین محدوده ای از مکان ها را در بر می گیرد ودر نتیجه نمیتوان یک مکان مشخص را به موقعیت آن نسبت داد. از طرفی، اندازه حرکت یک موج، دقیق و معلوم است، در حالیکه اندازه حرکت یک ذره نا معین بوده و محدوده ای از مقادیر را دارد. بنابراین یک ذره نمی تواند به طور کامل فقط موج یا ذره باشد، بلکه در حقیقت مخلوطی از این دو می باشد. در نتیجه اصل عدم قطعیت پدیدار می شود.
مفهوم عدم قطعیت هایزنبرگ
اصل عدم قطعیت هایزنبرگ می گوید، درست است که اندازه گیری اندازه حرکت یا مکان ذره به طور دقیق امکان پذیر است، اما اندازه گیری این دو خاصیت فیزیکی به طور همزمان و با دقت دلخواه امکان پذیر نمی باشد. در واقع هر چه یکی از دو کمیت ذکر شده دقیق تر اندازه گیری شود، کمیت دوم نا معین تر خواهد بود. ذکر این نکته خالی از لطف نیست که این عدم قطعیت به روش اندازه گیری موقعیت و سرعت ذره بستگی ندارد و در حقیقت مستقل از نوع ذره می باشد. در واقع اصل عدم قطعیت یک خاصیت بنیادی و گریز ناپذیر جهان می باشد.
در حقیقت این اصل دلیل اینکه چرا یک فیزیکدان یا شیمیدان نمی تواند به طور دقیق و مشخص، خواص مرتبط با یک الکترون را اندازهگیری کند را بیان میکند. تا قبل از فیزیک کوانتومی، اینگونه تصور می شد که همه ویژگی ها و خواص یک جسم در لحظه را می توان با دقت قابل قبولی و معینی اندازه گیری کرد.
مثال
در ادامه یک مثال به منظور درک بهتر اصل عدم قطعیت هایزنبرگ ذکر شده است. فرض کنید با یک تفنگ الکترونی الکترون ها را از درون یک شکاف کوچک شلیک نماییم. یک صفحه آشکارساز در پشت شکاف و در فاصله معینی از آن وجود دارد. این صفحه آشکارساز مکان الکترون های شلیک شده را مشخص می کند. اگر تابع موج الکترون را بدانید، می توانید احتمال برخورد الکترون در یک مکان خاص بر روی صفحه آشکارساز را محاسبه کنید.
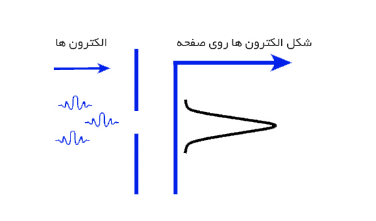
در مرحله بعدی، شکاف را کوچک و کوچک تر کنید. پیش بینی می شود که در اثر این کوچکتر شدن شکاف ورودی، الکترون ها قسمت باریک تری از صفحه آشکار سازی را اشغال کنند. در ابتدا بر طبق انتظار، الکترون ها بخش باریکی از صفحه آشکارساز را اشغال کرده اند. اما نکته قابل توجه اینجاست که با کوچکتر شدن شکاف از یک مقدار مشخص، نتیجه برعکس می شود، بنابراین الکترون ها شروع به پخش شدن می کنند.
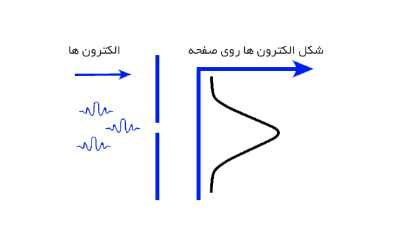
در این مرحله اصل عدم قطعیت وارد می شود. در واقع اگر شکاف باریک و باریک تر شود، عدم قطعیت در مورد مکان و موقعیت الکترون ها بر روی صفحه آشکار ساز، کاهش یافته، درحالیکه عدم قطعیت اندازه حرکت آنها افزایش پیدا کرده است. بنابراین الکترون ها محدوده بزرگتری از صفحه ی آشکار ساز را اشغال کرده و به اصطلاح پخش می شوند.
بیان ریاضی اصل عدم قطعیت هایزنبرگ
معادله زیر بیان ریاضی اصل عدم قطعیت هایزنبرگ می باشد. با توجه به معادله مشخص می شود كه نمی توان موقعیت و اندازه حركت ذرات را به طور همزمان و به صورت دقیق و بدون خطا تعیین كرد (مقادیر و
در نامساوی صدق نمی کند).
در معادله بالا، h ثابت پلانک، عدم قطعیت در موقعیت و
عدم قطعیت در تکانه می باشد. همچنین مکان (x) مربوط به خاصیت ذره بودن و اندازه حرکت (p) مربوط به خاصیت موجی بودن می باشد. با توجه به نا مساوی مشخص می شود که كاهش عدم قطعیت در اندازه گیری یكی از این دو كمیت، به طور حتم همراه با افزایش عدم قطعیت در تعیین كمیت دیگر خواهد بود. به بیان دیگر هرچه اندازه گیری در موقعیت و مکان یک ذره دقیق تر باشد، دقت اندازهگیری در تکانه یا مومنتوم آن ذره کمتر خواهد بود.
اگر در رابطه ذکر شده ћ را جایگزین ثابت پلانک کنیم، معادله عدم قطعیت به صورت زیر ساده می شود:
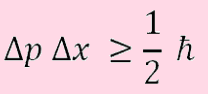
اصل عدم قطعیت هایزنبرگ به شرط ثابت بودن جرم جسم
فرض کنید جرم جسم ثابت باشد، بنابراین بیان ریاضی معادله به فرم زیر تبدیل می شود:
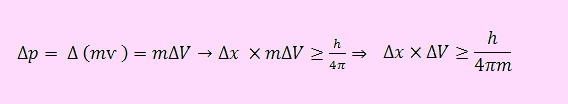
لازم به ذکر است که با توجه به معادله بالا و با افزایش جرم ذرات، حاصلضرب عدم قطعیت ها و در نتیجه خود عدم قطعیت ها کاهش پیدا می کند. شکل زیر این مطلب را به خوبی نشان می دهد. در واقع هرچه جرم ذره بیشتر باشد (m۲ > m۱)، محدوده مجاز عدم قطعیت به مبدا مختصات نزدیکتر و در نتیجه عدم قطعیت کمتر است.
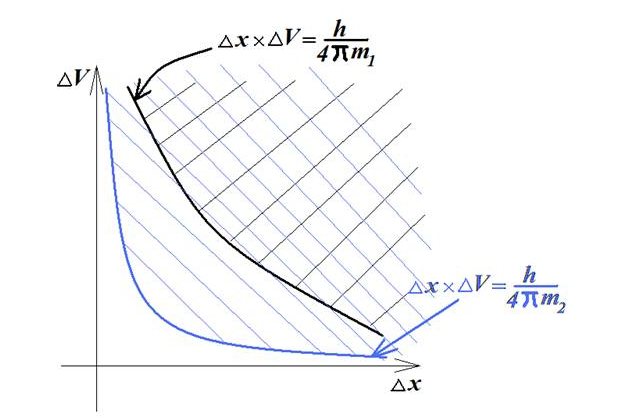
بطور کلی می توان نتیجه گیری کرد که در اجسام معمولی به دلیل جرم قابل قبول، عدم قطعیت پایین بوده، بنابراین تعیین دقیق و همزمان موقعیت و سرعت امكان پذیر می باشد. اما در ذرات ریز اتمی به دلیل جرم ناچیز ذرات، عدم قطعیت قابل توجه و زیاد می باشد، بنابراین تعیین دقیق و همزمان موقعیت و سرعت ذرات امكان پذیر نمی باشد. در این صورت می توان از اصل عدم قطعیت هایزنبرگ برای اجسام معمولی صرف نظر کرد.
رابطه عدم قطعیت هایزنبرگ در مورد انرژی و زمان
بر طبق کوانتوم و کمیت های کوانتیده، انرژی به صورت کوانتا های انرژی با مقدار hv می باشد. اگر رابطه انرژی (E = hv) را در رابطه عدم قطعیت در فرکانس و زمان قرار دهیم خواهیم داشت:
که در آن h ثابت پلانک، عدم قطعیت در انرژی و
عدم قطعیت در زمان می باشد. با توجه به معادله مشخص می شود که اگر به عنوان مثال
افزایش یابد،
کاهش می یابد.



















