عدد کوانتومی چیست؟ انواع عددهای کوانتومی الکترون ها
با توجه به مدل اتمی بور و نظریه اتمی شرودینگر فرض شد الکترون ها در مدارهایی که از نظر انرژی کوانتیده است،

در حال حرکت هستند. با بررسی ساختار طیف عناصر مختلف مشخص شد که انرژی هر الکترون به وسیله اعدادی که به عدد کوانتومی معروف هستند بیان می شود. در واقع موقعیت یک الکترون با چهار عدد کوانتومی توصیف می شود. این مقاله نشریه جهان شیمی فیزیک به توصیف این اعداد می پردازیم.
عدد کوانتومی اصلی (n)
عدد کوانتومی اصلی n همان عددی است که بور برای ترازهای انرژی خود استفاده کرده و به جای تراز در مدل کوانتومی، لایه استفاده می شود. n عددی صحیح و مثبت است که در این لایه های الکترونی، الکترون ها دور هسته می چرخند. انرژی پیوند الکترون در اتم های یک الکترونی با استفاده از رابطه ای که از حل معادله شرودینگر به دست می آید، حاصل می شود.
n نشان دهنده هر لایه ای است که الکترون ها در آن حضور دارند. هر چقدر عدد n بزرگتر باشد، الکترون ها در فاصله دورتری از هسته قرار دارند. اندازه اوربیتال نیز در این حالت بزرگتر خواهد بود.
اطراف هسته اتم ۷ لایه الکترونی اصلی وجود دارد که n = 1 پایدارترین لایه الکترونی است.
عدد کوانتومی فرعی (L)
با استفاده از طیف سنج های دقیق تر معلوم شد که هر کدام از خطوط طیفی مشاهده شده، خود از خطوط طیفی نزدیک به همی تشکیل شدند. زومرفلد کسی بود که از این مشاهده به این نتیجه رسید که هر کدام از ترازهای اصلی خود متشکل از ترازهای فرعی می باشد. طبق گفته بور الکترون ها در مسیر بیضی شکلی به دور هسته می چرخند. در این مدارها سرعت الکترون ثابت نیست، پس عدد کوانتایی دومی به نام عدد کوانتومی فرعی تعریف شد.
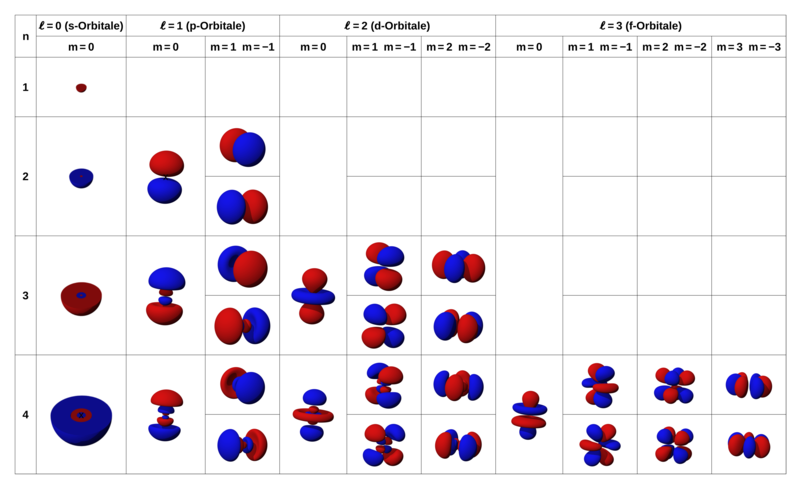
تعداد لایه های فرعی برابر با مقدار n در لایه اصلی است. مثلا پوسته n = 1 یک پوسته فرعی و n = 2 دو لایه فرعی دارد. تعداد زیر لایه ها با عدد کوانتومی L نشان داده می شوند. مقدار L برای هر پوسته اصلی n به ترتیب زیر حساب می شود.
L = 0, 1, 2, 3, . . ., (n – ۱)
به عنوان مثال :
برای n = 1 که L = 1 می باشد و فقط یک لایه فرعی دارد و مقدار L صفر است. نمادی که برای این زیرلایه استفاده می شود S است. یعنی فقط یک اوربیتال کروی S دارد. برای لایه اصلی دوم (n = 2) دوتا زیرلایه دارد که مقدار L آن ۰ و ۱ خواهد بود که با اوربیتال های S و P نمایش داده می شود. این نمادها اول خصوصیات خط طیفی است که هر کدام با آن نشان داده می شوند. با افزایش زیر لایه ها این نشانه ها به ترتیب با d, f, g, h نمایش داده می شود.
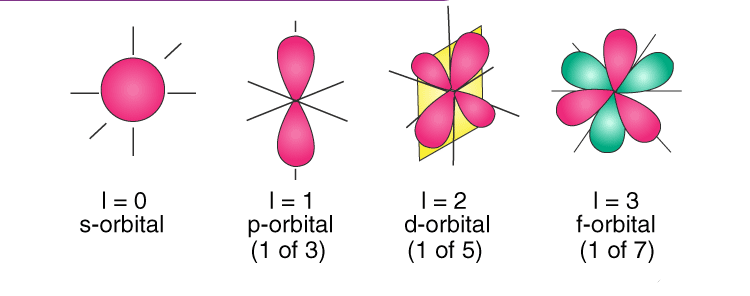
هر قدر مقدار L بزرگتر باشد، احتمال حضور الکترون در فاصله بیشتری از هسته است و این امر به دلیل شکل تابع موجی اتم است. در توضیح دقیق تر عدد کوانتومی فرعی، شکل اوربیتال را نشان می دهد.اوربیتال S به شکل کروی، اوربیتال P دمبلی شکل و اوربیتال d به ۵ شکل مختلف وجود دارد.
عدد کوانتومی مغناطیسی (ml)
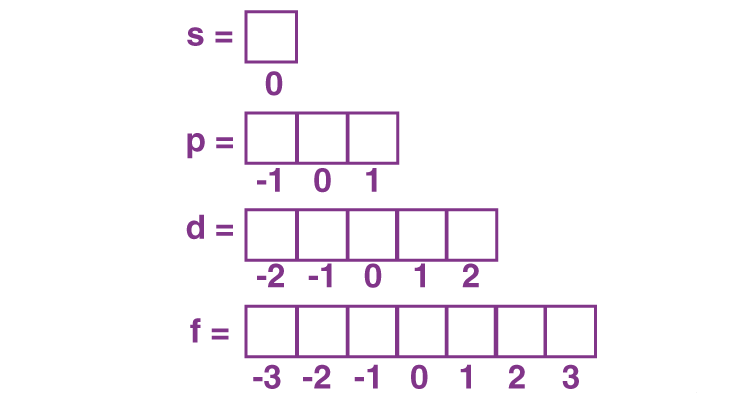
حرکت الکترون به عنوان یک ذره بار دار در اطراف خود تولید یک میدان مغناطیسی می کند. وقتی الکترون در مقابل یک میدان مغناطیسی دیگر (میدان تولید شده از حرکت الکترون به دور هسته) قرار می گیرد، جهت گیری خاصی پیدا می کند. ml نشان دهنده جهت میدان مغناطیسی الکترون خواهد بود. ml عددهای بین –L و +L و صفر را خواهد داشت که مقدار آن با فرمول (۲L + 1) تعیین می شود.
-L, (-L + 1), (-L + 2), . . .,0, 1, 2, . . ., (L – ۲), (L- 1), L
اوربیتال S چون کروی است، در صورت حضور در میدان مغناطیسی، در تمام جهات به طور یکسان تحت تاثیر خطوط نیرو قرار می گیرد و هیچ تغییری نمی کند.
اما اوربیتال P دمبلی شکل در سه جهت مختلف قرار می گیرد. الکترون های اوربیتال های P در غیاب میدان مغناطیسی هیچ تفاوتی باهم ندارند. اما در حضور میدان مغناطیسی در مطالعات طیف سنجی که اتم ها برانگیخته هستند، حرکت الکترون جهت های مختلفی پیدا می کند (اثر زیمان). این الکترون های متاثر شده دارای سطوح انرژی متفاوتی هر چند به مقدار کم هستند.
از این رو اوربیتال S همان طورکه گفته شد جهت خاصی ندارد، اما اوربیتال P سه جهت، اوربیتال d پنج جهت و اوربیتال f هفت جهت در حضور میدان مغناطیسی پیدا می کنند.
اعداد کوانتومی مغناطیسی برای اوربیتال d به شکل زیر است :
-۲, -۱, ۰, +۱, +۲
عدد کوانتومی مغناطیسی اسپینی (mS)
همان طور که گفته شد چرخش الکترون به دور خود، تولید میدان مغناطیسی می کند که باعث می شود الکترون مثل یک آهن ربا عمل کند. چون این میدان تولید شده در مجاورت میدان مغناطیسی تولید شده از چرخش الکترون به دور هسته قرار دارد، می تواند هم جهت با آن و تقویت کننده و یا در خلاف جهت آن و تضعیف کننده میدان باشد. حرکت اسپینی الکترون می تواند ساعتگرد و یا پاد ساعتگرد باشد. همین خاصیت مغناطیسی الکترون باعث تعریف عدد کوانتومی مغناطیسی می شود که می تواند برای الکترون دو مقدار ½- و ½+ باشد. جهت چرخش ساعتگرد برای الکترون با فلش رو به بالا و جهت چرخش پاد ساعتگرد برای الکترون با فلش رو به پایین نشان داده می شود.
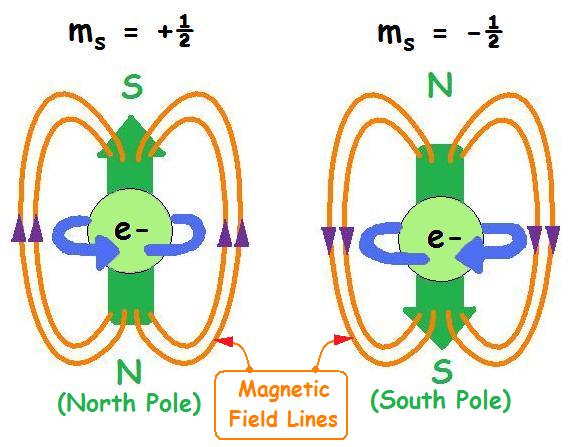
عدد کوانتومی مغناطیسی مستقل از سه اعداد کوانتومی گفته شده است، در صورتی که آن سه کاملا تحت تاثیرهم بودند. چون مقدار L تحت تاثیر n و مقدار مجاز m تحت تاثیر مقدارL است. به عنوان مثال برای n = 1 مقدار L با فرمول n – ۱ برابر صفر و فقط یک مقدار می تواند داشته باشد و ارزش mL با فرمول ۲L+1 برابر ۳ خواهد بود. اما mS همیشه همان ½+ و ½- است و به هیچ کدام از اعداد کوانتومی وابسته نیست.
در یک اوربیتال دو الکترون قرار می گیرند که عدد کوانتومی مغناطیسی آن ها از لحاظ عددی یکسان، ولی اسپین مخالف دارند. با این اسپین های مخالف اثر یکدیگر را خنثی کرده و خاصیت مغناطیسی از خود نشان نمی دهند.
نحوه محاسبه عدد کوانتومی
برای مشخص کردن مکان یک الکترون در یک اتم از دنباله ای از اعداد صحیح خاص به نام اعداد کوانتومی استفاده می کنیم. خواص اوربیتال های اتمی و الکترون های آن اوربیتال ها با اعداد کوانتومی توصیف می شوند. در مجموع چهار عدد کوانتومی وجود دارد که پیکربندی یک الکترون در یک اتم یا یون را مشخص میکند. آنها را به عنوان متغیرهای مهم در معادله ای که موقعیت سه بعدی الکترون ها را در یک اتم خاص توصیف می کند در نظر بگیرید.
الکترون ها ابتدا اوربیتال ها را به تنهایی اشغال می کنند و سپس جفت می شوند. در هر اوربیتال حداکثر دو الکترون می توانند جای بگیرند و جهت آنها مخالف یکدیگر خواهد بود. در اثر اسپین یک الکترون مانند یک آهنربای کوچک رفتار می کند. اگر در یک اتم تمام الکترون ها در اوربیتال ها جفت شوند، اسپین های آنها با مقادیر مخالف یکدیگر را خنثی می کنند و اتم دیامغناطیسی است.
اگر اسپینهای آنها را جمع کنیم، مجموع آنها صفر میشود و میدانهای مغناطیسی را دفع میکنند. اگر یک اتم دارای الکترونهای جفت نشده در اوربیتالها باشد، الکترون در اوربیتال دارای یک چرخش خالص و چرخش ها یکدیگر را خنثی نمی کنند. در نتیجه اتم یک اسپین خالص دارد و به یک میدان مغناطیسی جذب می شود. چنین اتم هایی پارامغناطیس نامیده می شوند.
الکترون ها ویژگی های خاصی مانند پیکربندی، اسپین و موقعیت در اتم دارند. این ویژگی ها با اعداد کوانتومی تعریف می شوند. اعداد کوانتومی چیست؟ مقادیر خاصی به هر الکترون در یک اتم اختصاص داده می شود. به این مقادیر اعداد کوانتومی می گویند. آنها آدرس دقیق یک الکترون در یک اتم را می دهند. طبق اصل طرد پائولی، هر الکترون در یک اتم دارای مجموعه منحصر به فردی از اعداد کوانتومی است، یعنی هیچ دو الکترونی ترکیبی از اعداد کوانتومی یکسانی ندارند. اعداد کوانتومی همه الکترون های یک اتم تابع موجی است که باید با معادله شرودینگر مطابقت داشته باشد.