اکسید بازی (اکسید فلز) چیست و چه ویژگی دارد؟
اکسید بازی اکسیدهایی هستند که خصوصیات بازی را در تقابل با اکسیدهای اسیدی نشان می دهند و در واکنش با آب یک باز تشکیل می دهند. این ترکیبات می توانند با یک اسید واکنش داده و نمک و آب تشکیل دهند که واکنش خنثی سازی نامیده می شود. مبحث اکسید بازی چیست شیمی دهم بطور کامل به این موارد می پردازد.
اکسید بازی یک کلمه ترکیبی از باز و اکسید است. واژه اکسید به ترکیبات شیمیایی اطلاق می شود که یک یا چند اتم اکسیژن با عنصر دیگری مانند H2O یا CO2 ترکیب می شوند. اکسیدهای اسیدی ، اکسیدهای بازی و اکسیدهای آمفوتریک و اکسیدهای خنثی را می توان بر اساس ویژگی های اسیدی و باز آنها طبقه بندی کرد. در مبحث تعریف اکسید بازی شیمی دهم انواع اکسیدها شرح داده شده است. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا همراه ما باشید.
واکنش پذیری اکسیدهای فلزی
اکسیدهای بازی که می توان آن را انیدریدهای بازی نیز نامید به معنی “باز بی آب” است که معمولاً در واکنش اکسیژن با فلزات ، به ویژه فلزات قلیایی (حالت اکسیداسیون ۱+) و فلزات قلیایی خاکی (حالت اکسیداسیون ۲+) ایجاد می شوند. هر دوی آنها اکسید یونی هستند. اکسید فلزی در آب حل شده و محلول های بازی هیدروکسید فلز را تشکیل می دهند ، در حالی که غیر فلزات معمولاً اکسیدهای اسیدی تشکیل می دهند.
به عنوان مثال اکسید بازی Li2O پس از واکنش با آب ، تبدیل به باز LiOH و BaO به Ba (OH) 2 تبدیل می شود. به طور کلی ، خاصیت بازی اکسیدهای عناصری که در سمت چپ جدول تناوبی قرار دارند (گروه ۱ و ۲) به سمت پایین افزایش می یابد زیرا خاصیت فلزی عناصر افزایش می یابد.
انواع اکسید بازی در جدول تناوبی
فلزات قلیایی (گروه ۱) X2O + H2O → ۲XOH
قلیایی (گروه ۲XO + H2O → X (OH) (۲
مثالها عبارتند از:
- سدیم اکسید که با آب واکنش می دهد و هیدروکسید سدیم تولید می کند
- اکسید منیزیم که با اسید کلریدریک واکنش داده و کلرید منیزیم را ایجاد می کند
- اکسید مس (II) ، که با اسید نیتریک واکنش داده و نیترات مس را تشکیل می دهد

روش تشکیل اکسیدهای بازی
نمونه هایی از اکسیدها (عناصر گروه ۱ با اکسیژن واکنش نشان می دهند):
لیتیوم با اکسیژن واکنش داده و اکسید Li2O می دهد
Li (s) + O2 (g) → ۲ Li2O (s)
سدیم با اکسیژن واکنش داده و پروکسید Na2O2 می دهد
Na (s) + O2 (g) → Na2O2 (s)
پتاسیم با اکسیژن واکنش داده و سوپراکسید KO2ایجاد می کند .
K(s) + O2(g) → KO2(s)
ویژگی های اکسید بازی
مولکول های حاوی گروه H-O-X می توانند به طور طبیعی به عنوان اسید رفتار کنند اما وقتی یون هیدروکسید تولید می شود ، می توانند به عنوان باز رفتار کنند. پیوند O-X دست نخورده باقی خواهد ماند و قطبی شده و پیوند ضعیف O-H تمایل به شکستن خواهد داشت ، هنگامی که گروه H-O-X در آب حل می شود یک پروتون آزاد می کند. اگر X دارای الکترونگاتیویته بسیار کمی باشد ، پیوند O-X تبدیل به یون وآب قطبی می شود.
به عنوان مثال ، هنگامی که NaOH و KOH که ترکیبات یونی هستند در آب حل می شوند ، محلول های بازی کاتیون فلز و یون هیدروکسید تولید می کنند. این اصول با تشخیص اینکه یون اکسید میل زیادی برای پروتون ها دارد ، می توانند رفتار باز را هنگامی که در آب حل می شوند ، توضیح دهند.
اکثر اکسیدهای بازی بر اساس اختلاف الکترونگاتیوی اکسیژن و فلزات ماهیت یونی دارند. محلول اکسید بازی در آب می تواند باعث افزایش pH (قلیایی شدن) آب شود زیرا اکسیدهای بازی یون های هیدروکسید (OH2) را در آب آزاد می کنند.

طبقه بندی اکسیدهای ساده
بر اساس رفتار شیمیایی ، اکسیدهای ساده به شکل اکسیدهای اسیدی ، بازی ، آمفوتریک و خنثی وجود دارند. در درس اکسید های اسیدی و بازی شیمی دهم این موارد شرح داده شده است.
۱- اکسید اسیدی
اکسید اسیدی با آب واکنش داده و اسید تولید می کند. اکسید های اسیدی معمولاً اکسید غیر فلزات هستند. به عنوان مثال می توان به SO2 ، CO2 ، SO3 ، Cl2O7 ، P2O5 و N2O5 اشاره کرد. همچنین می تواند اکسید فلزات با حالت اکسیداسیون بالا ، مانند CrO3 ، Mn2O7 و V2O5 باشد.اکسید نافلزی چیست
دی اکسید گوگرد با آب واکنش داده و اسید سولفوریک می دهد.
SO2 + H2O → H2SO3
انیدرید کرومیک با آب واکنش می دهد و منجر به تولید اسید کرومیک می شود.
Cr2O3 + H2O → H2Cr2O4
۲- اکسید بازی
یک اکسید بازی با آب واکنش می دهد و یک باز می دهد. به عنوان مثال می توان از اکسید اکثر فلزات مانند Na2O ، CaO ، BaO نام برد. اکسید های فلزی مانند کلسیم اکسید ماهیت بازی دارند.
اکسید کلسیم با آب واکنش می دهد و هیدروکسید کلسیم ، یک باز تولید می کند.
CaO + H2O → Ca (OH) 2
۳ – اکسید آمفوتریک
اکسید آمفوتریک یک اکسید فلزی است که رفتاری دوگانه از خود نشان می دهد. این ترکیبات ویژگی های اسیدی و بازی نشان می دهند و هم با مواد قلیایی و هم با اسیدها واکنش نشان می دهند.
به عنوان مثال ، اکسید روی هنگام واکنش با هیدروکسید سدیم غلیظ به عنوان یک اکسید اسیدی عمل می کند. با این حال ، در هنگام واکنش با اسید کلریدریک ، به عنوان یک اکسید بازی عمل می کند.
ZnO + 2H2O + 2NaOH → Na3Zn [OH] 4 + H2
ZnO + 2HCl → ZnCl2 + H2O
اکسید آلومینیوم نمونه دیگری است که با مواد قلیایی و همچنین اسیدها واکنش نشان می دهد.
Al2O3 (s) + 6NaOH (aq) + 3H2O (l) N 2Na3 [Al (OH) 6] (aq)
Al2O3 (s) + 6HCl (aq) + 9H2O (l) → ۲ [Al (H2O) 6] 3+ (aq) + 6Cl– (aq)
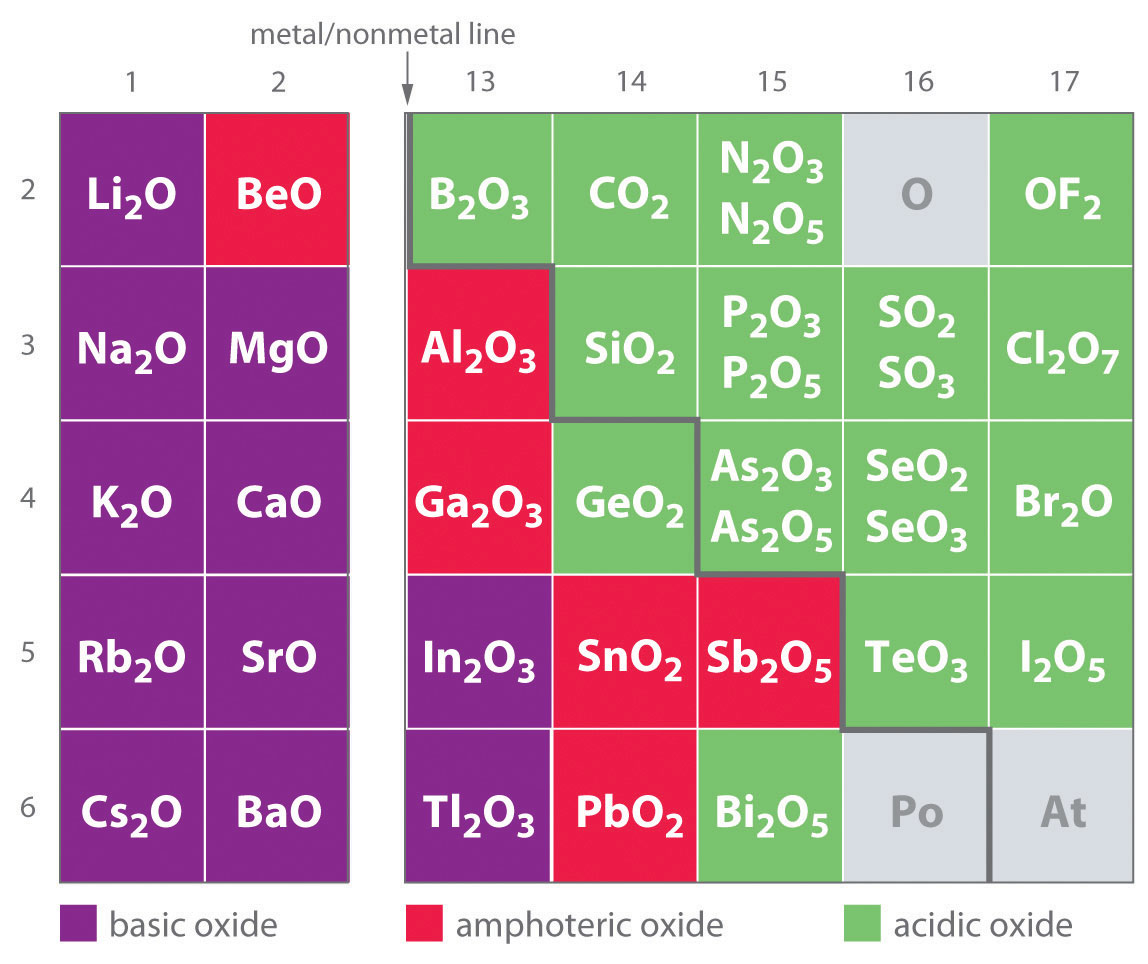
مثال اکسید بازی
تمام اکسیدهای موجود در عناصر گروه ۱ و ۲ بازی هستند (به جز BeO ) آنها با آب واکنش می دهند و یک باز تشکیل می دهند:
اکسید لیتیوم با آب واکنش می دهد و هیدروکسید لیتیوم تولید می کند Li2O (s) + H2O (l) → ۲ Li + (aq) + 2 OH−(aq)
اکسید سدیم با آب واکنش داده و هیدروکسید سدیم تولید می کند: Na2O (s) + H2O (l) Na 2 NaOH (aq)
اکسید پتاسیم برای تولید هیدروکسید پتاسیم با آب واکنش می دهد: (K2O(s) + H2O(l) → ۲ KOH(aq
اکسید روبیدیوم با آب واکنش داده و هیدروکسید روبیدیم تولید می کند : (Rb2O(s) + H2O(l) → ۲ RbOH(aq
اکسید سزیم برای تولید هیدروکسید سزیم با آب واکنش می دهد: Cs2O (s) + H2O (l) → ۲ CsOH (aq)
اکسید فرانسیوم برای تولید هیدروکسید فرانسیوم با آب واکنش می دهد : (Fr2O(s) + H2O(l) → ۲ FrOH(aq
اکسید منیزیم برای تولید هیدروکسید منیزیم با آب واکنش می دهد: MgO (s) + H2O (l) → Mg (OH) 2 (aq)
اکسید کلسیم برای تولید هیدروکسید کلسیم با آب واکنش می دهد: CaO (s) + H2O (l) → Ca (OH) 2 (aq)
اکسید استرانسیم با آب واکنش می دهد و هیدروکسید استرانسیم را تولید می کند: SrO (s) + H2O (l) → Sr (OH) 2 (aq)
اکسید باریم با آب واکنش می دهد و هیدروکسید باریم تولید می کند: BaO (aq) + H2O (l) → Ba (OH) 2 (aq)
اکسید رادیوم با آب واکنش می دهد و هیدروکسید رادیوم تولید می کند: RaO (aq) + H2O (l) → Ra (OH) 2 (aq)
برخی از اکسیدها در عناصر گروه ۱۳ بازی هستند یعنی با آب واکنش داده و یک باز ایجاد می کنند:
اکسید تالیوم (I) با آب واکنش می دهد و هیدروکسید تالیوم (I) تولید می کند: Tl2O (s) + H2O (l) → ۲ TlOH (aq)
برخی اکسیدها در عناصر گروه ۱۵ بازی هستند و با آب واکنش داده و یک باز ایجاد می کنند:
اکسید بیسموت (III) با آب واکنش می دهد و هیدروکسید بیسموت (III) را تولید می کند: Bi2O3 (s) + 3H2O (l) → ۲ Bi (OH) 3 (aq)
در واکنش های خنثی سازی ، اکسیدهای بازی با یک اسید واکنش داده و نمک و آب تشکیل می دهند:
اکسید منیزیم با کلرید هیدروژن (اسید) واکنش داده و کلرید منیزیم (نمک) و آب تولید می کند: MgO + 2 HCl → MgCl2 + H2O
اکسید سدیم با کلرید هیدروژن (اسید) واکنش داده و کلرید سدیم (نمک) و آب تولید می کند: Na2O + 2HCl → ۲NaCl + H2O
هیدروکسید سدیم با کلرید هیدروژن (اسید) واکنش داده و کلرید سدیم (نمک) و آب تولید می کند: NaOH + HCl → NaCl + H2O
اکسید های فلزی را چه می نامند؟
اکسیدهای فلزی حاصل واکنش فلز با اکسیژن هستند که آنها را زنگ می نامند مانند زنگ آهن که به رنگ های مختلف و البته بیشتر به رنگ قرمز و نارنجی قابل مشاهده است.
اکسید نافلزی چیست؟
اکسید نافلزی یا اکسید اسیدی اکسیدهایی هستند که با آب واکنش داده و یک اسید تولید می کنند یا با یک باز واکنش داده و نمک تشکیل می دهند. چند مثال اکسید اسیدی شامل سولفور تری اکسید ، کربن دی اکسید و سولفور دی اکسید هستند.
اکسید بازی چیست شیمی دهم
اکسیدهای پایه که به عنوان اکسیدهای قلیایی نیز شناخته می شوند، اکسیدهایی هستند که با اسیدها واکنش داده و نمک و آب تشکیل می دهند. آنها از واکنش یک فلز با اکسیژن تشکیل می شوند. به عنوان مثال، هنگامی که سدیم با اکسیژن واکنش می دهد، اکسید سدیم را تشکیل می دهد که یک اکسید پایه است. به طور مشابه، هنگامی که منیزیم، کلسیم یا باریم با اکسیژن واکنش می دهند، به ترتیب اکسید منیزیم، اکسید کلسیم و اکسید باریم را تشکیل می دهند.
اکسید سدیم (Na2O) یک اکسید بازی قوی است. هنگامی که با آب واکنش می دهد، هیدروکسید سدیم (NaOH) را تشکیل می دهد که یک باز قوی است. این واکنش گرمازا است، به این معنی که گرما را آزاد می کند. معادله این واکنش Na2O + H2O → ۲NaOH است.
اکسید منیزیم (MgO) نمونه دیگری از اکسیدهای پایه است. همچنین با آب واکنش می دهد و هیدروکسید منیزیم (Mg(OH)2) را تشکیل می دهد، اگرچه این واکنش به شدت واکنش اکسید سدیم با آب نیست. معادله این واکنش MgO + H2O → Mg(OH)2 است.
اکسید کلسیم (CaO) که به عنوان آهک زنده یا آهک سوخته نیز شناخته می شود، یک اکسید پایه است. هنگامی که با آب واکنش می دهد، هیدروکسید کلسیم (Ca(OH)2) را تشکیل می دهد که به عنوان آهک خاموش نیز شناخته می شود. این واکنش بسیار گرمازا است. معادله این واکنش CaO + H2O → Ca(OH)2 است.
اکسید باریم (BaO) یک اکسید پایه است که با آب واکنش می دهد و هیدروکسید باریم (Ba(OH)2) را تشکیل می دهد. معادله این واکنش BaO + H2O → Ba(OH)2 است.
به طور خلاصه، اکسیدهای بازی از واکنش یک فلز با اکسیژن تشکیل می شوند و با اسیدها واکنش داده و نمک و آب تشکیل می دهند. اکسید سدیم، اکسید منیزیم، اکسید کلسیم و اکسید باریم همگی نمونه هایی از اکسیدهای بازی هستند.