کاتیون چیست و چه ویژگی هایی دارد؟
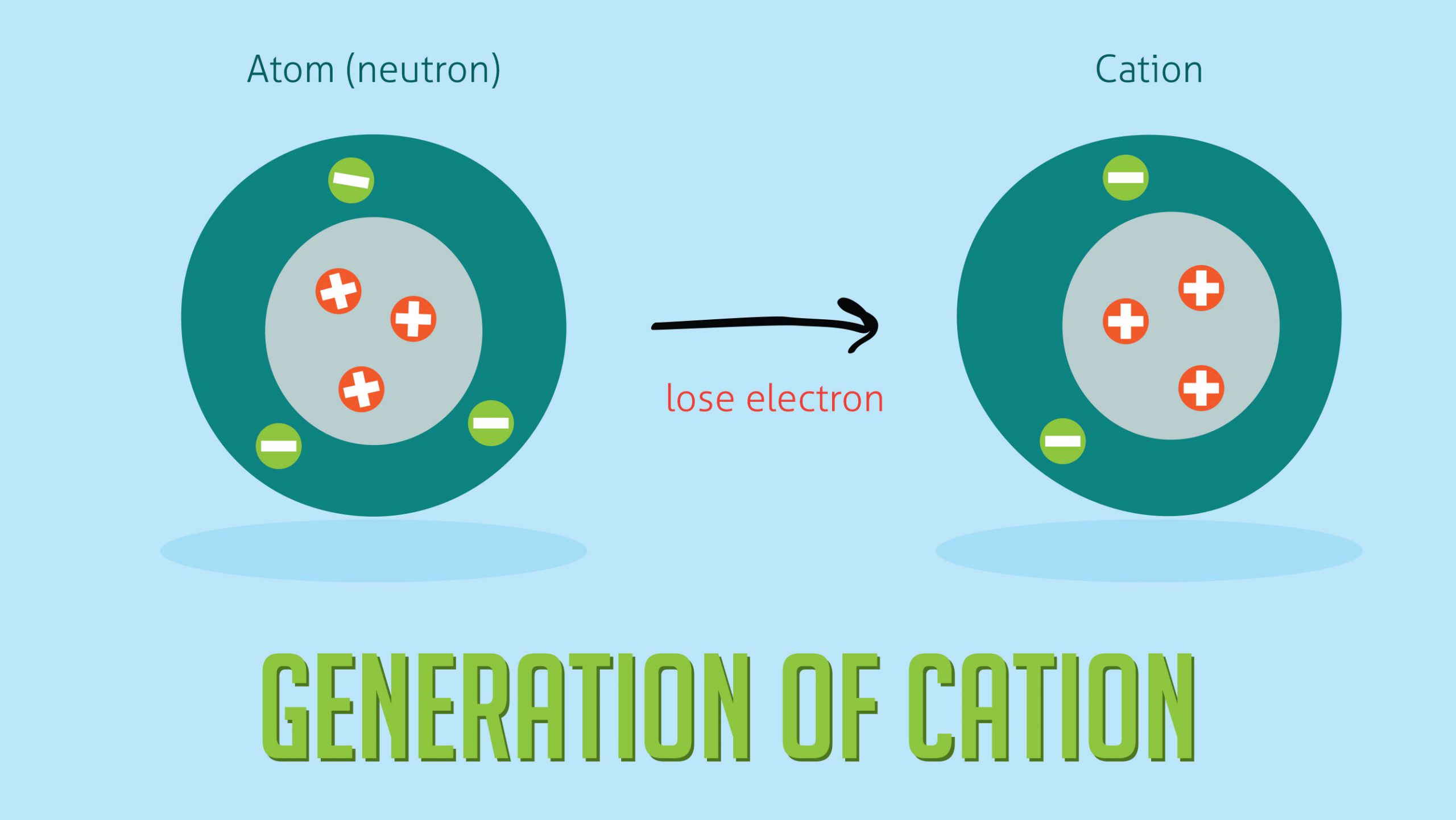
کاتیون یونی است که دارای پروتون بیشتری نسبت به الکترون است که در نتیجه یک بار مثبت خالص به آن می دهد.

برای تشکیل یک کاتیون ، باید یک یا چند الکترون از دست برود که معمولا توسط اتم هایی که میل بیشتری نسبت به آنها دارند ، جذب می شود. تعداد الکترون های از دست رفته و بنابراین بار یون پس از نماد شیمیایی نشان داده می شود ، به عنوان مثال نقره (Ag) یک الکترون را از دست می دهد تا تبدیل به +Ag شود ، در حالی که روی (Zn) دو الکترون را از دست می دهد تا+Zn۲ شود. این موارد در مبحث کاتیون و آنیون چیست علوم نهم شرح داده شده است.
وقتی فلز الکترون های خود را از دست می دهد ، کاتیون تشکیل می شود. فلزات یک یا چند الکترون از دست می دهند و تمام پروتون خود را نگه می دارند. بنابراین کاتیون ها دارای بار مثبت خالص هستند مانند کاتیون نیکل و کاتیون منگنز.
یک روش آسان برای به خاطر سپردن اینکه کاتیون ها یون های مثبت هستند جایگزینی حرف t در کاتیون با علامت مثبت + است. شما می توانید کاتیون را به لاتین اینگونه بنویسید ca + ion ، علامت مثبت به اندازه کافی شبیه tاست که به عنوان کاتیون خوانده شود.کاتیون ها و آنیون ها هر دو یون هستند. تفاوت بین کاتیون و آنیون بار الکتریکی خالص آنها می باشد. برای کسب اطلاعات بیشتر در این رابطه با ما در نشریه جهان شیمی فیزیک همراه باشید.
کاتیون چگونه تشکیل می شود؟
اتمهای فلزی بعضی از الکترون های خود را نسبتاً آزاد نگه می دارند. در نتیجه ، آنها تمایل به از دست دادن الکترون و تشکیل کاتیون دارند. برعکس ، اکثر اتمهای غیر فلزی الکترون ها را با شدت بیشتری نسبت به اتمهای فلزی جذب می کنند و بنابراین آنیون ها تشکیل دهند. بنابراین ، وقتی اتمهای یک فلز و یک عنصر غیر فلزی با هم ترکیب می شوند ، اتمهای غیر فلزی تمایل دارند یک یا چند الکترون را از اتمهای فلزی جذب کرده و یون تشکیل دهند. این یونهای متضاد بار دیگر یکدیگر را جذب می کنند تا پیوندهای یونی تشکیل دهند و ترکیبات یونی بدون بار خالص تولید کنند. به عنوان مثال می توان به کلرید کلسیم (CaCl2) ، یدید پتاسیم (KI) و اکسید منیزیم (MgO) اشاره کرد.
ویژگی های کاتیون
یونها در حالت در حالت گازی بسیار واکنش پذیر هستند و به سرعت با یونهای دارای بار مخالف برهم کنش می کنند تا مولکولهای خنثی یا نمک های یونی تشکیل دهند. یونها نیز در حالت مایع یا جامد نیز تولید می شوند درست وقتی که نمک ها با حلال ها (به عنوان مثال آب) برهم کنش می کنند و یونهای حل شده را تولید می کنند که از ثبات بیشتری برخوردار هستند ، به دلایلی از جمله تغییرات انرژی و آنتروپی یونها برای تعامل با مایع از یکدیگر دور می شوند. این گونه های تثبیت شده معمولاً در دمای پایین در محیط یافت می شوند. یک مثال متداول در این رابطه یونهای موجود در آب دریا است که از نمکهای محلول حاصل می شود. در مبحث کاتیون چیست علوم هشتم به این موارد اشاره شده است.
به عنوان اجسام باردار ، یون ها جذب بارهای الکتریکی مخالف (مثبت به منفی) دارند و با بارهای مشابه دفع می شوند. هنگام حرکت در یک مسیر آنها می تواند توسط یک میدان مغناطیسی منحرف شود.
آنیون ها (یون های دارای بار منفی) بزرگتر از مولکول یا اتم اصلی هستند ، زیرا با جذب الکترون های اضافی یکدیگر را دفع می کنند و به اندازه فیزیکی یون اضافه می شود. کاتیون ها به دلیل کوچکتر بودن ابر الکترون ، کوچکتر از اتم یا مولکول اصلی مربوطه هستند. یک کاتیون خاص (هیدروژن) حاوی الکترون نیست ، بنابراین از یک پروتون تشکیل شده است و بسیار کوچکتر از اتم هیدروژن اصلی است.

تاریخچه کشف کاتیون و آنیون
اصطلاح “یون” توسط فیزیکدان و شیمی دان انگلیسی مایکل فارادی در سال ۱۸۳۴ معرفی شد. وی کشف کرد بخش هایی از مولکولها از آند به سمت کاتد یا بالعکس حرکت می کند.
وی کشف کرد که برخی از مواد هنگام حل شدن در آب جریان الکتریکی را هدایت می کنند. وی همچنین متوجه شد که با عبور جریان الکتریکی از ترکیب ، برخی از ترکیبات به عناصر اولیه خود تجزیه می شوند. فارادی اصطلاح یون ها (یا در یونانی سرگردان) را برای توصیف گونه های شیمیایی عبور کرده از محلول معرفی کرد. وی همچنین اصطلاحات “آنیون” و “کاتیون” را برای یونهای منفی و مثبت و “آند” و “کاتد” را برای الکترودهای مثبت و منفی معرفی کرد.
کاتیون در فرمول های شیمیایی
هنگام نوشتن فرمول یک ترکیب ابتدا کاتیون نوشته می شود و بعد از آن آنیون ذکر می گردد. به عنوان مثال ، در NaCl ، اتم سدیم به عنوان کاتیون عمل می کند ، در حالی که اتم کلر به عنوان آنیون عمل می کند.
کاتیون در جدول تناوبی
بر اساس نظم موجود در جدول تناوبی و آرایش فلزات و نافلزات می توان پیش بینی کرد که آیا اتم بر اساس موقعیت خود در جدول تناوبی کاتیون تشکیل می دهد یا آنیون. هالوژن ها همیشه آنیون ، فلزات قلیایی و فلزات قلیایی همیشه کاتیون تشکیل می دهند. اکثر فلزات دیگر کاتیون تشکیل می دهند (به عنوان مثال آهن ، نقره ، نیکل) ، در حالی که بیشتر غیر فلزات به طور معمول آنیون تشکیل می دهند (به عنوان مثال اکسیژن ، کربن ، گوگرد). با این حال ، برخی از عناصر با توجه به شرایط مناسب قادر به تشکیل هر دو کاتیون و آنیون هستند. یک مثال هیدروژن است که ممکن است یک الکترون بدست آورد (–H) یا از دست بدهد (+H ) ، و ترکیبات هیدریدی مانند ZnH۲ که آنیون محسوب می شود و یا ترکیبات هیدرونی مانند H2O تشکیل دهد که کاتیون است محسوب می شود.
عناصر گروه ۱۸ جدول تناوبی – “گازهای نجیب” ، به دلیل آرایش الکترون هایشان ، یون تشکیل نمی دهند که باعث می شود آنها به طور کلی واکنش نشان ندهند. در مبحث کاتیون چیست علوم نهم و کاتیون شناسی علوم دهم این موارد شرح داده شده است.
تفاوت بین کاتیون و آنیون چیست؟
| آنیون | کاتیون
| |
| تعریف | اتم یا مولکول دارای بار منفی | اتم یا مولکول دارای بار مثبت |
| نوع بار | دارای بار منفی | دارای بار مثبت |
| نوع عنصر | غیر فلزی | فلزی |
| نوع الکترود مورد کاربرد | آند | کاتد |
| مثال | سولفید ، اکسید ، فلورید و کلرید | آهن ، سرب ، سدیم |
جدول کاتیون و آنیون
آنیون ها و کاتیون ها هر دو یون هستند. آنها دارای بار الکتریکی مخالف هستند ، بنابراین جذب یکدیگر می شوند. کاتیون ها، کاتیون های دیگر را دفع می کند در حالی که آنیون ها ، آنیون های دیگر را دفع می کنند. در کاتیون تعداد پروتون ها بیشتر از تعداد الکترون ها است در حالیکه در آنیون ها تعداد الکترون ها بیشتر از تعداد پروتون ها است.

کاربردهای کاتیون
یون ها بخش مهمی از موضوعات علم هستند شيمی حاصل از اتمها و الكترون هایی است كه با حذف يا افزودن يك يا چند الكترون ظرفيتي وزن خود را افزایش داده يا از دست داده اند كه باعث ايجاد بار مثبت يا منفی می شود.
یون ها ماهیت همه گیر دارند و مسئول پدیده های مختلفی از لومینسانس خورشید تا وجود یونوسفر زمین هستند. اتمها در حالت یونی خود ممکن است رنگ متفاوتی با اتمهای خنثی داشته باشند و بنابراین جذب نور توسط یونهای فلزی باعث ایجاد رنگ سنگ های قیمتی می شود. در هر دو شیمی معدنی و آلی (از جمله بیوشیمی) ، فعل و انفعال یون ها بسیار مهم است.
کاتیون ها نقش مهمی در زندگی روزمره ما دارند. یون های سدیم ، پتاسیم و منیزیم برای فرآیندهایی مانند تنظیم فشار خون و انقباض عضلات ضروری هستند. یون کلسیم قسمت مهمی از ساختار استخوان است. از یون های سدیم می توان در نرم کننده های آب برای از بین بردن سایر عناصر مضر استفاده کرد. سدیم کلرید (نمک خوراکی) را به غذای خود اضافه می کنیم و از آن به عنوان ماده نگهدارنده استفاده می کنیم.
استفاده از خواص کاتیونی و آنیونی در صنایع
از خصوصیات یونی می توان برای اهداف مختلفی استفاده کرد. به عنوان مثال از کروماتوگرافی تبادل یونی برای خالص سازی پروتئین ها و بیومولکول های باردار دیگر مانند اسید نوکلئیک ها و اسیدهای آمینه استفاده می شود.همچنین برای جداسازی و ارزیابی یون های معدنی مانند اکتنیدها و لانتانیدها نیز به استفاده می شوند.
ویژگی های یونی در عملکرد باتری ها نیز مهم هستند. باتری ها دارای دو الکترود ساخته شده از مواد رسانا هستند ، کاتد در انتهای مثبت و محل خروج جریان الکتریکی / الکترون ها است و آند محل ورود جریان الکتریکی / الکترون ها است. در بین الکترودها یک مایع یا ژل الکترولیت وجود دارد که حاوی ذرات باردار – یون ها است. همانطور که این ماده یونی با الکترودها واکنش می دهد ، جریان الکتریکی ایجاد می کند.
در باتری های خشک ، روی معمولاً به عنوان آند استفاده می شود در حالی که دی اکسید منگنز یک انتخاب محبوب برای کاتد است. آند روی همچنین به عنوان ظرف باتری در باتری های روی – کربن عمل می کند ، بنابراین در هنگام استفاده اکسید می شود و با گذشت زمان محتوای آن شروع به نشت می کند.
کاتیون فلز است یا نافلز
کاتیون ها یون هایی با بار مثبت هستند. هنگامی که یک فلز الکترون های خود را از دست می دهد، آنها تشکیل می شوند. کلسیم (Ca2+)، پتاسیم (K+) و هیدروژن (H+) نمونههایی از کاتیونها هستند. رایج ترین کاتیون های عناصر معمولی آنهایی هستند که در آنها تمام الکترون های ظرفیت از بین رفته اند. سدیم، یک فلز قلیایی را در نظر بگیرید. در سومین سطح انرژی اصلی، یک الکترون ظرفیت دارد. یون سدیم اکنون دارای یک هشت الکترون از دومین سطح انرژی اصلی پس از از دست دادن آن الکترون است. یک اتم و یک یون از یک اتم متفاوت (یا دو یون جداگانه) که دارای پیکربندی الکترونی یکسان هستند، ایزوالکترونیک نامیده می شوند. یون سدیم و اتم نئون ایزوالکترونیک هستند.
کاتیونها معمولاً از اتمهای فلزی ساخته می شوند، با این حال یونهای رادیکال مثبت، مانند یون آمونیوم (NH4+)، میتوانند چندین اتم داشته باشند. از آنجایی که کاتیون ها دارای پروتون های بیشتری نسبت به الکترون ها هستند، کاتیون ها دارای بار مثبت هستند. در نتیجه کاتیون ها دارای کمبود الکترون هستند.
شعاع یونی کاتیون ها برای تعیین اندازه آنها استفاده می شود و کاتیون ها به طور کلی شعاع کمتری نسبت به اتم های مادر خود دارند زیرا یک مدار کمتر دارند. کوچکترین کاتیون بدون الکترون هیدروژن است که به طور قابل ملاحظه ای کوچکتر از اتم مادر است.
آنیون ها یون هایی با بار منفی هستند. هنگامی که یک غیر فلز الکترون به دست می آورد، آنها تشکیل می شوند. آنها یک یا چند الکترون دریافت می کنند اما تمام پروتون های خود را حفظ می کنند. در نتیجه دارای بار منفی خالص هستند. یدید (I–)، کلر (Cl–) و هیدروکسید (OH–) نمونههایی از آنیونها هستند.
اتم های غیر فلزی اغلب الکترون می گیرند تا زمانی که بیرونی ترین سطح انرژی اصلی آنها به یک اکتت برسد. به جز نئون، همه این آنیون ها ایزوالکترونیک هستند. بیشترین تعداد الکترونهای بدست آمده در تولید آنیونها در شرایط عادی سه عدد است.



















