اکسید اسیدی (اکسید نافلز) چیست و چگونه ایجاد می شود؟

اکسید اسیدی ، اکسیدی است که در واکنش با آب یک اسید تولید می کند و به عنوان اکسید نافلز نیز شناخته می شوند. اکسید نوعی ترکیب شیمیایی است که حداقل در فرمول شیمیایی خود حاوی یک اتم اکسیژن باشد. بیشتر پوسته زمین از اکسیدهای جامد تشکیل شده است که نتیجه اکسیده شدن عناصر توسط اکسیژن موجود در هوا یا آب می باشد. در مبحث اکسید اسیدی شیمی دهم به این موارد پرداخته شده است.
مونوکسید کربن (CO) و دی اکسید کربن (CO2) که از احتراق هیدروکربن ها بدست می آیند دو اکسید اسیدی بسیار معروف هستند. حتی موادی که به صورت عناصر خالص در نظر گرفته می شوند اغلب دارای یک پوشش اکسید بر روی خود می باشند. به عنوان مثال فویل آلومینیوم پوسته نازکی از Al2O3 ایجاد می کند که از آن در برابر خوردگی بیشتر محافظت می کند.
برخی از اکسیدهای اسیدی موجود در هوا عبارتند از دی اکسید نیتروژن (NO2) ) دی اکسید گوگرد (SO2 ) ، مونوکسید کربن (CO) و دی اکسید کربن (CO2). در مبحث اکسید اسیدی چیست شیمی دهم به این موارد اشاره شده است. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا همراه ما باشید.
توصیف اکسید اسیدی و اکسید بازی
سطح اکثر فلزات در حضور هوا از اکسیدها و هیدروکسیدها تشکیل شده است. همانطور که در بالا ذکر شد ، یک نمونه معروف فویل آلومینیوم است که با یک فیلم نازک از اکسید آلومینیوم پوشانده شده و فلز را منفعل می کند و باعث جلوگیری از خوردگی بیشتر می شود. لایه اکسید آلومینیوم را می توان با فرآیند آنودایزینگ الکترولیتی با ضخامت بیشتری ساخت. اگرچه منیزیم و آلومینیوم در STP به آهستگی با اکسیژن واکنش نشان می دهند ، اما آنها مانند اکثر فلزات در هوا می سوزند و دمای بسیار بالایی ایجاد می کنند.
بطورکلی چهار نوع اکسید وجود دارد که شامل اکسیدهای اسیدی ، اکسید های بازی ، آمفوتریک و اکسیدهای خنثی هستند. اکسیدهای غیر فلزی اسیدی شامل CO2 ، NO2 ، SO2 ، SO3 ، Cl2O7 ، P2O5 و غیره هستند. از طرف دیگر ، انواع اکسیدهای فلزی به عنوان اکسیدهای بازی شناخته شده و شاملNa2O ، K2O ، CaO ، MgO و غیره هستند.
تشکیل اکسید اسیدی و اکسید بازی
اکسیدهای اسیدی یا انیدرید اسید ، اکسیدهایی هستند که با آب واکنش می دهند و یک اسید تشکیل می دهند یا با یک باز واکنش داده و یک نمک تشکیل می دهند. اکسیدهای غیر فلزات یا فلزات در حالت اکسیداسیون بالا قرار دارند. شیمی آنها را می توان به طور سیستماتیک با گرفتن یک اکسو اسید و حذف آب از آن درک کرد ، تا زمانی که فقط یک اکسید باقی بماند. به عنوان مثال ، اسید سولفور (SO2) ، اسید سولفوریک (SO3) و اسید کربنیک (CO2) اکسیدهای اسیدی هستند. انیدرید غیر آلی (یک اصطلاح تا حدودی قدیمی) یک انیدرید اسید فاقد بخش آلی است.
اکسیدهای اسیدی اسیدهای برونشتد – لوری نیستند زیرا پروتون اهدا نمی کنند. با این حال ، آنها اسیدهای آرنیوس هستند زیرا غلظت یون هیدروژن آب را افزایش می دهند. به عنوان مثال ، دی اکسید کربن غلظت یون هیدروژن آب باران (۶/۵ =pH ) را ۲۵ برابر نسبت به آب خالص (۷ =pH ) افزایش می دهد. آنها همچنین اسیدهای لوئیس هستند ، زیرا جفت الکترون را از برخی بازهای لوئیس ، به ویژه انیدریدهای بازی می پذیرند.
لازم به ذکر است که از واکنش اکسیدهای نافلزی با آب، اسید اکسیژن دار تولید می شود. واکنش تشکیل اسید از اکسید مربوطه ممکن است یک واکنش کامل یا تعادلی باشد. در واقع اگر اسید پایدار باشد واکنش تشکیل آن کامل خواهد بود و اگر ناپایدار باشد واکنش تشکیل آن تعادلی خواهد بود. جالب است بدانید که اسیدهای H۲SO۳ و H۲CO۳ اسیدهای ناپایدار هستند.
اکسید اسیدی در جدول تناوبی
در جدول تناوبی با حرکت در طول دوره ها اکسیدها اسیدی تر می شوند. اکسیدهای سدیم و منیزیم قلیایی هستند. اکسیدهای آلومینیوم آمفوتریک هستند. اکسیدهای سیلیسیم ، فسفر ، گوگرد و کلر اسیدی هستند. برخی از اکسیدهای غیر فلزی ، مانند اکسید نیتروژن (N2O) و مونوکسیدکربن (CO) ، هیچ ویژگی اسید / باز را نشان نمی دهند.
اکسیدهای اسیدی همچنین می توانند با اکسیدهای بازی واکنش داده و نمک های اکسوژن تولید کنند:
۲ MgO + SiO2 → Mg2SiO4
اکسیدهای اسیدی از نظر زیست محیط نیز حائز اهمیت هستند. گوگرد و اکسیدهای ازت آلاینده هوا محسوب می شوند زیرا با بخار آب موجود در جو واکنش می دهند و باران اسیدی تولید می کنند.
واکنش های اکسید اسیدی
اگرچه طبقه بندی این اکسیدها به عنوان اسید دشوار است ، اما این خاصیت در واکنش با بازها آشکار می شود. به عنوان مثال ، دی اکسید کربن با بازها واکنش می دهد.
CO2 + 2OH− ⇌ HCO3− + OH− ⇌ CO32− + H2O
به همین دلیل بازها را محصور می کنند تا از واکنش آنها با دی اکسید کربن موجود در اتمسفر جلوگیری کنند. در ژئوشیمی سیلیکات های پیچیده غالباً به گونه ای نوشته می شوند که گویی حاصل واکنش اسید و باز هستند. به عنوان مثال ، فرمول شیمیایی ماده معدنی اولیوین را می توان به صورت (Mg,Fe)2SiO4 یا به صورت (MgO,FeO)2SiO2 نوشت. گفته می شود که این ماده معدنی اولترامافیک است ، به این معنی که محتوای اسمی بسیار زیادی اکسید منیزیم بازی و اکسید آهن دارد و از این رو مقدار اسید دی اکسید سیلیسیم آن بسیار کم است.

مثال اکسید اسیدی و واکنش های آنها
دی اکسید کربن در واقع یک انیدرید اسید کربنیک است:
H2CO3 -> H2O + CO2
آنزیم کربنیک انهیدراز که این واکنش را کاتالیز می کند به دلیل ویژگی دی اکسید کربن اینگونه نامگذاری شده است.
تری اکسید کروم با آب واکنش می دهد و اسید کرومیک تولید می کند.
پنتا اکسید دی نیتروژن با آب واکنش می دهد و اسید نیتریک تشکیل می دهد.
هپتواکسید منگنز با آب واکنش داده و تشکیل اسید پرمنگانیک می دهد.
اکسید فلزی چیست و اکسید های فلزی را چه مینامند؟
اکسید فلزی از ترکیب فلز و اکسیژن تشکیل می شود و معمولا به آن زنگ می گویند. معروف ترین اکسید فلزی ، اکسید آهن (Fe2O3) است که نام آن هماتیت است و همان زنگ آهن است که بر روی سطح این فلز در تماس با آب و رطوبت هوا تشکیل می شود.
اکسید های اسیدی و بازی شیمی دهم
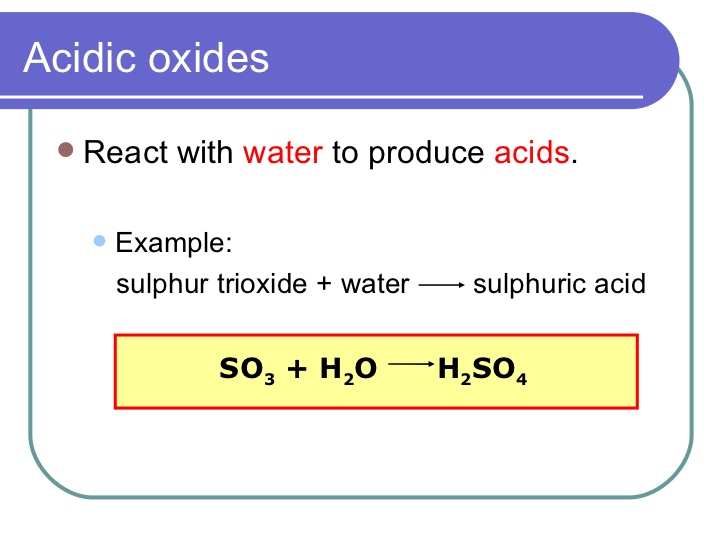
اکسیدهای اسیدی، همچنین به عنوان انیدریدهای اسیدی شناخته می شوند، معمولاً اکسیدهای غیر فلزات هستند. این اکسیدها با آب واکنش داده و اسید تشکیل می دهند و خاصیت اسیدی از خود نشان می دهند. مثال: تری اکسید گوگرد (SO3) یک اکسید اسیدی است زیرا با آب واکنش می دهد و اسید سولفوریک (H2SO4) تشکیل می دهد. از طرف دیگر، اکسیدهای پایه معمولاً اکسیدهای فلزات هستند. این اکسیدها با آب واکنش داده و یک پایه تشکیل می دهند و خواص اساسی را از خود نشان می دهند. مثال: اکسید کلسیم (CaO) یک اکسید پایه است زیرا با آب واکنش می دهد و هیدروکسید کلسیم (Ca(OH)2) تشکیل می دهد.
برای پیش بینی اسیدی یا بازی بودن یک اکسید، باید عناصر موجود در ترکیب و موقعیت آنها را در جدول تناوبی بررسی کنیم. در اینجا دستورالعمل های کلی آمده است:
اکسیدهای غیر فلزات تمایل به اسیدی دارند: غیر فلزات در سمت راست جدول تناوبی (به استثنای هیدروژن) قرار دارند. عناصری مانند کربن، نیتروژن و گوگرد، اکسیدهای اسیدی مانند CO2، NO2 و SO3 را تشکیل می دهند.
اکسیدهای فلزات تمایل به بازی دارند: فلزات در سمت چپ و مرکز جدول تناوبی قرار دارند. عناصری مانند سدیم، منیزیم و کلسیم اکسیدهای اساسی مانند Na2O، MgO و CaO را تشکیل می دهند. ۳. اکسیدهای عناصر با خواص فلزی و غیرفلزی (فلزات) می توانند رفتار آمفوتریک نشان دهند. این اکسیدها می توانند هم با اسیدها و هم با بازها واکنش دهند. به عنوان مثال: اکسید آلومینیوم (Al2O3) و اکسید روی (ZnO).
یک اکسید به عنوان اسیدی یا بازی مستلزم بررسی عناصر درگیر در اکسید و موقعیت آنها در جدول تناوبی است. اکسیدهای غیر فلزی معمولاً خواص اسیدی از خود نشان می دهند، در حالی که اکسیدهای فلزی در طبیعت بازی هستند. برخی از اکسیدهای متالوئید رفتار آمفوتریک نشان می دهند.



















