گازهای نجیب (بی اثر) – عناصر گروه ۱۸ جدول تناوبی
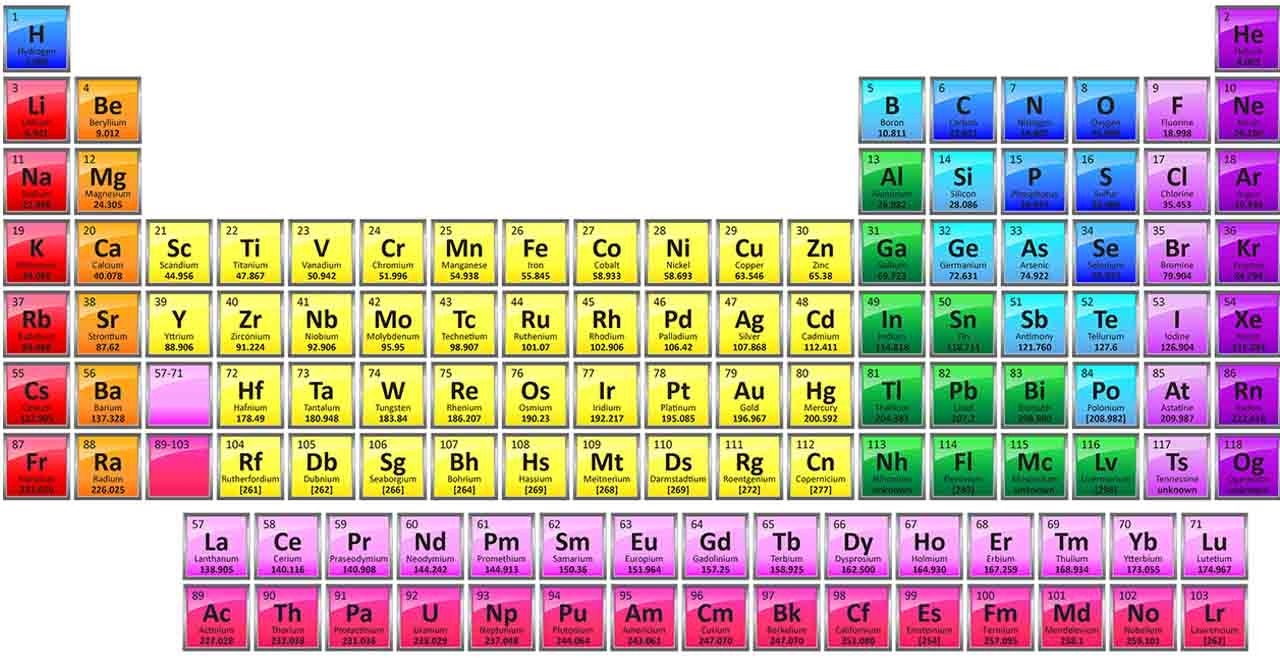
گروه ۱۸ از جدول تناوبی شامل ۷ عنصر است که همگی در دمای اتاق به شکل گاز و تک اتمی وجود دارند به گازهای نجیب معروفند.

این عناصر به ترتیب از بالا به پایین جدول عبارتند از: هلیم (He)، نئون (Ne)، آرگون (Ar)، کریپتون (Kr)، زنون (Xe)، رادون (Rd) و عنصر تازه کشف شده اگانسون (Og). اگانسون عدد اتمی ۱۱۸ دارد و در سال ۲۰۱۷ به جدول اضافه شده است. آرایش الکترونی لایه ظرفیت آن ها به جز هلیم (۲S۲)، ns۲np۶ می باشد. در این مقاله نشریه جهان شیمی فیزیک به خواص و کاربردهای این عناصر می پردازیم.
علت نام گذاری گازهای بی اثر
در گذشته به گازهای نجیب به دلیل اینکه نمی توانند با دیگر اتم ها پیوند برقرار کنند عناصر گروه صفر گفته می شد. علت نامگذاری آن ها به گازهای نجیب و بی اثر نیز به دلیل واکنش پذیری بسیار سخت آن هاست. این گازها از نظر شیمیایی خنثی هستند یعنی تمایل به شرکت در واکنش های شیمیایی ندارند و دلیل این امر آرایش الکترونی لایه ظرفیت آن هاست که کاملا از الکترون پر می باشد و میلی به گرفتن و از دست دادن الکترون ندارد و خودشان در حالت پایدار هستند. در واقع عدد اکسایش این گازها صفر است.
تشکیل گازهای نجیب
این گازها فراوانی بسیار پایینی در جو دارند. از بین عناصر گروه ۱۸ جدول تناوبی هلیم فراوانترین است اما چون این گاز سبک است و به سمت لایه های بالایی اتمسفر می رود (بادکنک های پرشده از گاز هلیم) به دست آوردن آن سخت بوده و بیشتر از منابع گاز طبیعی تهیه می شود. بقیه گازهای این گروه به جز رادون در هوا وجود دارد. اگر هوا را تا نقطه انجماد گازهای نجیب موجود در هوا سرد کنیم، با عمل تقطیر جز به جز و جداسازی می توانیم این گازها را به دست آوریم.

نکته
از بین این گازها رادون رادیواکتیو بوده و توسط فردریک دورن از تجزیه رادیواکتیوی توریوم و رادیوم کشف شده است. به بیانی دیگر در تجزیه رادیوم ذره های آلفا (هسته هلیم با عدد اتمی ۲) و انرژی از این عنصر تابش شده و عنصر رادون باقی می ماند. ذرات دیگری که از تجزیه و فروپاشی عناصر سنگین می توانند ساطع شوند بتا و گاما می باشند. جدیدترین فرضیه دانشمندان برای منبع گاز آرگون پوسته اقیانوسی است که سرشار از کانی های آرگون می باشد. در نهایت اوگانسون از ضربه زدن به ذرات شتاب دار تهیه می شود. چون وجود این گازها در سیارات دیگر ثابت شده در آینده امکان تهیه آن ها از سیارات دیگر وجود دارد.
خواص گازهای نجیب
گازهای نجیب بی رنگ، بی بو و بی مزه هستند. شعاع اتمی در این گروه از بالا به پایین گروه با افزایش تعداد لایه های الکترونی افزایش می یابد. در بین عناصر هر دوره در جدول تناوبی گازهای بی اثر بیشترین انرژی یونیزاسیون را دارند. در این گازها الکترونگاتیوی بسیار کم است نقطه ذوب و جوش همچنین پایین است. کمترین نقطه ذوب را هلیم در بین این عناصر دارد. این گازها حلالیت خیلی کمی در آب دارند.
خواص هلیم و نئون
هلیم سبک ترین این گازهاست و از نظر فراوانی در جهان بعد از هیدروژن قرار دارد. این گاز به شکل مایع نیز می تواند وجود داشته باشد اما به شکل جامد هرگز در نمی آید. این گاز انفجاری نیست ولی هلیم مایع داخل کپسول در اثر گرمای زیاد ممکن است منفجر شود.
نئون از سه ایزوتوپ پایدار تشکیل شده است. این گاز مانند دیگر گازهای عناصر گروه هشتم اصلی بی اثر است. اما بعضی یون های نئون از جمله Ne+، NeH+، NeAr+ و HeNe+ در طیف سنجی جرمی شناخته شده و رنگ درخشندگی نئون برانگیخته شده نارنجی مایل به قرمز است. نئون غیر سمی است اما تنفس زیاد آن می تواند بدن را با کمبود اکسیژن مواجه کند.

خواص آرگون و رادون
آرگون نیز مانند نئون مخلوطی از سه ایزوتوپ پایدار است و چون به حدی سنگینی دارد که تحت اثر گرانشی زمین باقی بماند پس در جو زمین فراوان وجود دارد. کریپتون متراکم و غیرسمی است اما ترکیبات آن رنگی و سمی است. رادون سنگین بوده به صورت مایع فسفر زرد و درخشان است. اگانسون طول عمر بسیار کوتاهی دارد به همین دلیل خواص فیزیکی و شیمیایی آن را نمی توان متوجه شد. چون عدد اتمی این عنصر بالاست نیروی دافعه بین بارهای مثبت بیشتر از نیروی هسته ای بوده و اگانسون به شکل حباب است.

ترکیبات گازهای نجیب
گفته شد گازهای بی اثر تمایل به انجام واکنش ندارند اما مارسلین بارتلت اولین بار ترکیبی از زنون تهیه کرد و به تدریج ترکیبات دیگر ساخته شدند که مهمترین آن ها XF۶ می باشد. تری اکسید زنون از تتروکسید زنون اهمیت بیشتری دارد.
کاربردهای گازهای نجیب

کاربرد هلیم
هلیم و آرگون قابل دسترس ترین گازهای نجیب بوده و بیشتر مورد استفاده هستند. از گاز هلیم به دلیل نقطه ذوب پایین برای خنک کردن قطعات ابررساناها در دستگاه MRI استفاده می کنند. از آن جاییکه اگر هلیم وارد خون انسان شود هیچ واکنشی با خون ندارد و قابل حل در مایعات نیست، برای تنفس راحت تر غواص ها به کپسول اکسیژن آن ها هلیم اضافه می کنند. از هلیم برای محافظت از قوس های جوشکاری نیز استفاده می کنند. کاربردهای دیگر هلیم استفاده در کیسه هوای اتومبیل ها، نشت یابی گاز و بالن های هوایی و بادکنک ها را می توان نام برد. اما تنفس زیاد هلیم ممکن است باعث تغییر صدای افراد، تهوع، سردرد و سرگیجه شود. هلیم در تهیه بلور سیلیسیم و ژرمانیوم و طیف سنجی های جرمی نیز به کار برده می شود.

کاربرد آرگون
از آرگون در برای تولید پلاسما جهت استفاده در پزشکی و فرآیند لایه نشانی استفاده می شود. با تبدیل گاز آرگون به پلاسما با ایجاد اختلاف پتانسیل رنگ اتم های برانگیخته آرگون بنفش می شود. از آرگون در پنجره های دوجداره برای پرکردن فضای بین شیشه استفاده می شود. کارایی دیگر آرگون در کربن گیری از فولاد ضدزنگ، شست و شوی فلزات مذاب و عکاسی است. آرگون در ترکیب با دی اکسید کربن در آتش خاموش کن ها به کار گرفته می شود.
کاربرد نئون
این گاز در ساخت تابلوهای تبلیغاتی، لامپ های نئونی (نور قرمز)، چراغ چشمک زن، تیوب های تلویزیون، لیزر نئون- هلیم و نمایشگرهای ولتاژ بالا کاربرد دارد. مانند هلیم چون نقطه ذوب وجوش پایینی دارد به عنوان خنک کننده استفاده می شود. داخل لوله بی رنگ نئون خالص نور قرمز را جذب کرده نور آبی به نام نور فلورسنت را منتشر می کند.
کاربرد کریپتون
از کریپتون مانند آرگون به دلیل رسانایی گرمایی پایین به عنوان عایق در پنجره های دو جداره استفاده می شود. کریپتون در لیزرها، منابع سوختی، کالریمتر الکترومغناطیسی، در پزشکی برای اسکن ریه، ساخت لامپ فلش دوربین عکاسی، چراغ های جلوی خودرو و تولید لامپ های درخشان با نور سبز مایل به زرد کاربرد دارد.
کاربرد زنون
کاربردهای این گاز در مطالعات رد یابی توده های هوا، فلوئوریتمری، بی حسی، لیزر، لامپ های ماشین و صنایع نیمه هادی است. لامپ های سدیم و جیوه توسط گاز زنون خالص پر می شود این لامپ ها به وفور در فضاهای باز به کار گرفته می شود.
کاربرد رادون
از رادون در پرتوپزشکی و معالجه سرطان استفاده می شود. بیماران آرتروزی در مقابل رادیو اکتیو آب معدنی و رادون قرار می گیرند. حتی در برخی کشورها از در معرض قرار گرفتن این گاز انرژی کسب می کنند. با مطالعه روی تغییرات غلظت رادون می توانند به پیش بینی زمین لرزه بپردازند.
گازهای نجیب در جدول تناوبی
عناصر موجود در گروه ۱۸ دارای اوربیتال های پوسته ظرفیتی به طور کامل پر شده هستند بنابراین، تنها در شرایط خاصی با چند عنصر واکنش نشان می دهند. بنابراین امروزه به عنوان گازهای نجیب شناخته می شوند.
همه این گازها به جز رادون و اوگانسون در جو وجود دارند. فراوانی اتمسفر آنها در هوای خشک ۱% حجمی است که آرگون جزء اصلی آن است. هلیوم و گاهی نئون در مواد معدنی با منشاء رادیواکتیو مانند پیچبلند، مونازیت، کلویت یافت می شوند. منبع اصلی تجاری هلیوم گاز طبیعی است. زنون و رادون نادرترین عناصر این گروه هستند. رادون به عنوان محصول واپاشی عدد اتمیک Ra 226 به دست می آید.
تمام گازهای نجیب تک اتمی هستند. آنها بی رنگ، بی بو و بی مزه هستند. آنها به ندرت در آب حل می شوند. آنها نقطه ذوب و جوش بسیار پایینی دارند زیرا تنها نوع برهمکنش بین اتمی در این عناصر نیروهای پراکندگی ضعیف است. هلیم کمترین نقطه جوش (۴.۲ K) را در بین هر ماده شناخته شده دارد. این خاصیت غیرمعمولی دارد که در اغلب مواد آزمایشگاهی مورد استفاده مانند لاستیک، شیشه یا پلاستیک پخش می شود.
گازهای نجیب که تک اتمی هستند هیچ نیروی بین اتمی جز نیروهای پراکندگی ضعیف ندارند و بنابراین در دماهای بسیار پایین به مایع تبدیل می شوند. از این رو نقطه جوش پایینی دارند. به طور کلی گازهای نجیب کمترین واکنش را دارند. بی اثر بودن آنها در برابر واکنش شیمیایی به دلایل زیر نسبت داده می شود:
(i) گازهای نجیب به جز هلیوم (۱s2) به طور کامل پیکربندی الکترونیکی ns2 np6 را در پوسته ظرفیت خود پر کرده اند.
(۲) آنتالپی یونیزاسیون بالا و آنتالپی افزایش الکترون مثبت بیشتری دارند.
واکنش پذیری گازهای نجیب از زمان کشف آنها گهگاه مورد بررسی قرار گرفته است، اما همه تلاش ها برای وادار کردن آنها به واکنش برای تشکیل ترکیبات، برای چندین سال ناموفق بود. در مارس ۱۹۶۲، نیل بارتلت که در آن زمان در دانشگاه بریتیش کلمبیا بود، واکنش یک گاز نجیب را مشاهده کرد. ابتدا یک ترکیب قرمز رنگ تهیه کرد که به صورت O2 PtF6 فرموله شده است.



















