در شیمی یک ترکیب کووالانسی به عنوان یک ترکیب مولکولی نیز شناخته می شود. در این ترکیبات، اتم ها برای آنکه به آرايش گاز نجيب (آرايش هشتايي) دست یابند، الکترون های لایه ظرفیت را ميان خود به اشتراک مي گذارند. این ترکیبات را می توان به راحتی تشخیص داد، زیرا آنها معمولاً از نافلزات متصل به یکدیگر تشکیل شده اند. در ادامه این مقاله در نشریه جهان شیمی فیزیک درباره ترکیبات کووالانسی توضیح خواهیم داد.
ترکیب کووالانسی
ترکیب کووالانسی چیست ؟ در این ترکیبات، اتم ها براي دست یابی به حالت پایدار خود و رسیدن به آرایش گاز نجیب، الکترون ها را ميان خود به اشتراک مي گذارند. در واقع در این ترکیبات، بین اتم های درگیر در پیوند، پیوند کووالانسی تشکیل می شود. برای آشنایی اجمالی با پیوندهای کووالانسی بخش بعدی رو مطالعه کنید.
اگر به جدول تناوبی دقت کنید، متوجه می شوید که نا فلزات تمایل و توانایی مشابه ای برای جذب الکترون دارند، بنابراین ترکیب کووالانسی در نتیجه پیوند بین دو نافلز ایجاد می شود. این ترکیبات همچنین از مولکول هاي جدا از هم تشکيل شده اند، بنابراین به ترکيبات مولکولي نیز مشهورند.
پیوند کووالانسی
تعریف پیوند کووالانسی چیست؟ پیوند کووالانسی که به نام پیوند اشتراکی نیز مشهور است، یکی از انواع پیوندهای شیمیایی می باشد. در این نوع پیوند، اتم های شرکت کننده در پیوند به جاي گرفتن يا از دست دادن الکترون (پیوند یونی) آنها را ميان خود به اشتراک مي گذارند. در حقیقت اتم ها با به اشتراک گذاشتن الکترون ها، به آرايش هشتایی پایدار گاز نجیب بعد از خودشان دست پیدا می کنند.
این الکترون های به اشتراک گذاشته شده، قبل از تشكيل پيوند كووالانسي، تنها تحت جاذبه هسته اتم خودشان می باشند، اما بعد از تشکیل پیوند، به طور همزمان جاذبه هر دو هسته را احساس مي كنند.
انواع پیوند های کووالانسی
پيوند كووالانسي معمولاً بين اتم هاي نا فلزات تشکیل مي شود. در واقع این نوع پیوند، با اشتراک گذاری الکترون بین اتم های غیر فلزی درگیر در پیوند (به دلیل اختلاف الکترونگاتیوی پایین دو اتم نسبت به یکدیگر)، ایجاد می شود. لایه ظرفیت اتم های غیر فلزی کامل نیست، بنابراین این اتم ها ناپایدارند. این دو اتم با اشتراک گذاشتن الکترون در هنگام تشکیل پیوند کووالانسی، به ساختار پایدار می رسند.
اگر دو اتم نافلزی شرکت کننده در پيوند های كووالانسي دارای مقادیر الکترونگاتیویته یکسان یا مشابه باشند، یک پیوند کووالانسی خالص تشکیل می شود (مانند پیوند تشکیل شده بین دو اتم هیدروژن در مولکول H۲). به این نوع پیوند، پیوند کووالانسی ناقطبی می گوییم.

اما زمانیکه دو اتم نا فلزی متفاوت درگیر پیوند شوند، الکترون های اشتراکی زمان بیشتری را در نزدیکی یکی از اتم های دو سر پیوند می گذرانند و بنابراین یک پیوند کووالانسی قطبی ایجاد می شود (مانند پیوند تشکیل شده بین اتم های هیدروژن و کلر در مولکول HCl).

در بعضی ترکیبات هر دو مدل پیوند های یونی و کووالانسی را همزمان داریم. به عنوان نمونه به مولکول CaCO۳ توجه کنید. در این مولکول، بین اتم فلزی کلسیم و یون منفی چند اتمی کربنات، پیوند یونی تشکیل می شود. اما در بین اتم های کربن و اکسیژن در بخش کربنات (CO۳)، پیوند کووالانسی دارید.
تقسیم بندی پیوند های کووالانسی
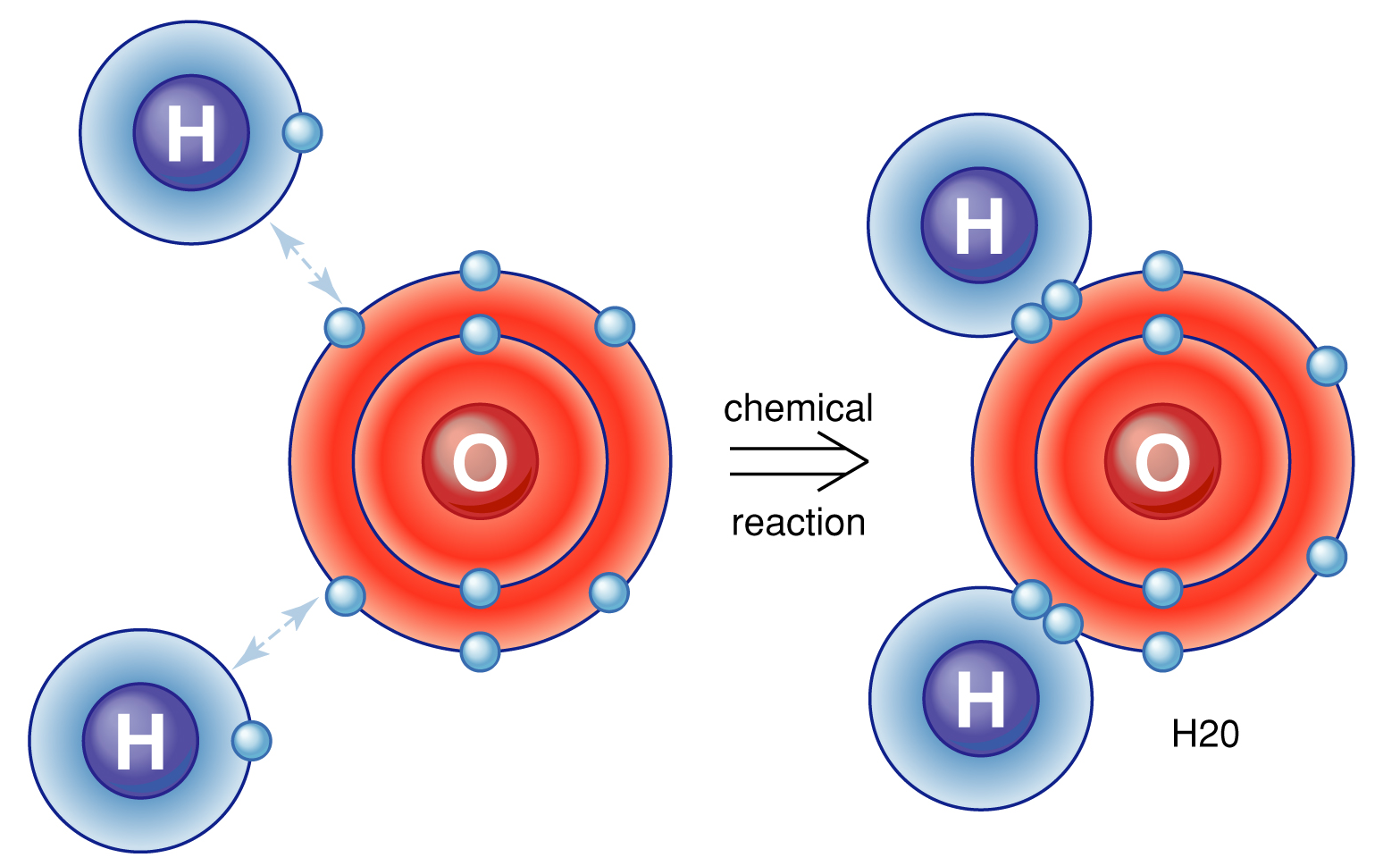
به طور کلی پیوند های کووالانسی به دو دسته پیوند های یگانه و چندگانه تقسیم می شوند. در پیوند کووالانسی یگانه فقط یک جفت الکترون بین اتم ها به اشتراک گذاشته می شود. این پیوند را با یک خط نشان می دهند (مانند پیوند بین اتم های اکسیژن و هیدروژن در مولکول H۲O). اما در بسیاری موارد بیش از دو الکترون بین اتم ها به اشتراک گذاشته می شود. مانند پیوند دوگانه بین اتم های اکسیژن و کربن (C=O) در مولکول CO۲ و یا پیوند سه گانه در مولکول نیتروژن (N۲). در موارد بسیار کمی، پیوند کووالانسی چهارگانه نیز دیده شده است.

خواص و ویژگی های ترکیب کووالانسی
خواص و ویژگی های ترکیبات کووالانسی نسبت به ترکیبات یونی بسیار متفاوت است. دلیل این تفاوت اینست که یک ترکیب یونی زمانی تشکیل می شود که الکترون ها از یک اتم به اتم دیگر منتقل گردند. در طی این انتقال، یون های مثبت و منفی در ترکیب به وجود می آیند. در واقع به دلیل اختلاف زیاد الکترونگاتیوی بین دو اتم، پیوند یونی (پیوند الکترووالانس) ایجاد می شود. بنابراین در ترکیبات یونی، یون ها به وسیله جاذبه الکتریکی قوی در کنار هم نگه داشته شده اند.
اما ترکیبات مولکولی، نتیجه به اشتراک گذاشتن الکترون های لایه ظرفیت دو اتم در پیوند می باشند. در این ترکیبات، به دلیل اختلاف الکترونگاتیویته پایین بین دو اتم درگیر در پیوند، مولکول خنثی است. می دانید که جاذبه بین یون های باردار قوی تر از جاذبه بین مولکول های خنثی می باشد. بنابراین تفاوت اصلی بین این دو دسته ترکیبات به دلیل تفاوت در نیرهای جاذبه بینشان می باشد.
تفاوت های اصلی بین ترکیبات یونی و ترکیبات کووالانسی
۱- از لحاظ پیوند : در ترکیبات یونی پیوند شیمیایی از نوع الکترووالانسی یا یونی است، در حالیکه در ترکیبات کووالانسی، پیوند کووالانسی داریم.
۲- از لحاظ اجزای تشکیل دهنده : ترکیبات یونی از واکنش یک فلز با یک نافلز به وجود می آیند، در حالیکه ترکیب مولکولی معمولا به وسیله واکنش بین دو و یا چند اتم غیر فلزی تشکیل شده است.
۳- از لحاظ اختلاف الکترونگاتیویته: اختلاف الکترونگاتیویته بین دو اتم درگیر در یک پیوند الکترووالانسی زیاد است، در حالیکه در یک ترکیب مولکولی اختلاف الکترونگاتیویته بین اتم ها کم می باشد.
۴- از لحاظ شکل ترکیب در دما و فشار استاندارد : ترکیبات یونی در دما و فشار استاندارد بیشتر به حالت جامد می باشند، در حالیکه ترکیبات مولکولی معمولا به حالت مایع یا گاز اند.
۵- از لحاظ حلالیت : بیشتر ترکیبات یونی در آب انحلال پذیرند، در حالیکه ترکیبات مولکولی در آب نا محلول اند. ترکیبات مولکولی در حلالهای آلی حل می شوند.
۶- از لحاظ هدایت الکتریکی : ترکیبات یونی در حالت مایع، هدایت الکتریکی خوب و مناسبی دارند، در حالیکه یک ترکیب مولکولی در حالت های مختلف هدایت کننده بسیار ضعیفی برای الکترسیته و گرما میباشد.
۷- از لحاظ نقطه ذوب و جوش : به دلیل نیروهای جاذبه قوی بین یون های مثبت و منفی در یک ترکیب یونی، نقاط ذوب و جوش در این ترکیبات نسبت به ترکیبات مولکولی بسیار بالاتر است.
همچنین می توان به این مورد اشاره کرد که، ترکیبات یونی نسبت به ترکیبات مولکولی واکنش پذیرتر میباشند. اما قابلیت اشتعال در ترکیب مولکولی بالاتر است. از طرفی به طور کلی ترکیبات یونی در مقایسه با ترکیبات مولکولی سخت تر می باشند.
نامگذاری ترکیب کووالانسی
براي نامگذاري ترکیبات کووالانسی، از دو روش استفاده می شود. در ادامه مقاله این دو روش نامگذاري را به همراه مثال بررسی می کنیم.
۱- استفاده از پیش وند و پسوند:
در این روش، در ابتدا نام اتم نا فلز با الكترونگاتيوتيه كمتر و سپس نام اتم نا فلز دوم با الكترونگاتيوتيه بيشتر ذكر مي شود. توجه کنید که به آخر نام اتم با الكترونگاتيوتيه بيشتر پسوند يد (ide) اضافه می کنیم. به عنوان مثال نام مولکول NO، نيتروژن اکسيد (Nitrogen oxide) است. اتم نیتروژن الكترونگاتيوتيه كمتری نسبت به اتم اکسیژن دارد.
اگر ترکیب کووالانسی مورد نظر بیش از دو اتم غیر فلز داشت، تعداد اتم هاي هر نافلز در تركيب را با پيشوند های رومی مشخص مي کنیم. پيشوند هاي رایج مربوط به تعداد اتم ها در جدول زير آمده است.
| عدد | پيشوند (Prefix) |
| ۱ | مونو (mono) |
| ۲ | دي (di) |
| ۳ | تري (tri) |
| ۴ | تترا (tetra) |
| ۵ | پنتا (penta) |
| ۶ | هگزا (hexa) |
| ۷ | هپتا (hepta) |
| ۸ | اكتا (octa) |
| ۹ | نونا (nona) |
| ۱۰ | دكا (deca) |
به عنوان نمونه مولکول CCl۴، را كربن تتراکلريد (Carbon tetrachloride) می نامیم.
نکته :
اگر از اتم غیر فلزی با الكترونگاتيوتيه كمتر تنها يك اتم در مولکول باشد، پيشوند مونو نوشته نمي شود. اما استفاده از پيشوند مونو برای اتم غیر فلزی با الكترونگاتيوتيه بالاتر دلخواه است. به عنوان مثال به مولکول CO، كربن مونوكسيد (Carbon monoxide) می گوییم.
۲- استفاده از عدد اکسایش :
در این روش، در ابتدا نام نا فلز اول با عدد اکسایش مربوط به آن (عدد کسایش را با اعداد رومی نشان می دهیم) و سپس نام اتم نا فلز دوم با پسوند يد (ide) ذكر مي شود. به عنوان مثال به مولکول CCl۴، كربن (IV) کلرید می گوییم. توجه کنید که این روش مرسوم نیست، بنابراین توصیه می شود برای نامگذاری ترکیبات کووالانسی از روش اول استفاده کنید.
تعدادی از ترکیبات کووالانسی دارای نام خاص و رایجی می باشند. این ترکیبات معمولا ترکیبات هیدروژن دار غیر فلزات اند. در حقیقت نام مورد استفاده و متداول برای این ترکیبات، از قواعد نامگذاری که در بالا ذکر شد، بدست نمی آید. به عنوان مثال می توان به مولکول های زیر اشاره کرد.
| فرمول | نام معمول |
| H۲O | آب |
| CH۴ | متان |
| NH۳ | آمونیاک |
| BH۳ | بوران |
| B۲H۶ | دی بوران |
| N۲H۴ | هیدرازین |
| H۲O۲ | هیدروژن پراکسید |
لیست ترکیب کووالانسی
به عنوان یک مثال مهم از ترکیبات کووالانسی می توان به هیدروکربن ها اشاره کرد. به طور کلی، تعداد ترکیبات مولکولی در طبیعت بیشتر از تعداد ترکیبات یونی می باشد. در زیر نمونه هایی از ترکیبات کووالانسی آورده شده است.
PCL۳, NO۲, CH۳CH۲OH, O۳, H۲O, HCl, CH۴, NH۳, CO۲, N۲O, NO, P۵O۱۰, PI۳. CCl۴, CO, H۲S, N۲H۴, PCl۵, SF۶, C۶H۱۲O۶, B۲H۶,
پیوند کووالانسی چیست علوم نهم
ترکیبات به عنوان مواد حاوی دو یا چند عنصر شیمیایی مختلف تعریف می شوند. آنها دارای ساختارهای شیمیایی متمایز هستند که با نسبت ثابتی از اتم ها که توسط پیوندهای شیمیایی به هم نگه داشته می شوند، مشخص می شود. پیوندهای کووالانسی با اشتراک الکترون ها بین دو یا چند اتم مشخص می شوند. این پیوندها بیشتر بین نافلزات یا بین دو عنصر یکسان (یا مشابه) رخ میدهند. اتم ها در عوض الکترون ها را به اشتراک می گذارند تا لایه الکترونی ظرفیت آنها پر شود.
پیوند کووالانسی زمانی اتفاق می افتد که الکترون ها بین اتم ها به اشتراک گذاشته شوند. پیوندهای کووالانسی دوگانه و سه گانه زمانی رخ می دهند که چهار یا شش الکترون بین دو اتم به اشتراک گذاشته می شوند و در ساختارهای لوئیس با رسم دو یا سه خط که یک اتم را به اتم دیگر متصل می کنند نشان داده می شوند. توجه به این نکته مهم است که فقط اتم هایی که نیاز به بدست آوردن یا از دست دادن حداقل دو الکترون ظرفیت از طریق اشتراک گذاری دارند می توانند در پیوندهای متعدد شرکت کنند.
پیوندهای کووالانسی بین اتمها کاملاً قوی هستند، اما جاذبههای بین مولکولها/ترکیبات یا نیروهای بین مولکولی میتوانند نسبتاً ضعیف باشند. ترکیبات کووالانسی عموماً نقطه جوش و ذوب پایینی دارند و در هر سه حالت فیزیکی در دمای اتاق یافت می شوند. ترکیبات کووالانسی رسانای الکتریسیته نیستند. این به این دلیل است که ترکیبات کووالانسی دارای ذرات باردار نیستند که قادر به انتقال الکترون باشند.



















