نرمالیته چیست و چگونه محاسبه می شود؟

نرمالیته که به صورت اختصاری با “N” نشان داده می شود برای اندازه گیری غلظت محلول بکار می رود و گاهی اوقات به عنوان غلظت معادل محلول شناخته می شود. نرمالیته عمدتا به عنوان معیار اندازه گیری گونه های واکنش پذیر در محلول و در حین واکنش های تیتراسیون یا به ویژه در شیمی اسید -باز است ، استفاده می شود.
طبق تعریف استاندارد ، نرمالیته به عنوان تعداد گرم یا مول معادل املاح موجود در یک لیتر محلول توصیف می شود. وقتی می گوییم معادل منظور تعداد مول واحدهای واکنش پذیر در یک ترکیب است. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می شود لطفا ما را همراهی کنید.
فرمول نرمالیته چیست؟
برای محاسبه این معیار باید با فرمول های آن آشنا شوید که در ادامه آمده است:
حجم محلول (لیتر) / تعداد گرم اکی والان =N
وزن اکی والان محلول / وزن حل شونده = تعداد گرم اکی والان
(حجم (لیتر) × وزن اکیوالان) / وزن حل شونده (گرم) = N
جرم اکیوالان/ (جرم مولی × مولاریته) = N
قدرت اسیدی × مولاریته = قدرت بازی × مولاریته =N
علاوه بر موارد فوق یک فرمول کلی وجود دارد که N را به صورت غلظت مولی (مولاریته) تقسیم بر ضریب اکی والان (feq) تعریف می کند.
N=ci/feq
نرمالیته چگونه محاسبه می شود؟
نکات خاصی وجود دارد که برای محاسبه N باید آنها را یاد بگیرید. اولین نکته جمع آوری اطلاعات در مورد وزن معادل یا اکی والان ماده واکنش دهنده یا املاح است. برای کسب اطلاعات در مورد وزن مولکولی و ظرفیت به دنبال کتاب درسی یا کتاب های مرجع باشید.
مرحله دوم یادگیری محاسبه اکی والان محلول است. باید به یاد داشته باشید که حجم بر حسب لیتر محاسبه می شود. سرانجام ، نرمالیته با استفاده از فرمول و جایگزینی مقادیر محاسبه می شود.
کاربردهای نرمالیته
نرمالیته بیشتر در سه حالت زیر استفاده می شود:
در تعیین غلظت ها در شیمی اسید- باز برای نشان دادن غلظت یون هیدرونیوم (H3O +) یا یون هیدروکسید (OH–) در یک محلول
در واکنش های رسوبی برای اندازه گیری تعداد یونهایی که احتمالاً در یک واکنش خاص رسوب می کنند
در واکنش های اکسیداسیون – احیا برای تعیین تعداد الکترون هایی که یک عامل احیا کننده یا اکسید کننده می تواند اهدا یا قبول کند.
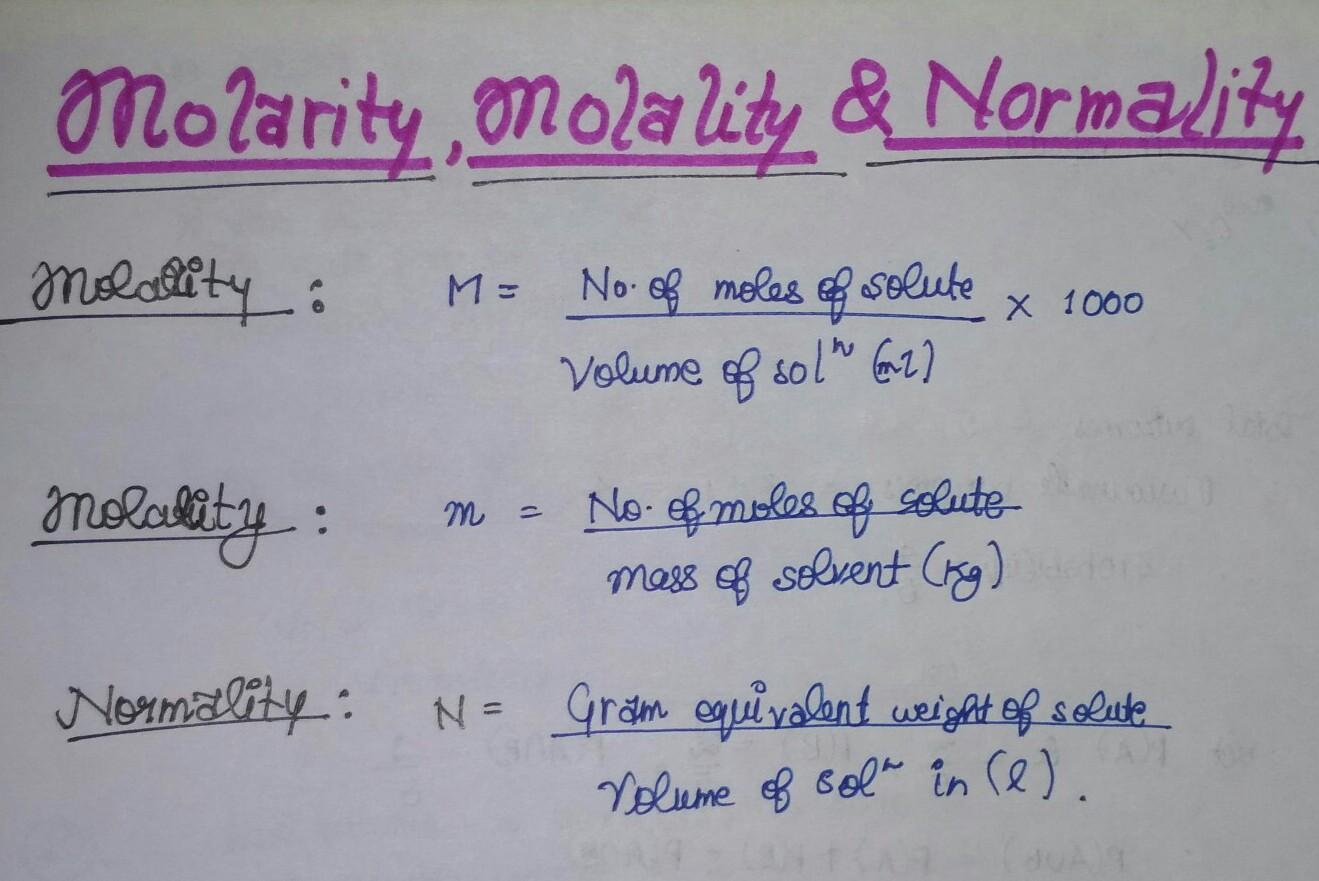
رابطه بین نرمالیته و مولاریته
نرمالیته و مولاریته دو اصطلاح مهم و رایج در شیمی هستند و برای نشان دادن سنجش کمی یک محلول استفاده می شوند. اما مولاریته چه نسبتی با نرمالیته دارد و فرق نرمالیته و مولاریته چیست؟ ما رابطه بین این دو را در ادامه درک خواهیم کرد.
مولاریته مانند N یک واحد غلظت در شیمی است. مولاریته به عنوان تعداد مول در هر لیتر محلول تعریف می شود. همچنین به عنوان غلظت مولی نیز شناخته می شود. از مولاریته اغلب در محاسبه PH ، ثابت های تفکیک یا تعادل و غیره استفاده می شود. فرمول مولاریته به شرح زیر است:
حجم محلول (لیتر) × تعداد مول حل شونده = مولاریته (M)
حال اگر در مورد رابطه این دو اصطلاح صحبت کنیم باید بگوییم تعریف نرمالیته شامل مولاریته هم هست. در حالی که مولاریته اولین گام در محاسبه حجم کل یا غلظت محلول هاست ، از نرمالیته برای محاسبات پیشرفته تر عمدتا در ایجاد رابطه یک به یک بین اسیدها و بازها استفاده می شود:
(جرم اکیوالان) / (جرم مولی × مولاریته) = N
با این حال ، در این مورد ، ما باید ابتدا قدرت بازی را محاسبه کنیم. مثلا می توان تعداد یونهای H + که یک مولکول اسید می تواند اهدا کند را محاسبه کرد . برای این منظور می توان از فرمول زیر استفاده کرد:
قدرت بازی × مولاریته =N
با شمارش تعداد یون های OH منفی یک مولکول باز هم می توان اسیدیته را تعیین کرد. برای محاسبه نرمالیته اسیدها می توان از فرمول زیر استفاده کرد:
قدرت اسیدی × مولاریته = N
همچنین می توانیم با استفاده از معادله زیر ، مولاریته را به نرمالیته تبدیل کنیم.
تعداد اکی والان× N=M
روش محاسبه نرمالیته در تیتراسیون
تیتراسیون فرآیند افزودن تدریجی یک محلول با غلظت و حجم مشخص به محلول دیگری با غلظت ناشناخته است تا زمانی که واکنش به وضعیت خنثی نزدیک شود. برای یافتن N تیتراسیون اسید و باز از فرمول زیر استفاده کنید.
N1 V1 = N2 V2
N1 = نرمالیته محلول اسیدی
V1 =حجم محلول اسیدی
N2 = نرمالیته محلول بازی
V2 = حجم محلول بازی
محدودیت ها در استفاده از نرمالیته
بسیاری از شیمیدانان برای عدم استفاده از نسبت مولی و دستیابی به نتایج دقیق تر از نرمالیته در شیمی اسید- باز استفاده می کنند. در حالی که این معیار معمولاً در واکنش های رسوبی و اکسیداسیون استفاده می شود ولی محدودیت هایی برای آن وجود دارد که عبارتند از:
در شرایطی به جزء موارد فوق N واحد مناسبی برای تعیین غلظت نیست. N یک معیار مبهم است و مولاریته یا مولالیته گزینه های بهتری هستند.
برای محاسبه دقیق N باید ضریب اکی والان را بطور دقیق را بدست بیاوریم.
نرمالیته برای یک محلول شیمیایی خاص مقدار مشخصی ندارد و مقدار آن بسته به نوع واکنش شیمیایی می تواند به طور قابل توجهی تغییر کند. به عنوان مثال یک محلول می تواند برای واکنش های مختلف نرمالیته متفاوتی داشته باشد.
چگونه می توان نرمالیته را از طریق مولاریته محاسبه کرد؟
نسبت مولی اسید یا باز با تعیین تعداد یونهای H + یا OH- به ازاء هر مولکول محاسبه می شود:
N = n × M
برای محلول اسیدی n تعداد یونهای H + است که توسط فرمول اسید مشخص می شود. برای یک محلول بازی n تعداد یون های OH- است که توسط فرمول باز مشخص می شود. مثال: محلول A 1 M Ca(OH)2 همان محلول N2 Ca (OH) 2 است.
شما با یادگیری فرمول های فوق می توانید نرمالیته پتاسیم پرمنگنات ، نرمالیته اسید استیک، نرمالیته nacl و هر ماده دیگری را به راحتی محاسبه کنید.
توجه: نرمالیته یک محلول هرگز کمتر از مولاریته آن نیست!
تفاوت نرمالیته و مولاریته
مولاریته و نرمال دو غلظت مهم و رایج در شیمی هستند که با استفاده از دو روش مختلف اندازه گیری می شوند. هر دو اصطلاح برای نشان دادن اندازه گیری کمی یک ماده استفاده می شود. اگر می خواهید تعداد یون های مس را در یک محلول تعیین کنید، می توان آن را به عنوان اندازه گیری غلظت در نظر گرفت. مولاریته و نرمالیته انواع اندازه گیری غلظت هستند.
مولاریته متداول ترین روش تغلیظ است. به عنوان تعداد مول های محلول حل شده در هر لیتر محلول بیان می شود. بنابراین، واحد مولاریته mol/L است. مولاریته به عنوان غلظت مولی نیز شناخته می شود و با “M” نشان داده می شود. به عنوان مثال، محلول ۱M کلرید سدیم محلول در آب دارای مولاریته ۱M است.
با تقسیم جرم بر وزن مولکولی املاح می توان تعدادی مول از املاح را محاسبه کرد. به عنوان مثال، اگر می خواهید یک مولار محلول سولفات پتاسیم تهیه کنید، ۱۷۴.۲۶ گرم مول در ۱ (۱M) سولفات پتاسیم باید در یک لیتر آب حل شود.
نرمالیته معیاری از غلظت است که برابر با گرم وزن معادل املاح در هر لیتر محلول است. وزن معادل گرم اندازه گیری ظرفیت واکنشی یک مولکول است. واحد نرمال معادله / L است. “N” نمادی است که برای نشان دادن عادی بودن استفاده می شود.
به عنوان مثال، ۱M کلرید هیدروژن ۱M یون هیدروژن و ۱M یون کلرید به محلول می دهد. ۱M یون هیدروژن برابر با یک معادل یون هیدروژن است. بنابراین، ۱M HCl همان ۱N HCl است، اما وقتی اسید سولفوریک می گیریم، ۱M اسید سولفوریک، ۲M یون هیدروژن به محلول می دهد. بنابراین، نرمالیته یون های هیدروژن برای محلول اسید سولفوریک ۲N خواهد بود.



















