هیدروژن چیست علوم هشتم

هیدروژن عنصری بی رنگ و بدون بو است که فراوان ترین عنصر روی کره زمین است. این عنصر با عدد اتمی یک، به عنوان اولین و سبک ترین عنصر جدول تناوبی است. هیدروژن در حالت عادی به صورت گاز بوده و اتم آن یک پروتون و یک الکترون داشته و نوترون ندارد. هیدروژن عنصری است که در بیشتر مواد مانند آب، چربی ها، نفت خام، اسیدهای چرب، شکر، آمونیاک، هیدروژن پراکسید و هیدروکربن ها وجود دارد. در این مقاله نشریه جهان شیمی فیزیک با خواص و کاربردهای عنصر هیدروژن آشنا می شوید.
خواص هیدروژن
هیدروژن حدود ۰,۱۴ از وزن پوسته زمین را تشکیل داده و به شکل گازی بی مزه و بدون رنگ است. این عنصر دارای خاصیت آتش زایی بوده و چگالی آن کمتر از هوا است. نقاط ذوب و جوش این عنصر به ترتیب ۹۹ و ۲۹۲,۹- درجه سانتی گراد است. عنصر مذکور دارای آرایش الکترونی مشابه با فلزات قلیایی بوده و در جدول تناوبی در این گروه قرار می گیرد. اما از لحاظ خواص، با عناصر دیگر متفاوت است. H یک نافلز بوده و مانند هالوژن ها، مولکول های دو اتمی تشکیل می دهد.
از نظر خواص واکنش پذیری، این عنصر می تواند با اکسیژن ترکیب شده و مولکول آب تولید کند. به طور کلی هیدروژن می تواند با عناصر بسیاری در جدول تناوبی وارد واکنش شده و ترکیبات متنوعی با خواص جدید را تشکیل دهد.
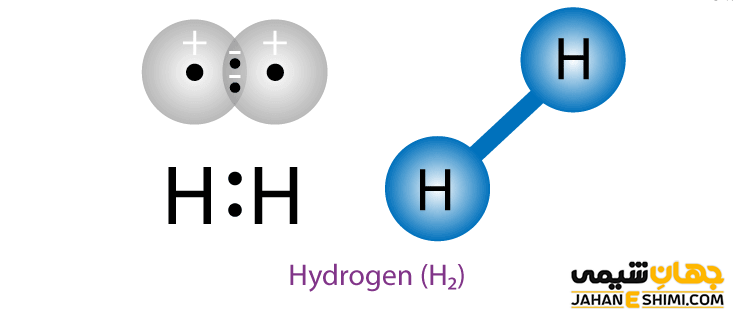
مواد به صورت سه دسته می توانند با هیدروژن ترکیب شوند. فلزات فعالی چون فلزات قلیایی خاکی و فلزات قلیایی به H الکترون داده و تولید هیدریدهای یونی می دهد.
نافلزاتی مانند اکسیژن و هالوژن ها با H، پیوندهای کووالانسی تشکیل می دهد.
H با فلزات واسطه، تولید هیدریدهای فلزی با ساختار بلوری می دهد.
ایزوتوپ های هیدروژن و منابع تولید آن
سه ایزوتوپ طبیعی از هیدروژن به صورت۱H ، ۲H و ۳H وجود دارد. ۱H و ۲H پایدار بوده ولی ۳H عنصری ناپایدار با نیمه عمری برابر با ۱۲,۳۲ سال است. ایزوتوپ های سنگین دیگری از این عنصر به صورت مصنوعی ساخته می شود. ۴H، ۵H و ۷H ایزوتوپ های سنگین تر هستند که ایزوتوپ ۴ ناپایدار بوده و ایزوتوپ ۷، بالاترین ثبات را دارد.
از جمله روش هایی که به تولید این ماده منجر می شود، الکترولیز آب، مکان تولید گاز طبیعی، برقکافت محلول سدیم کلرید، بازیافت پالایشگاه های نفت، فرایند کلرآلکالی و بازیافت گاز کوره کک در صنایع فولاد است.
مزایای هیدروژن
از هیدروژن مایع به طور عمده در صنایعی که به فضا مربوط هستند، استفاده می شود. به عنوان مثال در سوخت موشک ها در ترکیب با اکسیژن و فلوئور، به کار برده می شود.
اما H۲ بیشتر به صورت گازی به کار گرفته می شود. در هیدروکربن ها از این گاز برای گوگردزدایی استفاده می شود که منجر به تولید سوخت های بدون گوگرد می شود. در سوخت های فسیلی مانند نفت خام و زغال سنگ، وجود گوگرد باعث تولید گازهای آلاینده ای چون تری اکسید گوگرد می شود. ورود این گازها با هوا علاوه بر ایجاد مشکلات تنفسی، منجر به تشکیل باران های اسیدی نیز می شود.
از سبک ترین عنصر جدول تناوبی در پزشکی به عنوان یک عامل مهم فیزیولوژیکی در سلول ها و اندام ها به کار گرفته می شود. زیرا این عنصر در این بافت ها ایجاد خاصیت ضدالتهابی، آنتی اکسیدانی و ضد آپوپتوزی می کند. استنشاق، نوشیدن هیدروژن محلول در آب و یا تزریق، روش های مختلف هیدروژن درمانی است.
در صنعت از H۲ به طور عمده استفاده می شود. به عنوان مثال در صنعت الکترونیک و ساخت قطعات الکترونیکی، به عنوان انتقال دهنده گازهای فعال به کار برده می شود.
یکی از کاربردهای مهم آن در صنعت آمونیاک سازی است که در نتیجه ترکیب با نیتروژن اتفاق می افتد. آمونیاک ترکیبی بسیار مهم در تولید کود است.
عنصر مورد بحث برای تولید نایلون، فروم پلر اورتان، انواع مختلف پلاستیک ها، ساخت شیشه های تخت برای صفحات نمایشگر (در این صنعت از درصد بالای خلوص این ماده استفاده می شود) و … به کار برده می شود.



















