آسیلاسیون چیست؟ – ویژگی و مکانیسم انجام آسیلاسیون

آسلاسیون فریدل کرافتس یکی از واکنش های شیمیایی و از دسته ی واکنش های جانشینی الکتروفیلی است. در این واکنش جانشینی الکترون دوستی، در یک ترکیب آروماتیک به جای یکی از اتم های هیدروژن متصل به حلقه آرماتیک، یک گروه الکتروفیل قرار می گیرد. این واکنش در حضور کاتالیزور انجام می گیرد و معمول ترین کاتالیزور مورد استفاده، آلومینیوم تری کلرید (AlCl۳) است. با مطالعه این مقاله نشریه جهان شیمی فیزیک به معرفی و چگونگی انجام واکنش آسیلاسیون پرداخته می شود.
گروه آسیل چیست؟
گروه آسیل که به صورت R-(C=0)-CH۳ نشان داده می شود، با حذف یک یا چند گروه هیدروکسیل از یک اکسی اسید و یا اسید غیرآلی به دست می آید. در فرمولی که برای گروه آسیل بیان شد، R یک گروه آلکیل بوده که با یک پیوند به گروه کربونیل متصل می شود. گروه عاملی آسیل، به طور معمول از یک کربوکسیلیک اسید به دست می آید و یا از اسیدهایی چون اسید سولفونیک و اسید فسفونیک، حاصل می شود. در اکثر اوقات، اتصال گروه های آسیل به مولکول بزرگتری صورت می گیرد که بین اتم های اکسیژن و کربن آن، پیوند دوگانه برقرار باشد.
از جمله مهمترین ترکیبات آسیل ها، کلریدهای آسیل هستند. نمونه هایی از این ترکیبات، استیل کلرید و بنزوئیل کلرید هستند. از این ترکیبات به عنوان مهمترین واکنش دهنده ها استفاده می شود تا گروه آسیل را به مواد دیگر متصل کنند. از ترکیبات دیگر این گروه عاملی می توان به آمیدها، استرها، کتون ها و آلدهیدها اشاره داشت.
واکنش های فریدل – کرافتس
از معروف ترین واکنش های جانشینی الکتروفیلی، واکنش فریدل – کرافتس است. در این واکنش ها، به جای یکی از اتم های هیدروژن در حلقه آروماتیک، یک گروه آلکیل و یا یک گروه آسیل می نشیند. گروه آلکیل و یا آسیل به عنوان الکتروفیل بوده و بر این اساس، واکنش های فریدل – کرافتس را به دو نوع آلکیلاسیون و آسیلاسیون تقسیم بندی می کنند. کشف این واکنش برای اولین بار در سال ۱۸۷۷ میلادی توسط دو دانشمند به نام های شارل فریدل و جیمز کرافتس، صورت گرفت. در این مقاله ابتدا آسیلاسیون فریدل – کرافتس و سپس آلیکلاسیون مورد بررسی قرار می گیرد. بعد از آن توضیحاتی درباره چگونگی انجام واکنش های جانشینی الکتروفیلی آروماتیک داده می شود.
آسیلاسیون فریدل – کرافتس
در این نوع واکنش، با استفاده از یک اسید کلرید و یک اسید لوئیس مانند آلومینیوم کلرید، یک گروه آسیل جانشین یک اتم هیدروژن در حلقه آروماتیک می شود. محصول واکنش، کتون از حلقه آروماتیک است. در آسیلاسیون می توان به جای آسیل هالید از یک انیدرید استفاده کرد. هالوژنی که در ساختار آسیل هالید وجود دارد، به اسید لوئیس متصل شده و تشکیل یک کمپلکس می دهد. در نتیجه، الکتروفیلی به نام آسیلیوم تشکیل می شود که فرمول آن به صورت RCO+ است. پایداری الکتروفیل حاصل از طریق رزنانس برقرار می شود.
مکانیسم انجام واکنش آسیلاسیون فریدل – کرافتس
واکنش مورد بحث در این مقاله، طی مکانیسمی چهار مرحله ای انجام می شود. در مرحله اول این واکنش، همان طور که در بالا گفته شد، از اتصال هالوژن به اسید لوئیس، یون آسیلیوم تشکیل می شود که بعد با بنزن وارد واکنش می شود.
در مرحله دوم، یون آسیلیوم که نقش الکتروفیل را بازی می کند، به حلقه آروماتیکی حمله کرده و کمپلکس جدیدی تشکیل می دهد.
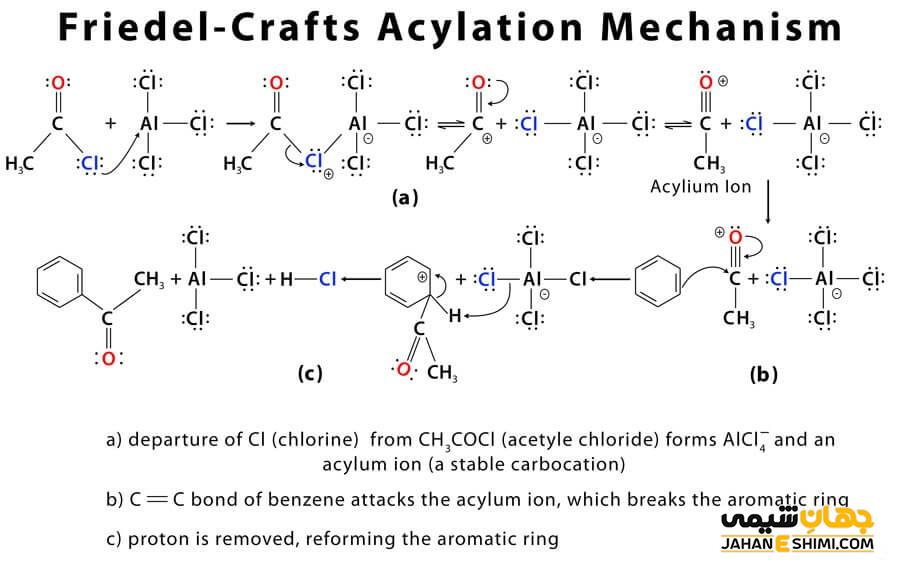
سپس در مرحله بعدی، یک پروتون از کمپلکس تشکیل شده جداشده، خاصیت آروماتیک در حلقه آروماتیکی برمی گردد. بعد AlCl۴، باعث حذف یک پروتون از حلقه آروماتیکی شده و باعث می شود که حلقه، خاصیت آروماتیسیته پیدا کند. کاتالیزور مورد استفاده در طی این واکنش تولید و می تواند دوباره مورد استفاده قرار گیرد. کتون به عنوان محصول نهایی واکنش، در این مرحله تولید می شود.
در مرحله آخر، محصول اصلی و نهایی که یک آسیل بنزن است با اضافه کردن آب، تولید می شود.
محدودیت های آسیل دار کردن
یکی از محدودیت های این واکنش، تولید کتون به عنوان تنها محصول اصلی آن است، زیرا فرمیل کلرید با قرار گرفتن در شرایط واکنش، به مونوکسید کربن و اسید کلریدریک تجزیه و شکسته می شود. از محدودیت های دیگر این واکنش، عدم شرکت در واکنش توسط ترکیب آروماتیکی، در صورت کمتر بودن میزان واکنش پذیری آن نسبت به مونو هالو بنزن است. آریل آمین ها به دلیل تشکیل کمپلکس هایی با میزان واکنش پذیری کم با کاتالیزور اسید لوئیس، در این واکنش ها استفاده نمی شوند. با استفاده از آمین یا الکل، آسیلاسیون در اتم های نیتروژن و یا اکسیژن صورت می گیرد.
آلکیلاسیون فریدل – کرافتس
اگر به جای گروه آسیل، گروه آلکیل به جای یکی از اتم های هیدروژن در حلقه آروماتیکی قرار گیرد، واکنش، آلکیلاسیون فریدل کرافتس خوانده می شود. این واکنش نیز یک واکنش جانشینی الکتروفیلی بوده و با حمله الکتروفیل به حلقه با کمک یک کربوکاتیون صورت می گیرد. در این واکنش ها، از آلکیل هالیدها به عنوان واکنش دهنده استفاده شده و آلکیل بنزن، محصول واکنش خواهد بود. کربوکاتیون به عنوان حدواسط با استفاده از یک کاتالیزور اسید لوئیس مانند آلومینیوم کلرید و آهن (III) کلرید، تشکیل می شود. کربوکاتیون تولید شده، باعث حذف راحت هالوژن می شود.
مکانیسم آلکیلاسیون فریدل – کرافتس
انجام واکنش آلکیلاسیون، سه مرحله ای است که در مرحله اول، کربوکاتیون الکتروفیل در نتیجه ی واکنش اسید لوئیس با آلکیل هالید، تشکیل می شود. در مرحله بعدی، کربوکاتیون به حلقه آروماتیکی حمله کرده، تشکیل ماده واسطه کاتیون سیکلوهگزادینیل می کند. با شکسته شدن پیوند دوگانه، خاصیت آروماتیسیته از بین می رود. در مرحله بعد، وقتی پروتون از این ماده واسط، جدا می شود، دوباره پیوند دوگانه کربن- کربن تشکیل شده و حلقه، خاصیت آروماتیکی خود را به دست می آورد. در نهایت، همین پروتون، باعث تشکیل دوباره اسید کلریدریک و اسید لوئیس می شود.
محدودیت های آلکیلاسیون فریدل – کرافتس
اگر آلکیله شدن با اضافه کردن زنجیر کربنی با بیش از دو اتم کربن صورت گیرد، می توان احتمال نوآرایی داد. زیرا با جابجایی هیدرید و یا متیل، امکان بازآرایی وجود دارد. با استفاده از واکنش آسیلاسیون، می توان به حل این مشکل کمک کرد.
از محدودیت های دیگر این واکنش، عدم غیرفعال شدن حلقه افزوده شده به گروه استخلافی است. به عنوان مثال، با استفاده از ترکیبات غیرفعال کننده ای چون نیتروبنزن، انجام واکنش اتفاق نمی افتد. در این صورت با عدم پیشرفت واکنش فریدل کرافتس مواجه شده و گروه هایی چون NH۲، NHR و NR۲ روی حلقه آروماتیک قرار می گیرد. واکنش جفت الکترون غیرپیوندی آمین ها با اسید لوئیس آلومینیوم کلرید صورت گرفته و با قرار گرفتن بار مثبت کنار حلقه بنزنی، واکنش فریدل کرافتس انجام نمی شود.
یکی دیگر از مجدودیت های این واکنش، احتمال پلی آلکیلاسیون است. در این صورت، بیشتر از یک گروه آلکیل الکترون دهنده روی حلقه قرار می گیرد. برای رفع این محدودیت، از افزودن مقدار اضافی ترکیب آروماتیکی استفاده می شود.
شناسایی هیدروکربن های آروماتیک با استفاده از تست فریدل – کرافتس
برای تست ترکیبات آروماتیک از واکنش کلروفرم با این ترکیبات استفاده می شود که کاتالیزور آلومینیوم کلرید به کار برده می شود. محصول واکنش، تری آریل متان ها خواهد بود که با رنگ روشن خود، نشان دهنده آروماتیسته بودن این ترکیبات هستند.
واکنش های آلی
هیدروکربن ها که کربن به عنوان عنصر اصلی تشکیل دهنده آن هاست، در واکنش های آلی شرکت می کنند. چهار ظرفیتی بودن اتم کربن، از دلایل عمده گستردگی واکنش های آلی است که هیدروکربن ها در آن شرکت می کنند. هر ترکیب آلی با توجه به نوع گروه عاملی خود در یک واکنش شرکت می کند. چند دسته از واکنش های آلی وجود دارد که مهمترین آن ها، واکنش های افزایشی، جانشینی و حذفی است.
واکنش افزایشی
نمونه ای از واکنش های افزایشی ترکیبات آلی، هیدراسیون یا آبپوشی یون ها و هیدرو هالوژن دار کردن است. این واکنش ها به انواع افزایشی الکترون دوستی، هسته دوستی و رادیکالی تقسیم بندی می شوند. در واکنش های افزایشی، دو یا چند مولکول ساده با هم ترکیب شده و محصول، مولکول بزرگتری خواهد بود. به عنوان مثال در هالوژن دار کردن، یک یا چند اتم هالوژن به یک ساختار شیمیایی افزوده می شود. در واکنش هیدراسیون، اضافه شدن یک گروه هیدروکسیل و یک یون مثبت، به دو انم کربن اتفاق می افتد.
درتعریف الکترون دوست می توان گفت که گونه ای با بار مثبت است که میل به گرفتن الکترون دارد تا خنثی شدن آن صورت بگیرد. اما هسته دوست با نوکلئوفیل، گونه ای شیمیایی است که تمایل به دادن زوج الکترون به یک الکترون دوست برای تشکیل یک پیوند شیمیایی دارد.
واکنش حذفی
حذف دو جانشین در یک فرایند یک یا دو مرحله ای از یک مولکول، به نام واکنش حذفی خوانده می شود.
واکنش جانشینی
به واکنشی که در آن جابجایی یک عامل هسته دوست با یک گروه ترک کننده مانند هالید از روی حلقه اتفاق می افتد. چندین نوع واکنش جانشینی وجود دارد. در واکنش جانشینی هسته دوستی آروماتیکی، یک عامل هسته دوست به جای یک گروه ترک کننده ای مانند هالید روی یک حلقه آروماتیک، می نشیند.
در جانشینی رادیکالی، واسطه های شرکت کننده در یک واکنش جابجایی، رادیکال ها هستند.
واکنش مورد بحث در این مقاله، واکنش جانشینی الکترون دوستی آروماتیکی است. در این نوع واکنش، به جای یکی از اتم های هیدروژن در حلقه آروماتیک، یک الکترون دوست می نشیند.
مکانیسم واکنش جانشینی الکتروفیلی آروماتیکی
در مکانیسم دو مرحله ای این واکنش، ابتدا گروه الکتروفیل (E+) به اتم کرن در حلقه بنزن اضافه می شود. حذف یک پروتون برای بازگشت آروماتیسیته حلقه بنزنی، توسط کربوکاتیون صورت می گیرد.
در مرحله اول این مکانیسم، تغییر هیبریداسیون اتم کربن از sp۲ به sp۳ صورت گرفته و مسطح بودن سیستم آروماتیک با از بین رفتن حالت آروماتیسیته، از بین می رود. با توجه به تشکیل کربوکاتیون ناپایدار در این مرحله، نامطلوب بودن این مرحله از مکانیسم از نظر انرژی، مشاهده می شود. پایدار شدن کربوکاتیون توسط رزونانس بار مثبت بین سه اتم کربن حلقه بنزن، صورت می گیرد.
در مرحله دوم مکانیسم، با حذف پروتون، هیبریداسیون اتم کربن به sp۲ رسیده و دوباره سیستم آروماتیکی و مسطح می شود. از لحاظ انرژی، این مرحله مطلوب بوده و این مرحله را به عنوان پیش برنده واکنش محسوب می کنند. محصول واکنش جانشینی الکتروفیلی، یک بنزن استخلاف شده است. واکنش آسیلاسیون فریدل – کرافتس، همان طور که در بالا توضیح داده شد، با این مکانیسم انجام می شود.
انجام آزمایش واکنش فریدل – کرافتس
هدف از انجام این آزمایش، انجام یک واکنش جانشینی الکتروفیلی با تولوئن و تهیه ی یک آلکیل هالید است. برای انجام این آزمایش به ابزار آزمایشگاهی چون لوله آزمایش، چراغ بونزن، گیره لوله آزمایش، پیپت، پیست، و مواد آلومینیوم کلرید به عنوان کاتالیزور، تولوئن و کلروفرم نیاز است.
برای انجام آزمایش، ابتدا با کمک یک اسپاتول، آلومینیوم کلرید را داخل لوله آزمایش می ریزیم. سپس با استفاده از یک گیره، لوله آزمایش را روی شعله به صورت ملایم می گیریم. در این حالت، داخل لوله، بخار تشکیل می شود. بعد از این که بخار تشکیل شده، دو سوم از لوله آزمایش را گرفت، ۳ قطره تولون به آن اضافه می کنیم. سپس سه قطره کلروفرم نیز به محتویات داخل لوله آزمایش، اضافه می کنیم. بعد از تکان دادن لوله، واکنش انجام شده و رنگ زرد مشاهده می شود.
در این واکنش، ابتدا الکتروفیل را تشکیل داده و سپس واکنش ان با ترکیبی غنی از الکترون مانند بنزن یا مشتقات بنزن صورت می گیرد. ترکیبات بنزن به دلیل پایدار بودن نسبت به آلکن ها، میلی به انجام واکنش های افزایشی ندارند. در نتیجه در واکنش های جانشینی الکتروفیلی شرکت می کنند. تولوئن به عنوان مشتق بنزنی مورد استفاده در این ازمایش است که متیل به عنوان الکتروفیل به آن متصل می شود. با قرار گرفتن گروه متیل روی حلقه بنزنی، این گروه هدایت کننده ارتو و پارا خواهد بود.



















