واکنش احیا در شیمی را بشناسید

واکنش های اکسیداسیون احیا یکی از واکنش های بسیار مهم در شیمی بشمار می آیند. واکنشهای احیا در صنعت بسیار پرکاربرد بوده و از این رو پرداختن به نحوه انجام آن ها بسیار حائز اهمیت است. واکنش احیا به واکنشی گفته می شود که طی آن یک اتم یا یون یک یا چند الکترون به دست خواهد آورد. برای انجام واکنش احیا به عوامل کاهنده یا احیا کننده نیاز است. در ادامه این مطلب از جهان شیمی فیزیک به بررسی واکنش های احیا و عوامل موثر بر آن می پردازیم. با ما همراه باشید تا بیشتر با این واکنش ه آشنا شوید. واکنشهای احتراق نمونه ای از واکنش های احیا اکسیداسیون یا ردوکس محسوب می شوند. واکنش های احیا اکسیداسیون بسیار مهم هستند، زیرا واکنش های ردوکس منابع اصلی انرژی طبیعی یا بیولوژیکی و مصنوعی در زمین محسوب می شوند.
واکنش احیا چیست
واكنش احیا اكسیداسیون یا Redox واكنشی شیمیایی است که در آن سطح اكسیداسیون مواد تغییر خواهد نمود. وقتی اتمی الكترون از دست می دھد، در اصطلاح اكسیده گشته وعدد اكسیداسیون آن افزایش خواهد یافت. اتم یا مولكولی که الكترون دریافت می كند نیز احیا شده و عدد اكسیداسیون در آن كاھش خواهد یافت. بنابراین واکنش های اکسایش و احیا انواعی از واکنش های شیمیایی هستند که حالت اکسید شدن اتم در آن ها تغییر می یابد. در واکنشهای احیا و اکسیداسیون درواقع یک تبادل الکترون بین واکنش دهندهها رخ خواهد داد. فرآیندهای احیا و اکسایش به طور همزمان رخ داده و مستقل از هم نیستند. بنابراین اکسیداسیون به تنهایی و واکنش احیا نیز به تنهایی نعنا نداشته و تنها به عنوان یک نیم واکنش در نظر گرفته می شوند.
دو نیم واکنش اشاره شده، همیشه با هم رخ داده تا یک واکنش کامل تشکیل گردد. در ادامه به مثال هایی از واکنش ردوکس اشاره شده است.
- در واکنش سوختن چوب، اكسیژن با دریافت الكترون از كربن احیا و كربن، اكسید می شود.
- اکسایش كربن با اكسیژن و تشكیل گاز CO۲
- واکنش احیا كربن توسط ھیدروژن و تشكیل گاز متان CH۴ که قابلیت جذب اكسیژن، سوختن و اشتعال دارد.
- سوختن قندھا در بدن نیز نوعی واكنش ردوکس بوده و منجر به تولید انرژی و گرما می گردد.
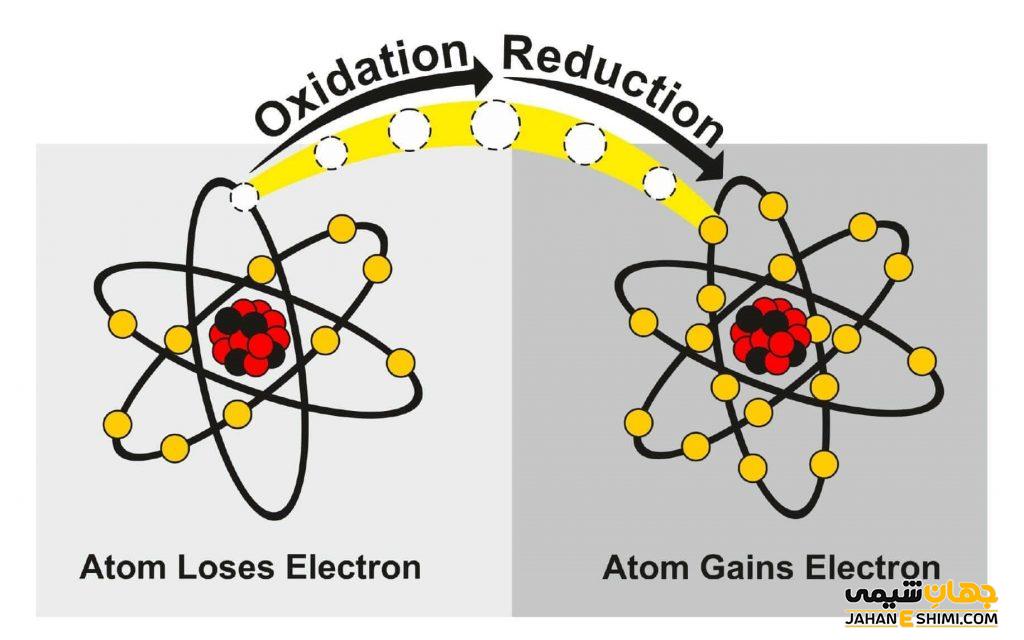
چند واکنش احیا اکسایش
تولید آهن مذاب
آهن از گذشته تا حال بیشترین کاربرد را در میان فلزات برای انسان داشته است. این فلز به طور عمده توسط حرارت دادن هماتیت در حضور کربن و به کمک کوره هایBlast Furnace تولید می شود. این فرآیند را می توان در واکنش زیر به صورت خلاصه نشان داد.
Fe۲O۳ (s) + 3CO (g) ⟶ ۲Fe (l) + 3CO۲ (g)
در واکنش فوق گاز مونو اکسید کربن، اکسیژن را از هماتیت گرفته و دی اکسید کربن و آهن تولید می گردد. واکنشی را که در آن یک ماده اکسیژن جذب کند، واکنش اکسایش می نامند. واکنشی را هم که در آن مادهای اکسیژن از دست بدهد را واکنش احیا مینامند. برطبق این تعریف در واکنش فوق مونواکسید کربن اکسایش و هماتیت کاهش یافته است. توجه نمایید که اکسایش و کاهش همواره همزمان اتفاق افتاده و چنین واکنشهایی را واکنش اکسایش کاهش یا ردوکس می نامند.
البته اکسیژن موجود در هماتیت را به کمک شعله ور ساختن مخلوط خرد شده هماتیت و آلومینیوم نیز می توان حذف نمود. واکنش به صورت انفجاری رخ داده و گرمای زیادی آزاد خواهد شد. این گرما موجب ذوب شدن آهن می گردد. برای تولید آهن مذاب و استفاده در جوشکاری ریل های راه آهن از این نوع واکنش بهره می برند.
واکنش اکسایش و کاهش آب
به فرآیند تجزیه آب از طریق عبور یک جریان الکتریکی به گازهای هیدروژن و اکسیژن الکترولیز آب می گویند. در آب خالص، در بخش کاتد با بار منفی واکنش احیا رخ می دهد. طی این نیم واکنش، الکترون کاتد به کاتیون هیدروژن داده شده و گاز هیدروژن تشکیل می شود. در بخش آند با بار مثبت نیز نیم واکنش اکسایش رخ می دهد. طی این فرآیند آند الکترون به دست می آورد و گاز اکسیژن آزاد می گردد. این واکنش ها نیز نمونه ای از واکنش های احیا اکسیداسیون هستند که کارایی زیادی دارند.
تفاوت واکنش های احیا اکسایش با واکنش های اسید و باز
بسیاری از واکنش های اکسایش احیا شامل +H و –OH یا ترکیبات یونی نامحلولی هستند. واکنش های اکسایش کاهش ممکن است گاهی با واکنش های اسید و باز یا تشکیل رسوب اشتباه گرفته شوند. در صورت آشنایی کامل با این واکنش ها و شناخت درست آن ها می توان از بروز این اشتباهات ممانعت نمود. واکنش های رسوبی شامل ترکیب یون ها در محلول جهت تولید رسوب های نامحلول هستند. یک واکنش اسید و باز انتقال پروتون +H را شامل می گردد. این درحالی است که در واکنش های احیا اکسایش، انتقال الکترون و تغییر عدد اکسایش اتفاق می افتند.
نحوه تشخیص واکنش احیا اکسیداسیون (اکسایش کاهش)
برای تشخیص یک واکنش اکسایش احیا، باید به اعداد اکسایش تمام عناصر شرکت کننده در واکنش توجه نمود. درواقع باید مشخص شود که در درجه اکسایش اعضای شرکت کننده در واکنش چه تغییری صورت گرفته است. اگر در سمت چپ یا سمت راست واکنشی، عنصری به حالت آزاد وجود داشته باشد (مانند O۲ و یا Cu) حتما واکنش از نوع ردوکس بوده است. توجه شود که عکس این مطلب درست نیست و نمی توان گفت در واکنشی که عنصری به حالت آزاد وجود ندارد، پس آن واکنش ردوکس نیست.
معرفی ترکیبات احیا کننده
مواد کاهنده یا احیا کننده به موادی گفته می شود که دهنده الکترون به سایر مواد هستند. بنابراین موجب کاهش آن ها و اکسایش خودشان می شوند. احیا کننده ای که تمایلش به از دست دادن الکترون شدیدتر باشد، قوی تر است. به عنوان نمونه تعدادی از کاهنده های قوی مورد استفاده در واکنش های ردوکس عبارتند از:
- فلزات قوی همانند فلزات قلیایی و قلیایی خاکی
- هیدروژن
- دی اکسید گوگرد
- سولفات آهن (II)
- نمک های قلع (II) و آهن (II)
- اسید اکسالیک
- اسید یدیدریک
- H۲S
- و…
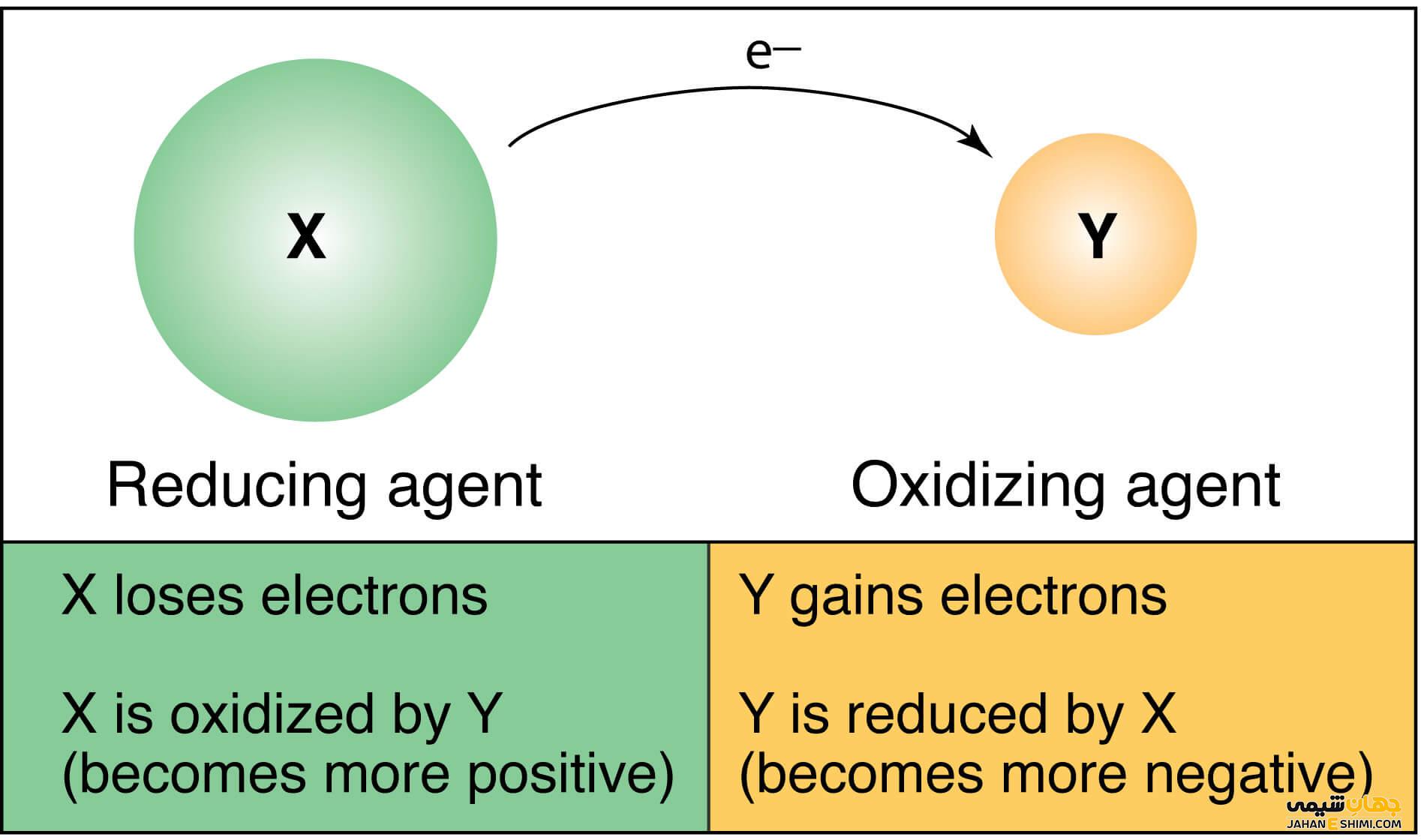
بر اساس تعاریفی که از واکنش های اکسایش و احیا شد، ماده کاهنده به ماده ای گفته می شود که دارای یکی از چهار خواص زیر باشد. این ویژگی ها به صورت زیر بیان می شوند.
- اکسیژن بگیرد.
- هیدروژن از دست بدهد.
- الکترون از دست بدهد.
- عدد اکسایش آن بزرگ شود.
نیم واکنش احیا در شیمی
واکنش احیا به کلیه واکنش هایی گفته می شود که طی آن ماده ای الکترون گرفته و عدد اکسایش آن کاهش می یابد. در نیم واکنش های احیا، الکترون ها در سمت چپ نیم واکنش نوشته می شوند. توجه شود که نیمه واکنش احیا گرماگیر است. به در ادامه به نیم واکنش احیا در سوختن منیزیم اشاره شده است.
O۲ (g) + 4e– → ۲O۲– (s)
اتم اکسیژن در طی این واکنش، الکترون های اتم منیزیم را به سمت خود کشیده و دارای بار منفی می گردد. در این واکنش تغییر عدد اکسایش صورت گرفته و عدد اکسایش اکسیژن از صفر به ۲- کاهش یافته است. دو نیم واکنش به طور همزمان انجام شده و بنابراین الکترون به طور همزمان از منیزیم به اکسیژن انتقال پیدا خواهد کرد. به طور کلی می توان گفت در این واکنش ردوکس اتم منیزیم الکترون از دست داده و اکسایش پیدا کرده و موجب کاهش اتم اکسیژن شده است.
تعریف واکنش احیا اکسایش
مبادله اکسیژن
قدیمی ترین و ابتدایی ترین تعریف واکنش های ردوکس مربوط به مبادله اکسیژن است. طبق این تعریف ماده ای که در واكنش شیمیایی اكسيژن بگيرد اکسایش یافته است. درمقابل ماده ای که اكسيژن از دست داده، کاهش یافته و احیا شده است. به واکنش زیر که یک واکنش ردوکس است توجه کنید. ترکیب V۲O۵ را در نظر بگیرید. این ترکیب در واکنش زیر اكسيژن از دست داده و بنابراین احیا شده است. حال به كربن مونوكسيد توجه نمایید. این ترکیب با گرفتن اكسيژن اکسایش یافته است.
V۲O۵ +۲CO → V۲O۳ + ۲CO۲
تعریف واکنش ردوکس براساس مبادله هیدروژن
برای درک بهتر این تعریف به واکنش زیر توجه نمایید.
Na + H۲O → NaOH + H۲
در این تعرف واکنشی ردوکس است که در آن مبادله هیدروژن صورت گیرد. به طوریکه عنصری که هیدروژن از دست داده، اکسایش یافته و عنصری که هیدروژن بگیرد کاهش یافته یا احیا شده است. در واکنش بالا سدیم هیدروژن گرفته و بنابراین احیا شده است. در این واکنش مولکول آب هیدروژن از دست داده و اکسایش یافته است.
مبادله الکترون
اين تعريف بر مبادله الکترون استوار است. برطبق این تعریف اگر عنصری الکترون از دست بدهد اکسایش یافته و اگر الکترون بگیرد کاهش یافته یا احیا شده است. به واکنش زیر توجه نمایید. در واکنش زیر مس الکترون گرفته و احیا شده است. روی نیز با از دست دادن الکترون اکسایش یافته و اكسيد شده است. همان طور که مشاهده می کنید این تعریف واکنش های ردوکس را بر مبنای گرفتن یا از دست دادن الکترون شرح می دهد.
Zn (s) + Cu۲+ (aq) ⟶ Zn۲+ (aq) + Cu (s)
عدد اکسایش
این تعريف واکنش های ردوکس را بر مبنای عدد اکسایش تعریف می کند. طبق این تعریف از واکنش ردوکس، عنصری که عدد اکسایشش افزایش یابد، اکسایش یافته است. عنصر هم که عدد اکسایشش کم شود، کاهش یافته یا احیا شده است. این تعریف از دیگر تعاریف جامع تر و کامل تر بوده و واکنش های احیا اکسیداسیون را بهتر تفسیر می کند. واکنش زیر نمونه ای از واکنش ردوکس است که بر مبنای عدد اکسایش توضیح داده می شود.
در این واکنش عدد اکسایش گوگرد از صفر به ۴+ افزایش یافته است. طبق تعریف گوگرد اکسید شده است. عدد اکسایش اکسیژن نیز از صفر به ۲- تغییر کرده و کاهش یافته است. بنابراین بر طبق این تعریف احیا شده است.
S (s) + O۲ (g) → SO۲ (g)
کاربرد واکنش احیا در شیمی
روش احیا شیمیایی یکی از روشهای سنتز نانو مواد به روش پایین به بالاست. این روش برای سنتز نانوذرات فلزی مورد استفاده قرار می گیرد. نانوذراتی همچون نانو ذرات طلا، نقره، پلاتین و پالادیوم با اندازه باریک، سایز و شکل دلخواه با استفاده از این روش قابل سنتز هستند. پیش ماده فلزی، عامل احیا کننده و عامل پایدارکننده از عوامل مهم در این واکنش احیا هستند. هریک از این اجزا با توجه به کاربرد مورد نظر و حلال، انتخاب گشته و سنتز انجام می شود. این واکنش تحت تاثیر عوامل زیر قرار دارد:
- دما
- زمان انجام واکنش
- نوع پیش ماده فلزی
- غلظت پیش ماده فلزی
- میزان کاهندگی عامل کاهنده
- نوع پلیمر پایدارکننده
رویکرد پایین به بالا یکی از رویکردهای سنتز نانو مواد است. روش احیا شیمیایی یکی از روشهای سنتز برطبق رویکرد پایین به بالاست. این روش در ساخت نانوذرات استفاده میشود. با توجه به انتخاب هر یک از عوامل بالا و کنترل شرایط سنتز می توان شکل، ترکیب و اندازه نانوذرات فلزی را تحت کنترل درآورد.
نحوه واکنش احیا شیمیایی نانوذرات
در واکنش احیا شیمیایی یک پیش ماده فلزی در یک حلال مناسب حل می گردد. کاتیون های فلزی در اثر حل شدن پیش ماده فلزی در محیط حلال پخش خواهند شد. سپس عامل کاهنده به حلال اضافه شده و با فراهم کردن الکترون موجب احیا کاتیونهای فلزی و خنثی شدن آن ها می گردد. با افزودن عامل کاهنده، کاتیونهای فلزی خنثی گشته و هسته زایی و رشد رخ خواهد داد.
اکسایش و کاهش چه زمانی اتفاق میافتند
اکسیداسیون یا اکسایش زمانی رخ می دهند که واکنش دهنده ای در حین واکنش الکترونها را از دست بدهد. کاهش نیز زمانی رخ می دهد که واکنش دهنده ای در حین واکنش الکترون به دست آورد. این نیم واکنش ها با یکدیگر واکنش ردوکس را پدید می آورند که از واکنش های مهم صنعتی محسوب می شود.
تفاوت اصلی بین اکسیداسیون و کاهش
الکترونها در نیم واکنش اکسایش از دست می روند یا به عبارتی دیگر تعداد آن ها کم می شود. در نوع کاهش برخلاف نامی که دارد، تعداد الکترونهای عنصر بیشتر می شوند.
اکسیداسیون فرآیندی است که طی آن، عدد اکسایش با از دست دادن الکترون در عناصری افزایش می یابد. الکترونها در واکنش های اکسایش در طرف راست نیم واکنش دیده می شوند. بنابراین نیم واکنش اکسایش گرماده است.

واکنش احیا فرآیندی است که عدد اکسایش عناصر در آن ها با گرفتن الکترون کاهش خواهد یافت. در این نیم واکنش الکترونها در سمت چپ ظاهر میشوند. این نیم واکنش گرما گیر است.
سخن آخر
واکنش های اکسایش احیا در شیمی از اهمیت بالایی برخوردار هستند. این واکنش ها را می توان به دو نیم واکنش تفکیک نمود. نیم واکنش های اکسایش کاهش همزمان رخ داده و تعداد الکترونها در نیم واکنش اکسیداسیون باید با تعداد کل الکترونها در نیم واکنش احیا برابر باشد.



















