یون هالید چیست؟ – ویژگی ها، نحوه تشخیص و کاربرد آن

به عناصر گروه ۱۷ جدول تناوبی که دارای ۷ الکترون در لایه ظرفیت خود هستند، هالوژن گفته می شود. هالوژن ها می توانند با گرفتن یک الکترون به آرایش هشتایی و پایدار رسیده و یون هالید تشکیل دهند. برای این که نشان داده شود که در یک ترکیب، یون هالید وجود دارد از روش های مختلفی استفاده می شود. یکی از این روش ها، حلالیت در آب است که برخی از این ترکیبات محلول بوده و برخی تشکیل رسوب می دهند. با مطالعه مقاله نشریه جهان شیمی فیزیک با یون هالید، ویژگی ها و کاربرد آن آشنا می شویم.
یون هالید چیست؟
هالوژن ها در ترکیبات مختلف به صورت یون های هالید ظاهر می شوند تا بتوانند با ذرات دیگر در پیوندهای شیمیایی شرکت کنند. یون های هالید با گرفتن یک الکترون در هالوژن ها تشکیل می شود. به عبارتی هالوژن ها به آنیون هایی با یک بار منفی تبدیل می شوند. بار الکتریکی یون های هالید، ۱- بوده و این یون ها توانایی برقراری پیوند با یون های مثبت دارند. یون های هالید هالوژن ها در گروه ۱۷ عبارتند از فلوئورید، کلرید، برمید، یدید و استاتید است. از عناصر این گروه، استاتین دارای خاصیت رادیواکتیوی و پرتوزایی است.
عدد اکسایش یون های هالید برابر ۱- بوده و برخی از آن ها محلول و برخی دیگر به صورت رسوب در می آیند.
ویژگی های یون هالید
یکی از خواص یون های هالید، نقش آن به عنوان عامل کاهنده است که بیرونی ترین الکترون را از دست می دهد. میزان قدرت از دست دادن این الکترون به شعاع یونی و اثر پوششی الکترون های داخلی بستگی دارد. این خاصیت در یون های هالید با حرکت از بالا به پایین گروه ۱۷ در جدول تناوبی، افزایش پیدا می کند. به عبارتی یون های پایین تر راحت تر می توانند الکترون خود را از دست دهند.
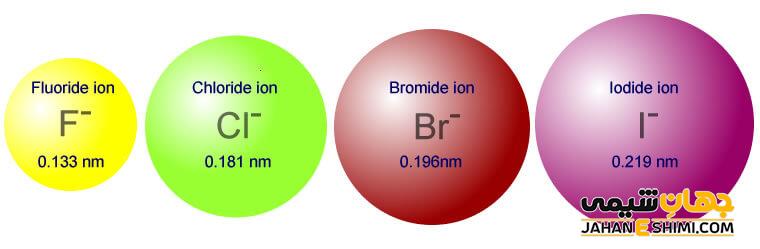
همچنین در گروه هالوژن ها در جدول تناوبی که هالیدها از آن ها تشکیل شده است، با حرکت از بالا به پایین جدول، از جاذبه میان هسته و الکترون های خارجی کاسته می شود. زیرا در این روند حرکت، شعاع یونی زیاد شده و فاصله میان الکترون های خارجی و هسته زیاد می شود. در نتیجه جاذبه میان آن ها کم می شود. با حرکت در یک گروه، تعداد لایه های الکترونی افزایش پیدا کرده و اثر پوششی الکترون های داخلی کم می شود. با کاهش اثر پوششی این الکترون ها، جاذبه هسته بر الکترون های لایه ظرفیت کاهش پیدا می کند.
روند تغییرات خواص یون های هالید از بالا به پایین جدول متفاوت است. به طوری که الکترونگاتیوی، قطبیت و قدرت اکسیداسیون در این روند، کاهش یافته ولی نقطه جوش، شعاع اتمی و اثر پوششی زیاد می شود.
ترکیبات یون هالید
یون هالید تشکیل یافته از هالوژن ها می تواند با عناصر گروه های مختلف در جدول تناوبی، تشکیل ترکیبات مختلف دهد. به عنوان مثال، فلزات قلیایی، فلزات قلیایی خاکی، هیدروژن، سیلیکون و … می تواند با این یون ها تشکیل ترکیب دهد. برخی از این ترکیبات در زیر بررسی می کنیم.
ترکیب یون هالید با فلزات قلیایی
هالیدها با فلزات قلیایی ترکیباتی تشکیل می دهند که جامد کریستالی بوده و هالید فلزات قلیایی خوانده می شوند. این ترکیبات نقطه ذوب بسیار بالایی داشته و به راحتی می توانند در آب حل شوند. اما در این مورد، لیتیم فلوئورید استثنا بوده و قابل انحلال در آب نیست. علت این خاصیت، کوچک بودن اندازه آنیون و کاتیون این ترکیب و همچنین داشتن انرژی شبکه بالای آن است. یون های هالید دیگر لیتیم مانند لیتیم کلرید در استون، اتانول و اتیل استات حل می شود. میزان انحلال پذیری سزیم یدید پایین است، زیرا یون های تشکیل دهنده این ترکیب، انرژی هیدراته کمی دارد.
ترکیب یون هالید با فلزات قلیایی خاکی
از میان ترکیبات هالید با فلزات قلیایی خاکی، بریلیم کلرید، منیزیم کلرید و منیزیم کلرید، می توانند در حلال های آلی حل شوند. حلالیت فلوئوریدهای عناصر این گروه از جدول تناوبی در آب کم بوده ولی این انحلال با زیاد شدن شعاع یونی، افزایش پیدا می کند. از میان کلریدهای فلزات قلیایی خاکی، بریلیم کلرید، ترکیبی مولکولی بوده و دارای پیوند کووالانسی است. بقیه این ترکیبات یونی بوده و می تواند در آب حل شود. همچنین بریلیم کلرید به دلیل این مولکولی بودن، نقطه ذوب بالایی دارد.
ترکیب یون هالید با هیدروژن
یون هالید با هیدروژن تشکیل هیدروژن هالید می دهد که کاربردهای زیادی دارند. این ترکیبات به صورت محلول، نقش اسید قوی را دارند، ولی هیدروژن فلوئورید به عنوان یک اسید ضعیف عمل می کند. این هالیدها در آب حل شده و جدایی یون های تشکیل دهنده آن صورت می گیرد.
در آزمایشگاه ها می توان یون های هالید را با اسیدهای فرار به دست آورد. به عنوان مثال اگر اسید سولفوریک را با کلرید سدیم واکنش دهند، هیدروژن کلرید به دست می آید و سولفات سدیم به عنوان محصول دیگر حاصل می شود. از واکنش اسید فسفریک با برمید پتاسیم، هیدروژن برمید و از واکنش اسید سولفوریک با دی فلوئورید کلسیم نیز هیدروژن فلوئورید به دست می آید.
علت این که با کمک روش های این چنینی نمی توان هیدروژن یدید ساخت، عدم پایدار بودن این ترکیب هالیدی است. به همین دلیل برای این که هیدروژن یدید ساخته شود، فسفر را با ید ترکیب می کنند. فسفر یدید تشکیل شده، هیدرولیز شده و هیدروژن یدید تشکیل می شود.
رنگ های ترکیبات هالیدی
وقتی ترکیات هالید تشکیل می شود، رسوب برخی از آن ها دارای رنگ های متفاوت است. به عنوان مثال، رسوب کلرید به رنگ سفید، رسوب برمید به رنگ زرد روشن و یدید نیز به رنگ زرد است. یون فلوئورید رسوبی تشکیل نمی دهد.
شناسایی یون هالید به حالت محلول
یون های هالید می تواند به صورت جامد و یا محلول وجود داشته و با روش های مختلفی در آزمایشگاه ها شناسایی شود. نمک های هالید را با ترکیبات مختلف واکنش داده و از روی رسوبات ایجاد شده می توان وجود این هالیدها را شناسایی کرد.
شناسایی یون کلرید در محلول
برای شناسایی این یون، ابتدا استات سرب (ll) و یا نیترات سرب (ll) را به محلول این نمک ها اضافه کرده و رسوب سفیدرنگ کلرید سرب (ll) تشکیل می شود. رسوب تشکیل شده در آب گرم ذوب می شود ولی اگر سرد شود، مجدد تشکیل رسوب می دهد.
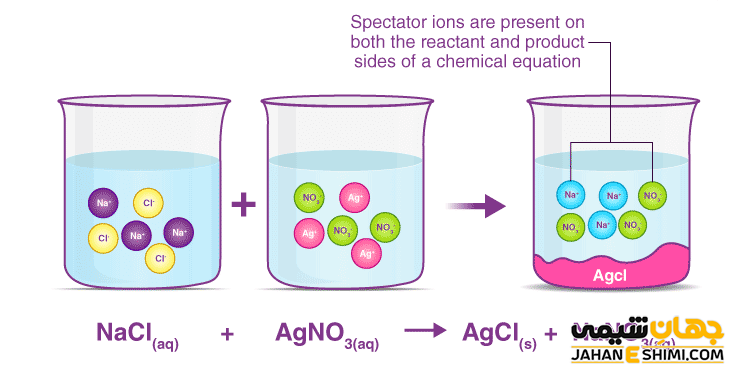
یکی دیگر از روش های شناسایی یون کلرید، استفاده از محلول نیترات نقره است. در این روش ابتدا محلول را با اسید نیتریک اسیدی کرده و با اضافه کردن نیترات نقره، رسوب سفید رنگ کلرید نقره تشکیل می شود. رسوب حاصل شده قابلیت حلالیت در آمونیاک رقیق را دارد.
روش دیگری که برای این منظور به کار برده می شود، افزودن کلروفرم و یا تتراکلرید کربن به محلول حاوی یون کلرید است. اگر با تکان دادن محلول، لایه بی رنگی تشکیل شد، دلیل بر وجود این یون هالید در محلول است.
شناسایی یون برمید در محلول
برای شناسایی یون هالید در حالت محلول، یکی از روش ها همان افزودن استات سرب (ll) و یا نیترات سرب (ll) به محلول است. در این جا نیز رسوب تشکیل می شود ولی رنگ آن کرم و زرد کمرنگ است. این رسوب که برمید سرب (ll) است نیز در آب گرم ذوب شده و بعد از سرد شدن تشکیل بلور می دهد.
روش دوم مانند شناسایی محلول کلرید، استفاده از محلول نیترات نقره و اسید نیتریک است که در این جا رسوب کرمی برمید نقره تشکیل می شود که در آمونیاک غلیظ حل می شود.
استفاده از تتراکلرید کربن یا کلروفرم و تکان دادن محلول نیز، با تشکیل گلوله های قهوه ای- نارنجی، ثابت کننده وجود یون برمید است.
شناسایی یون یدید در محلول
روش هایی که برای شناسایی یون هالید بعدی یعنی یدید استفاده می شود نیز مانند تشخیص یون های کلرید و برمید است.
در روش استفاده از استات سرب (ll) یا نیترات سرب (ll)، رسوب زرد رنگ یدید سرب (ll) تشکیل می شود. این رسوب نیز با آب گرم در حال جوشیدن، ذوب شده و بعد از سرد شدن، مجدد بلوری زرد و طلا فرم می شود.
در روش دوم و کاربرد اسید نیتریک رقیق و نیترات نقره، رسوب زرد یدید نقره تشکیل می شود. اما این رسوب برخلاف دو رسوب دیگر، در آمونیاک حل نمی شود.
کاربرد کلروفرم و یا تتراکلرید کربن نیز باعث تشکیل گلوله های ارغوانی رنگ می شود. اگر این گلوله های مشاهده شد، یون یدید در محلول وجود دارد.
تشخیص و شناسایی یون هالید در حالت جامد
شناسایی یون کلرید در ترکیبات جامد
با دو روش می توان یون کلرید را در یک ترکیب جامد شناسایی کرد. یکی از این روش ها، ترکیب دادن ماده جامد مذکور با اسید سولفوریک و گرما دادن آن هاست. محصول تولید شده سدیم هیدروژن کربنات و گاز هیدروکلریدریک اسید است. با ترکیب کردن گاز تولید شده با گاز آمونیاک، گازی با غلظت بالا و مانند مه تشکیل می شود که آمونیوم کلرید است. با تشکیل این مه، وجود یون کلرید در این ترکیب جامد شناسایی می شود.
دومین روشی که برای این هالید در حالت جامد به کار می رود، ترکیب این جامد با اسید سولفوریک غلیظ و اکسید منگنز و گرما دادن آن هاست. در این واکنش، یون های کلرید توسط اکسید منگنز به عنوان عامل اکسید کننده، گاز کلر سبز رنگ متمایل به زرد تولید می شود. در این واکنش باید احتیاط کرد زیرا گاز کلر، سمی و خطرناک است.
شناسایی یون برمید در حالت جامد
برای شناسایی یون برمید در حالت جامد نیز از روش های شناسایی یون کلرید استفاده می شود. به این ترتیب اگر این ترکیب جامد با اسید سولفوریک ترکیب شده و حرارت داده شود، محصول به دست آمده، گاز برم قهوه ای و گاز هیدروژن خواهد بود.
با روش دیگر و ترکیب این جامد با اسید سولفوریک غلیظ و اکسید منگنز و گرما دادن آن ها، گاز برم قهوه ای تشکیل شده و یون های کاهش یافته منگنز (ll) نیز تشکیل می شود.
شناسایی یون یدید در حالت جامد
در شناسایی یون یدید در حالت جامد در صورت ترکیب با اسید سولفوریک و حرارت دادن، اکسید شدن یون ید انجام شده و گاز ارغوانی رنگ ید تشکیل می شود. در این واکنش، گاز هیدروژن نیز تولید می شود.
با استفاده از روش دیگر و ترکیب این جامد با اسید سولفوریک غلیظ، اکسید منگنز و حرارت دادن، گاز ید به رنگ ارغوانی تولید می شود.
کاربرد یون هالید

از کاربردهای مهم یون هالید، به عنوان لامپ های تخلیه فشار بالاست که در خیابان ها مشاهده می شود. این لامپ ها با نام متال هالید و یا لامپ هالید فلزی خوانده می شود. مزیت این لامپ ها نسبت به لامپ های بخار جیوه، مقرون به صرفه بودن است. همچنین مزیت آن نسبت به لامپ های سدیم فشار بالا این است که می تواند رنگ ها را بهتر تفکیک کند. این لامپ ها می تواند در هوای بارانی به جای نور طبیعی استفاده شود و یا در گلخانه ها به کار برده می شود.
یکی دیگر از کاربردهای یون هالید در فیلم های عکاسی است که ترکیب هالید نقره به کار برده می شود. در هالید کردن پلیمرها و همچنین در روغن لحیم نیز یون هالید به کار برده می شود.