آنتالپی فروپاشی شبکه بلور چیست؟ – چرخه بورن هابر

در علم شیمی به تغییرات آنتالپی که با تراکم یون های مثبت و منفی ایجاد شده و تولید یک شبکه بلوری را می کند، آنتالپی فروپاشی شبکه بلور می گویند. با انرژی شبکه می توان قدرت پیوند را در ترکیب های یونی اندازه گیری کرد. انرژی که در هنگام تشکیل یک مول جامد یونی از یون های گازی آزاد می شود، انرژی شبکه بلوری گفته می شود. این مقاله نشریه جهان شیمی فیزیک ما را با آنتالپی فروپاشی شبکه بلور آشنا می کند.
انرژی شبکه چیست؟
انرژی شبکه نوعی انرژی پتانسیل است. در تعریف این انرژی می توان گفت که میزان انرژی است که در شکستن و تبدیل کردن یک جامد یونی به اتم های سازنده آن لازم است. با این تعریف، انرژی شبکه عددی مثبت بوده و فرایند تعریف این انرژی، گرماگیر است. اما اگر با واکنش گرماده بخواهیم، انرژی شبکه بلور را به صورت انرژی آزاد شده در بر همکنش های یون های گازی در تشکیل یک جامد گازی تعریف کنیم. با این تعریف، انرژی شبکه بلور مقدار عددی منفی خواهد داشت.
به عبارتی وقتی یک جامد یونی از هم پاشیده شده و به اتم های سازنده خود تبدیل می شود و یا وقتی که اتم های تشکیل دهنده یک بلور طی چرخه بورن – هابر به یک جامد یونی تبدیل می شود، میزان انرژی آزاد و یا جذب شده را به عنوان انرژی شبکه و یا آنتالپی فروپاشی شبکه بلور می نامند.به طور معمول آنتالپی شبکه بلوری را به صورت مثبت گزارش می کنند.

تعریف آنتالپی فروپاشی شبکه بلور در پایداری جامدات یونی
پایداری کمی در یک جامد یونی با توجه به ساختار شبکه ای منظم وجود دارد، چون جامدات یونی دارای میزان آنتروپی (بی نظمی) کمی است. در یک جامد با توجه به ساختار بلوری، برهمکنش بین هر یون با یون های ناهمنام دیگر ایجاد شده و تغییرات آنتالپی با شدت بیشتری را با خود خواهد داشت. در این برهمکنش هاست که انرژی زیادی آزاد می شود. این خواص باعث بالا شدن نقاط ذوب و جوش در جامدات یونی می شود. نقاط ذوب و جوش در بعضی از جامدات یونی به حدی است که تجزیه و شکسته شدن آن ها قبل از این دماها اتفاق می افتد.
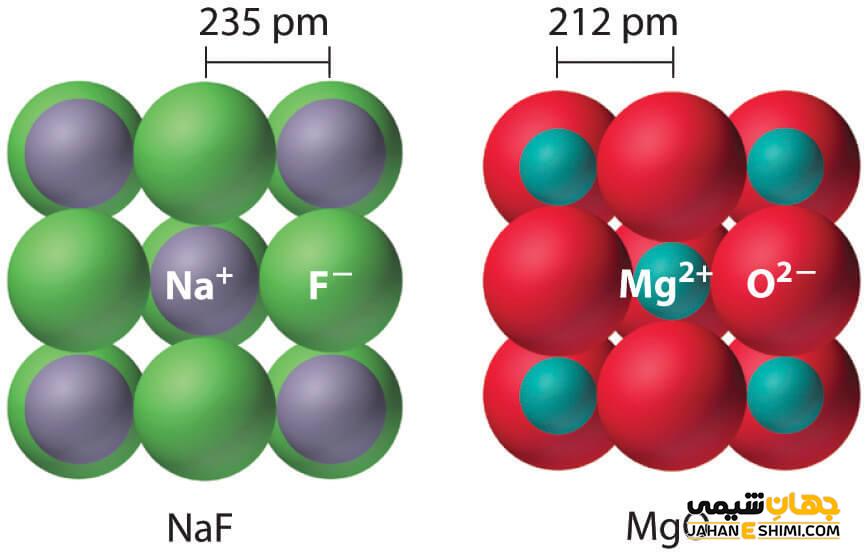
جامد یونی چیست؟
جامدات یونی، ساختارهای بلوری هستند که از کنار هم قرار گرفتن یون های مثبت و منفی تشکیل شده اند. یون های تشکیل دهنده آن ها با یک الگوی هندسی مشخصی در کنار هم قرار می گیرند. چون نیروی جاذبه بین یون های مثبت و منفی بیشتر از نیروی دافعه بین آن هاست، جامدات یونی ترکیبات پایداری هستند. جامدات بلوری، ترکیبات پایداری با نقاط ذوب و جوش بالا بوده و در حالت مذاب، رسانای خوبی برای الکتریسیته هستند. در یک جامد یونی، بار الکتریکی نهایی صفر بوده و آنیون ها و کاتیون ها طوری در کنار هم قرار گرفتند که بر همدیگر مماس هستند.
انرژی های موجود در یک جامد یونی که با پیوند جاذبه الکتروستاتیکی در کنار هم هستند، به شکل های زیر است. یکی از انرژی هایی که در یک جامد یونی وجود دارد، انرژی واندروالسی است که هسته یک یون بر الکترون های لایه ظرفیت یون ها مجاور وارد می کند. دومین انرژی موجود، جاذبه الکتروستاتیکی بین یون های با بار مخالف است.
چگونگی تشکیل یک پیوند یونی
تشکیل یک پیوند یونی در بیشتر مواقع به دلیل واکنش های اکسایش و کاهشی است که اتفاق می افتد. در تشکیل این پیوندها، اتم فلزی، الکترون های خود را از دست داده و با رسیدن به آرایش پایدار گاز نجیب، به یک یون مثبت تبدیل می شود. اتم های نافزی نیز با گرفتن الکترون به آرایش گاز نجیب رسیده و یک آنیون را تشکیل می دهند. بین آنیون ها و کاتیون های تشکیل شده، جاذبه الکتروستاتیکی برقرار شده و یک ساختار بلوری و یا جامد یونی تشکیل می شود. آنیون ها و کاتیون ها علاوه بر داشتن ساختار ساده و تک اتمی، می توانند دارای ساختارهای پیچیده ای باشند. به عنوان نمونه کاتیون آمونیوم از این دست یون هاست.
در تشکیل یک ترکیب یونی خنثی، نسبت های دقیق و معینی از آنیون ها و کاتیون ها کنار هم قرار می گیرند. این ترکیبات با وجود این که مولکولی نیستند، ولی بر طبق قوانین استوکیومتری دقیقی در کنار هم قرار می گیرند. لازم به ذکر است که اکثر ترکیبات یونی، نمک ها هستند. کلرید سدیم نمونه بارزی از این ترکیبات است.
چرخه بورن – هابر
روشی که به طور مستقیم و تجربی بتواند، مقدار آنتالپی شبکه های بلوری را اندازه گیری کند، وجود ندارد. به همین دلیل میزان این انرژی را با استفاده از داده های تجربی و همچنین استفاده از چرخه بورن هابر می توان به دست آورد.
برای توضیح چرخه بورن – هابر به اصطلاحاتی نیاز است که در این جا به تعریف آن ها می پردازیم.
انرژی یونی چیست؟
به میزان انرژی که برای جداسازی یک الکترون از یک اتم و یا یون خنثی لازم است تا تبدیل به یک یون مثبت شود، انرژی یونی می گویند. مقدار عددی انرژی یونش مثبت بوده و مقدار آن در جدول تناوبی با حرکت از سمت چپ به سمت راست جدول، افزایش پیدا می کند. اما با حرکت از بالا به پایین جدول، مقدار انرژی یونش کاهش پیدا می کند.
الکترون خواهی
وقتی یک الکترون به یک اتم و یا یون خنثی افزوده می شود، انرژی که آزاد می شود به نام انرژی الکترونخواهی نامیده می شود. مقدار این انرژی همیشه عددی منفی است اما در جدول ها این مقدار را به شکل مثبت نشان می دهند. میزان الکترون خواهی در یک جدول تناوبی از سمت چپ به سمت راست، افزایش و از بالا به پایین جدول، کاهش پیدا می کند.
انرژی تفکیک یونی
به مقدار انرژی که برای تفکیک یک ترکیب یونی لازم است، انرژی تفکیک می گویند. برای این فرایند به گرما نیاز است و واکنش آن گرماگیر است. انرژی تفکیک یونی با توجه به میزان الکترونگاتیوی اتم ها تشکیل دهنده آن متفاوت است. تغییرات انرژی تفکیک یون ها، مثبت است.
انرژی تصعید
وقتی یک ترکیب از حالت جامد به طور مستقیم به حالت گازی تبدیل می شود، به مقداری انرژی نیاز است که به نام انرژی تصعید خوانده می شود. مانند انرژی تفکیک، چون در این فرایند نیز به انرژی نیاز است، مقدار عددی آن مثبت است. انرژی تصعید را انرژی اتمیزه شدن نیز می گویند.
گرمای تشکیل
وقتی یک ترکیب از عناصر تشکیل دهنده خود تشکیل می شود، انرژی تغییر می کند که به آن میزان انرژی، گرمای تشکیل می گویند. مقدار عددی گرمای تشکیل می تواند با توجه به نوع اتم های تشکیل دهنده آن می تواند مثبت و یا منفی باشد.
قانون هس
قانون هس در چرخه بورن – هابر مهم بوده و این چرخه را نوعی قانون هس می دانند. با توجه به این قانون، تغییرات کلی انرژی یک فرایند را با تقسیم کردن آن به مرحله های مختلف و افزوده کردن به هر مرحله می توان تعیین کرد. به عبارتی این قانون بیان می کند که میزان تغییرات آنتالپی در هر واکنش شیمیایی دارای مقداری ثابت خواهد بود و یک مرحله ای و یا چند مرحله ای بودن واکنش در آن تاثیری نخواهد داشت. این قانون برگرفته از اصل اول ترمودینامیک یا اصل بقای انرژی است.
بر طبق قانون هس، آنتالپی تشکیل جامدات یونی به صورت معادله زیر تعریف می شود.
∆Hf = ∆HAM + ∆HAX + IE + EA +U
در این رابطه، ∆Hf به عنوان آنتالپی تشکیل جامد یونی، ∆HAM آنتالپی اتمی شدن فلز، ∆HAX آنتالپی اتمی شدن نافلز، IE انرژی یونیزاسیون فلز، EA انرژی الکترون خواهی نافلز و U انرژی شبکه بلوری را نشان می دهد.



















