نظریه حالت گذار چیست و چه کاربردی در واکنش های شیمیایی دارد؟

نظریه حالت گذار (TST) یک «حالت گذار» فرضی را توصیف می کند که در فضای بین واکنش دهنده ها و محصولات در یک واکنش شیمیایی رخ می دهد. تشکیلاتی که در حالت گذار تشکیل می شود، به عنوان کمپلکس فعال یا حد واسط شناخته می شود. این نظریه برای توصیف چگونگی وقوع یک واکنش شیمیایی استفاده می شود و بر اساس تئوری برخورد است.
اگر ثابت سرعت برای یک واکنش شیمیایی مشخص باشد، نظریه حالت گذار می تواند به خوبی برای محاسبه آنتالپی استاندارد فعال سازی و انرژی استاندارد گیبس استفاده شود. این نظریه همچنین به عنوان «نظریه کمپلکس فعال»، «نظریه نرخ مطلق» و «نظریه نرخ واکنش مطلق» نیز شناخته می شود.
تشکیلاتی که در طول حالت گذار تشکیل می شوند انرژی بالاتری دارند و به عنوان کمپلکس فعال شناخته می شود. بر اساس این نظریه، یک برخورد موفقیت آمیز لزوما به تشکیل محصول منجر نمی شود، بلکه تنها منجر به تشکیل کمپلکس فعال می شود. هنگامی که کمپلکس فعال شده تشکیل شد، می تواند تبدیل به محصولات شده، یا می تواند به حالت واکنش دهنده ها برگردد. برای کسب اطلاعات بیشتر در موردی نظریه حالت گذار، لطفا تا انتها با ما در این مقاله از نشریه جهان شیمی فیزیک همراه باشید.
نظریه آرنیوس و مختصات واکنش
تئوری آرنیوس و مختصات واکنش به دیدگاه خاصی در مورد سینتیک شیمیایی مربوط می شود که مسیر طی شده توسط واکنش دهنده ها را هنگام تبدیل آنها به محصولات تصور می کند. این تغییرات سریع نخواهند بود و معمولا کند صورت می گیرند. زیرا برای تبدیل از واکنش دهنده ها به محصولات، سیستم ابتدا باید از یک حالت انرژی بالاتر به نام حالت گذار عبور کند. اندازه سد انرژی، به میزان دمای واکنش بستگی دارد.
سرعت یک واکنش به تعداد مولکول هایی که انرژی کافی دارند، بستگی خواهد داشت. برای افزایش سرعت، می توان دما را افزایش داد یا می توان سد انرژی را پایین آورد. در نتیجه، براساس قانون آرنیوس تمام واکنش های شیمیایی با افزایش دما، سرعت خود را افزایش می دهند. با این حال، محدودیت هایی در دنیای واقعی وجود دارد، زیرا نگهداری یک سیستم در دمای بالا به انرژی زیادی نیاز دارد. علاوه بر این، با افزایش دما ممکن است نتایج نامطلوبی مانند تجزیه برخی از واکنش دهنده ها یا محصولات نیز ایجاد شود.
نمودار مختصات یک واکنش شیمیایی
نمودار مختصات واکنش مسیری است که مولکول های واکنش دهنده و مولکول های محصولات را به هم پیوند می دهد. در بسیاری از واکنش ها، می توانیم مستقیما این مختصات را به عنوان طول یک پیوند یا پیوندهای خاص تصور کنیم. در موارد دیگر، مختصات واکنش صرفا برای نمایش برخی مختصات ناشناخته استفاده می شود. نکته کلیدی این است که مسیرهای بالقوه زیادی بین واکنش دهنده ها و محصولات وجود دارد. مختصات واکنش نشان دهنده کمترین مسیر انرژی است.
به عنوان مثال، در یک واکنش برای تشکیل CH۳OH و Cl، مکانیسم این واکنش یک مرحله است که در آن CH۳Cl با OHبرخورد می کند و محصولات را تشکیل می دهد. ما می توانیم مختصات واکنشی را متصور شویم که شامل طولانی شدن پیوند C-Cl (پیوندی که در حال شکستن است) و کوتاه شدن پیوند C-O (پیوندی که در حال تشکیل است) است.
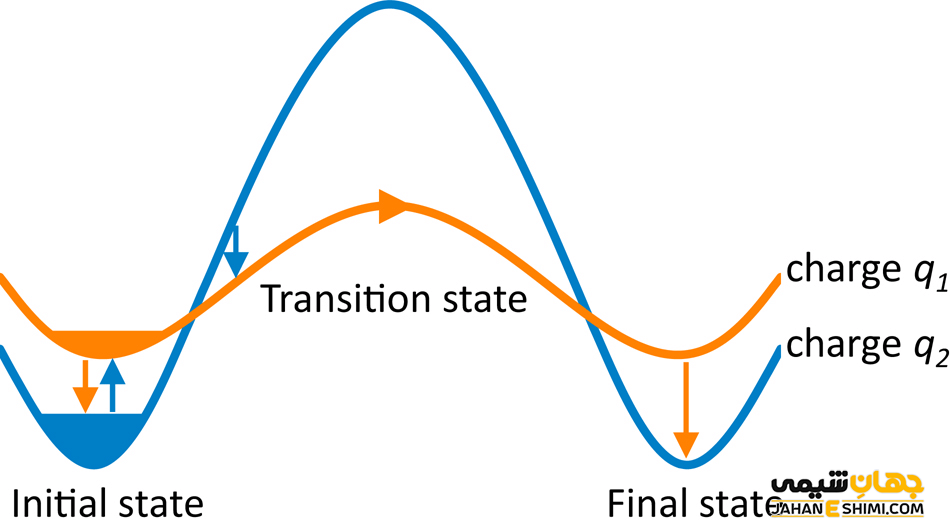
درست در میانه شکستن پیوند قدیمی و تشکیل پیوند جدید در این سیستم حالتی وجود دارد که ما آن را «حالت گذار» می نامیم که انرژی آن بالاتر از واکنش دهنده ها یا محصولات است. هنگامی که از این حالت فراتر می رویم، واکنش به سمت جلو پیش می رود تا محصولات تولید شود.
اگر یک مکانیسم شیمیایی مراحل زیادی داشته باشد، فراز و فرودهای زیادی در امتداد مختصات واکنش خواهید داشت. هر حداقلی که بین واکنش دهنده ها و محصولات در امتداد مختصات واکنش وجود داشته باشد، به عنوان حد واسط شناخته می شوند.
مرحله گذار چیست
مرحله گذار یا نظریه حالت گذار توسط هنری آیرینگ در سال ۱۹۳۵ در دانشگاه منچستر ایجاد شد. این نظریه عامل بسیار مهمی در تعیین سرعت یک واکنش شیمیایی است. اگرچه نظریه حالت گذار نمی تواند سرعت واکنش مطلق یک واکنش شیمیایی را تعیین کند، اما می تواند انرژی آزاد گیبس و آنتروپی را به خوبی محاسبه کند. در نتیجه، این نظریه با فرض تعادل بین واکنش دهنده ها و کمپلکس فعال شده در حالت گذار، درک روشنی از سرعت یک واکنش شیمیایی و وقوع کیفی یک واکنش شیمیایی ارائه می دهد.
معنای حالت گذار را می توان به سادگی بدین گونه توضیح داد وقتی دو واکنش دهنده با آرایش مولکولی مشخص تحت یک واکنش شیمیایی قرار می گیرند، بین آرایش اولیه و نهایی مولکول ها یا اتم ها، یک حالت میانی واکنش به دست می آید که در آن حداکثر انرژی جنبشی مشاهده می شود. این پیکربندی میانی خاص اتم ها یا مولکول ها با حداکثر مقدار انرژی جنبشی، کمپلکس فعال نامیده می شود و حالت آن به عنوان حالت گذار تعریف می شود.
نظریه برخورد چیست
نظریه برخورد بیان می کند که واکنش های شیمیایی در فاز گاز زمانی رخ می دهد که مولکول ها با انرژی جنبشی کافی با یکدیگر برخورد کنند. این نظریه بر اساس نظریه جنبشی گازها ساخته شده است. نظریه ای که توصیف می کند گازها حاوی ذراتی هستند که حجم مشخصی نداشته اما جرم مشخصی دارند و هیچ جاذبه یا دافعه بین مولکولی بین این ذرات وجود ندارد.
بر اساس تئوری برخورد، تنها چند برخورد بین ذرات گاز باعث می شود که این ذرات تحت واکنش های شیمیایی قابل توجهی قرار گیرند. این برخوردها به عنوان برخوردهای موفق شناخته می شوند و انرژی مورد نیاز برای این برخوردهای موفقیت آمیز به عنوان انرژی فعال سازی شناخته می شود. این برخوردها می تواند باعث شکستگی و تشکیل پیوندهای شیمیایی جدید شود.
انرژی فعال سازی چیست
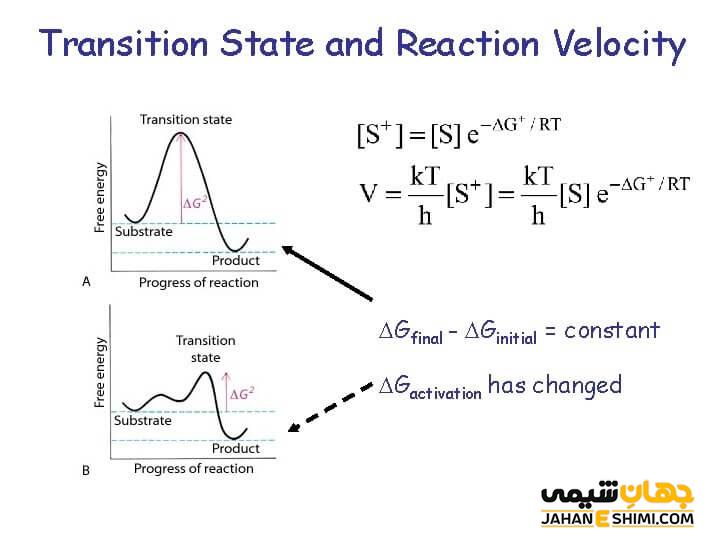
انرژی فعال سازی حداقل مقدار انرژی لازم برای پیشروی یک واکنش شیمیایی است. هر چه انرژی فعال سازی بیشتر باشد، سرعت واکنش کندتر است. با این حال، افزودن گرما به یک واکنش سرعت آن را افزایش می دهد، زیرا باعث می شود مولکول ها سریع تر حرکت کنند و احتمال برخورد مناسب مولکول ها را با یکدیگر افزایش می دهد.
برخورد و شکستن پیوندها نشان دهنده مرحله روبه بالایی یک واکنش است و عبور از حالت گذار را ایجاد می کند. تشکیل پیوندهای شیمیایی جدید و محصولات نهایی و آزاد شدن انرژی در مراحل سراشیبی نمودار واکنش صورت می گیرد. کاتالیزورها با کاهش انرژی فعال سازی سرعت واکنش را افزایش می دهند.
کاتالیزور چیست و چه کاربردی دارد
کاتالیزور ماده ای است که با کاهش انرژی فعال سازی سرعت واکنش را افزایش می دهد و در ادامه فرآیند خود را بازسازی می کند. این ترکیبات یک مسیر یا مکانیسم جایگزین را برای انجام واکنش فراهم می کنند و واکنش های رو به جلو و واکنش های معکوس را تسریع می کنند. در زیست شناسی، آنزیم ها نمونه هایی از کاتالیزورها هستند زیرا انرژی فعال سازی مورد نیاز برای واکنش های سلولی را کاهش می دهند.
به عنوان مثال، بدن انسان قند و چربی را برای تولید انرژی متابولیزه می کند. آنزیم ها برای تجزیه این مولکول ها برای انسان حیاتی هستند، زیرا اگر انرژی حرارتی به تنهایی استفاده شود، انرژی آزاد شده به شکل گرما باعث دناتوره شدن پروتئین های سلول می شود. علاوه بر این، انرژی حرارتی به طور غیر اختصاصی تمام واکنش ها را کاتالیز می کند. با این حال، آنزیم ها فقط به واکنش دهنده های شیمیایی خاص، به نام سوبسترا، متصل می شوند و انرژی فعال سازی آن ها را کاهش می دهند تا واکنش های سلولی انتخابی را کاتالیز کنند.
عملکرد کمپلکس فعال در واکنش های شیمیایی
دو واکنش دهنده X و Y می توانند با یکدیگر واکنش نشان دهند اگر مولکول های آنها با یکدیگر برخورد کنند و محصول XY را تشکیل دهند. سرعتی که در آن واکنش انجام می شود، سرعت واکنش نامیده می شود. سرعت واکنش به عوامل زیادی مانند دما، غلظت واکنش دهنده ها و استفاده از کاتالیزور بستگی دارد. افزایش سرعت واکنش نشان دهنده برخورد موثرتر بین مولکول های واکنش دهنده است.
استفاده از کاتالیزور برای افزایش انرژی جنبشی واکنش دهنده ها بسیار مفید است. افزایش انرژی جنبشی باعث می شود واکنش دهنده ها به راحتی از سد انرژی فعال سازی برای تشکیل محصولات عبور کنند. همچنین با افزایش غلظت واکنش دهنده ها برخورد مناسب مولکول ها افزایش می یابد. بدیهی است که اگر مولکول های واکنش دهنده بتوانند در انرژی فعال سازی شرکت کنند، کمپلکس فعال شده می تواند تشکیل شود.
هنگامی که کمپلکس فعال شده تشکیل می شود، ترکیبات نمی تواند در این حالت بمانند. کمپلکس فعال به دلیل انرژی پتانسیل بالا در مقایسه با واکنش دهنده ها یا محصولاتی که تشکیل می دهد، ماهیت بسیار ناپایدار و موقتی دارد. اگر انرژی فعال سازی کافی وجود نداشته باشد، کمپلکس نمی تواند یک محصول تشکیل دهد و واکنشی انجام نمی شود.
کاربردهای نظریه حالت گذار در بیوشیمی
این نظریه بیشترین کاربرد را در زمینه بیوشیمی دارد، جایی که اغلب برای مدل سازی واکنش هایی که توسط آنزیم ها در بدن کاتالیز می شوند، استفاده می شود. برای مثال، با دانستن حالت های انتقالی که می توانند در یک واکنش معین ایجاد شوند و همچنین با دانستن انرژی های فعال سازی مختلف برای هر حالت گذار، می توان سیر یک واکنش بیوشیمیایی را پیش بینی کرد و سرعت واکنش آن را تعیین کرد.
از این نظریه همچنین می توان برای درک مکانیسم یک واکنش شیمیایی اولیه نیز استفاده کرد. این نظریه جایگزین دقیق تری برای معادله آرنیوس در واکنش های شیمیایی است. بر اساس تئوری حالت گذار، سه عامل اصلی بر مکانیسم واکنش تأثیر می گذارند، این سه عامل عبارتند از:
- غلظت ترکیب حالت گذار (معروف به کمپلکس فعال شده)
- سرعت تجزیه کمپلکس فعال – میزان تشکیل محصول مورد نظر را تعیین می کند.
- نحوه تجزیه کمپلکس فعال شده – محصولات تشکیل شده در واکنش شیمیایی را تعیین می کند.
با این حال، طبق این نظریه، دو رویکرد برای انجام یک واکنش شیمیایی وجود دارد. کمپلکس فعال شده ممکن است به شکل واکنش دهنده بازگردد یا می تواند برای تشکیل محصول از هم جدا شود. تفاوت انرژی بین انرژی واکنش دهنده و انرژی حالت گذار به عنوان انرژی فعال سازی شناخته می شود.
تفاوت نظریه حالت گذار و نظریه برخورد
نظریه برخورد و تئوری حالت گذار دو نظریه متفاوت هستند که برای بیان سرعت واکنش های شیمیایی مختلف در سطح مولکولی استفاده می شوند. تئوری برخورد، برخورد مولکول های گاز را در واکنش های شیمیایی توصیف می کند. در حالی که تئوری حالت گذار سرعت یک واکنش را با فرض تشکیل ترکیبات میانی که حالت های گذار هستند را توضیح می دهد. تفاوت اصلی بین نظریه برخورد و نظریه حالت گذار در این است که نظریه برخورد به برخورد بین مولکول های گاز مربوط می شود در حالی که نظریه حالت گذار به تشکیل ترکیبات میانی در حالت های گذار مربوط می شود.
همچنین تئوری برخورد بیان می کند که واکنش های شیمیایی (در فاز گاز) به دلیل برخورد مناسب بین واکنش دهنده ها رخ می دهد. در حالی که تئوری حالت گذار بیان می کند که واکنش های شیمیایی از طریق عبور از یک حالت گذار رخ می دهند. بر اساس تئوری برخورد، تنها برخوردهای موفق باعث بروز واکنش های شیمیایی می شوند. اما بر اساس تئوری حالت گذار، اگر واکنش دهنده ها بتوانند بر سد انرژی فعال سازی غلبه کنند، یک واکنش شیمیایی پیشرفت می کند.
تفاوت حد واسط و حالت گذار
تفاوت زیادی میان حد واسط و حالت گذار وجود دارد. حالت گذار در اصل یک حالت بر روی نمودار انرژی یک واکنش شیمیایی است که بالاترین سطح انرژی را نشان می دهد و بسیار ناپایدار است. در حالی که حد واسط در اصل نوعی ماده است که بیشترین انرژی را برای تبدیل شدن به محصولات یک واکنش دارد. حد واسط در واقع به عنوان کمپلکس فعال نیز شناخته می شود که یک ترکیب شیمیایی است که بالاترین سطح انرژی را برای تبدیل به محصولات دارد.