ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی چیست؟

گروهی از ترکیب های شیمیایی که دارای یک اتم و یا یون در مرکز خود بوده و در اطراف مرکز، دارای مولکول های متصلی به نام لیگاند باشند، ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی نامیده می شوند. اتم و یا یونی که در مرکز ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی قرار می گیرد به طور معمولی فلزی بوده و مرکز کوئوردیناسیون نامیده می شود. به طور غالب بیشتر ترکیب های فلزی و مخصوصاً ترکیب های فلز های واسطه، در دسته ی کمپلکس های کوئوردیناسی جای می گیرند. در این مقاله نشریه جهان شیمی فیزیک به ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی می پردازیم.
نظریه ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی ونر
در اوایل قرن هجدهم میلادی اولین ترکیبی که می توان آن را ترکیب کوئوردیناسی در نظر گرفت، به اکتشاف رسید. این ترکیب نیل فرنگی است. در سال ۱۷۹۸ میلادی با ترکیب کردن دو ترکیب شیمیایی پایدار با یک دیگر، یک ترکیب شیمیایی پایدار و به رنگ زرد توسط تاسر که یک شیمیدان اهل فرانسه بود به وجود آمد. ترکیب هایی که این گونه حاصل دو ترکیب پایدار ساده تر باشند را ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی می نامند. دومین ترکیب کوئوردیناسی نیز که بلورهایی به رنگ بنفش بود در سال ۱۸۵۱ میلادی کشف شد.
با گذشت زمان و کشف ترکیبات بیشتری از این قبیل و پر طرفدار شدن شیمی ترکیب های مدنی، این ترکیبات گسترده تر مورد مطالعه قرار گرفتند. در سال ۱۹۸۳ میلادی دانشمندی به نام ونر با آزمایش های گسترده نظریه ای را ارائه داد که زمینه ای برای تحقیقات هدایت الکتریکی ترکیبات کوئوردیناسی شد. نظریه ونر بیان می کند که بعضی اتم های فلزی و فلزات واسطه دارای دو نوع ظرفیت پیوندی هستند. نوع اول را تعداد الکترون های از دست رفته در زمان ایجاد یون فلزی توصیف می کند و نوع دوم مربوط به پیوند های لیگاند ها و فلز مرکزی است.
عدد کوئوردیناسیون چیست؟
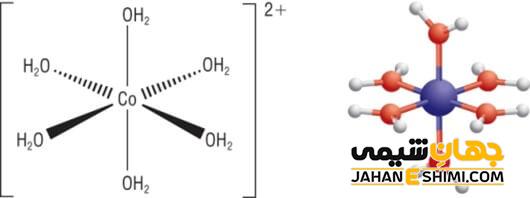
Coordination Number یا همان عدد کوئوردیناسیون در ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی تعداد نقطه هایی است که پیوند های لیگاند های متصل به فلز مرکزی این ترکیبات در آن قرار می گیرند. عدد کوئوردیناسیون وابسته به عوامل مختلف در بازه ی بین ۲ تا ۱۲ در ترکیبات کوئوردیناسی، متفاوت است. حد اقل این عدد در ترکیب های کوئوردیناسی یا کمپلکس های کوئوردیناسی ۲ و حد اکثر آن ۱۲ است. نسبت شعاع مرکز کوئوردیناسیون (اتم و یا یون فلزی مرکزی) به شعاع لیگاند هایی که در اطراف این مرکز و متصل به آن هستند مهم ترین عاملی است که در مقدار عدد کوئوردیناسیون اثر دارد. عدد اکسایش و عدد کوئوردیناسیون در فلزات مختلف قایل محاسبه است. بار کمپلکس یونی برابر با مجموع بار های لیگاند با عدد اکسایش فلز آن کمپلکس است.
یون مس (کوپرو) عدد ۲ و ۴، یون نقره عدد ۲، یون کبالت عدد ۴ و ۶، یون فریک عدد ۶، یون مس (کوپریک) عدد ۴ و ۶، یون نیکل عدد ۶ و ۴، یون طلا عدد ۲ و ۴، یون پلاتین عدد ۴، یون روی عدد ۴، یون آلومینیوم عدد ۴ و ۶ و … نمونه هایی از عدد کوئوردیناسیون مربوط به برخی از یون های پرکاربرد است.
لیگاند چیست؟
در تمامی ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی لیگاند ها نقش مشترکی دارند و این نقش اهدای جفت الکترون ها به اتم فلزی و یا یون مرکزی ترکیب است. لیگاند های تک دانه و یا Monodenate Ligand انواعی هستند که فقط یک جفت الکترون را برای ایجاد پیوند بین خود و مرکز کوئوردیناسیون که یون و یا اتم فلزی مرکزی است، مورد استفاده قرار می دهند. یون های هالید که آنیون هایی تک اتمی هستند، آنیون های چند اتمی مانند یون هیدروکسید و مولکول های ساده و پیچیده مانند آمونیاک و یا متانامین مثال هایی از لیگاند های تک دانه هستند.
از آن جایی که در واکنش اسید و باز پیوند کوالانسی از مدل کوالانسی کوئوردیناسی است، می توان تعداد پیوند های کوالانسی کوئوردیناسی یک یون فلز واسطه در کمپلکس را همان عدد کوئوردیناسیون آن یون فلز واسطه در نظر گرفت. لیگاند های چند دانه هم می توانند دهنده ی بیش از یک جفت الکترون از اتم های مختلف و در نواحی مختلفی از ساختمان هندسی ترکیب کوئوردیناسی باشند. مولکول اتیلن دی آمین به عنوان مثالی برای لیگاند های دو دانه، می تواند دهنده ی دو جفت الکترون باشد.
نام گذاری ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی
شیوه های منحصر به فردی برای نام گذاری ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی وجود دارد. رنگ، خواص مغناطیسی و ایزومر های مختلفی برای کمپلکس های کوئوردیناسی وجود دارد. با توجه به ایت که ترکیبات یا کمپلکس ها کاربرد های متفاوت و ویژه ای نیز دارند، با روش های مختلفی نام گذاری می شوند. فلز ها در کمپلکس های کوئوردیناسی بر اساس نظریه لوییس، اسید لوییس و گیرنده (پذیرنده) ی الکترون هستند.
همچنین با توجه به همین نظریه، لیگاند ها به دلیل این که دهنده ی الکترون به فلز های مرکزی کمپلکس اند، باز لوییس در نظر گرفته می شوند. ترکیبات کوئوردیناسی از کاتیون فلزی مرکز کوئوردیناسیون و یک لیگاند تشکیل می شوند. این ترکیبات یا کمپلکس های کوئوردیناسی می توانند خنثی و یا دارای بار مثبت یا بار منفی باشند.
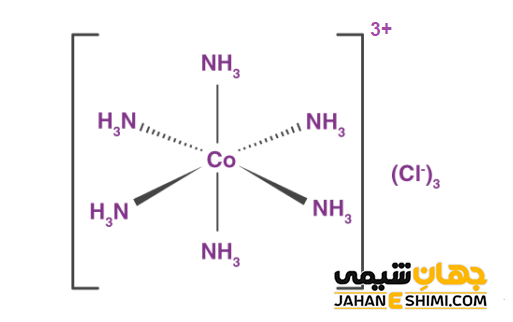
نام گذاری این ترکیبات به این صورت است که اول لیگاند ها را به ترتیب الفبا نام گذاری می کنند. سپس نام فلز کمپلکس آورده می شود. بعد از آن عدد اکسایش فلز به صورت عدد رومی ذکر می شود. برای مثال کمپلکس آنیونی −[CoCl4(NH3)2] و کمپلکس کاتیونی [CO(NH3)6]3+ و کمپلکس خنثی [CoCl3(NH3)3] و همچنین ترکیب کوئوردیناسی K4[Fe(CN)6] را می توان نام برد.
قوانین و نکات در نام گذاری ترکیبات کوئوردیناسی یا کمپلکس های کوئوردیناسی
قانون لیگاندهای آنیونی
قانون اول مربوط به لیگاند های آنیونی است. لیگاند های آنیونی که به –ید در انتهای خود ختم شوند را با –و در انتهای شان تعویض خواهند کرد. به عنوان مثال کلرید، فلوئورید، برومید و اوکسید به ترتیب به کلرو، فلوئورو، برومو و اوکسو تبدیل خواهند شد. –یت و –ات نیز در آنیون ها با –یتو و –اتو جایگزین می شوند. به عنوان مثال، آنیون های نیترات به نیتراتو و نیتریت به نیتریتو بدل خواهند شد.
قاون لیگاندهای خنثی
در مورد لیگاند های خنثی که به عنوان قانون دوم به آن می پردازیم، همان نام عادی شان به کار می رود. مثلاً CO همان کربونیل و یا H2O آکوا خواهد بود. لیگاند های چند دانه نیز تابع همین قوانین هستند. تعداد لیگاند های کمپلکس را هم با پیشوند های دی، تری، تترا و… مشخص خواهند کرد. اما در لیگاند های چند دانه ای دارای پیشوند برای مشخص کردن تعداد، نام لیگاند همراه با بیس، تریس، تتراس و… در داخل پرانتز آورده می شود.
قانون فلزات
در قانون نام گذاری فلزات نیز از نام قرار دادی و در برخی لاتین فلزات همراه با عدد اکسایش آن ها به صورت عدد رومی در داخل پرانتز استفاده می شود. در کمپلکس های آنیونی به انتهای نام فلزات –ات افزوده می شود. مثلاً کمپلکس [Cr(OH)4] یون تترا هیدروکسوکرومات (III) نام گذاری می شود.
نکته
در نام گذاری ترکیبات کوئوردیناسی باید دقت کرد که اول نام کاتیون و سپس نام آنیون آورده می شود. در مورد نام گذاری نمک ها نیز همین قانون است. به عنوان مثال NaCl با نام سدیم کلرید نامیده می شود.
نوشتن فرمول ترکیبات کوئوردیناسی
در نوشتن فرمول ترکیبات مورد مطالعه در این مقاله، قانونی متفاوت با نام گذاری آن ها باید رعایت شود. در این رابطه، اول نام فلز و سپس نام لیگاند نوشته می شود. ترتیب قرار گرفتن نوع لیگاندها در فرمول نیز به این صورت است که لیگاندهای خنثی بعد از لیگاندهای آنیونی قرار می گیرند. در صورت وجود بیشتر از یک لیگاند آنیونی و یا خنثی، در نوشتن، باید حروف الفبا در نظر گرفته شود. اگر یون موجود در این ترکیبات، یک عنصر باشد، نیازی به پیشوند برای نشان دادن تعداد اتم ها نیست. ولی به دلیل وارد کردن حتمی نام آن ها در فرمول، نشان دادن آن ها با موازنه بار کلی ترکیب انجام می شود.



















