در علم شیمی، بار قراردادی (Formal Charge) یا بار اسمی به باری گفته می شود که به یک اتم در یک مولکول یا یون نسبت داده شده است. البته با این فرض که الکترون ها در تمام پیوند های شیمیایی (صرف نظر از الکترونگاتیویته نسبی آنها) به طور مساوی بین اتم ها تقسیم و به اشتراک گذاشته شده اند. به بیان ساده تر، فرض کنید که اتم های درگیر در یک پیوند شیمیایی، به شکل یکسان در جفت الکترون پیوندی سهیم باشند. همانطور که می دانید، این فرض، در اغلب موارد صحیح نیست، بنابراین بار های قراردادی را باید با احتیاط استفاده کرد. لازم به ذکر است که این بار (با توجه به نامش)، تنها به طور قراردادی در نظر گرفته می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی بار قراردادی و نحوه محاسبه آن پرداخته می شود. لطفا با ما همراه باشید.
معادله بار قراردادی
بار قراردادی برای هر اتم در یک مولکول یا یون را از طریق فرمول زیر می توان بدست آورد:
FC = V – N – B/2
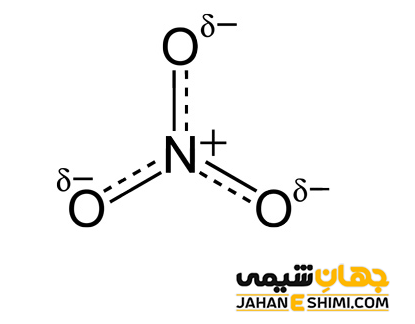
در این رابطه، V، نشان دهنده تعداد الکترون های لایه ظرفیت اتم منفرد یا خنثی (الکترون هایی که در بیرونی ترین مدار الکترونی اتم یا همان لایه والانس وجود دارند)، N نشان دهنده تعداد الکترون های غیر پیوندی اتم و B نشان دهنده تعداد الکترون های پیوندی اتم (تعداد کل الکترون هایی که اتم به در پیوند با سایر اتم ها در مولکول یا یون به اشتراک گذاشته است) می باشند. به عنوان مثال، محاسبه بار قراردادی اتم کربن در مولکول CH۴ و اتم نیتروژن را در یون –NO۳ در نظر بگیرید.
اتم کربن در مولکول متان، FC = 4 – 0 – (8 ÷ ۲) = ۰
اتم نیتروژن در یون نیترات، FC = 5 – 0 – (8 ÷ ۲) = +۱
تفسیر بار قراردادی
همانگونه که بیان شد، بار اسمی، در واقع بار الکتریکی است که به هر اتم در یک ترکیب اختصاص داده می شود. با کمک این بار نسبی، می توان ظرفیت اتم را تعیین و همچنین توجیه کرد. ظرفیت اتم مورد نظر در تشکیل پیوند کووالانسی، برابر است با تعداد الکترون هایی که آن اتم باید بگیرد تا به آرایش الکترونی گاز نجیب بعد از خود (حالت اکتت) دست یابد. از این جهت، عناصر گروه های مختلف معمولا به چهار الکترون (چهار ظرفیتی مانند عناصر گروه کربن)، سه الکترون (سه ظرفیتی مانند عناصر گروه نیتروژن)، دو الکترون (دو ظرفیتی مانند عناصر گروه اکسیژن) و یک الکترون (یک ظرفیتی مانند هالوژن ها) نیاز دارند تا به آرایش الکترونی گاز نجیب برسند.
به بیان دیگر، از بار قرار دادی اغلب جهت توجیه و تفسیر موقعیتی استفاده می شود كه در آن موقعیت،یک عنصر در تعدادی پیوند (متفاوت از تعداد پیوند کووالانسی كه از آن عنصر انتظار می رود) شركت کرده باشد. به عنوان نمونه در مولكول آمونیاك، اتم نیتروژن در گروه پانزده جدول تناوبی عناصر قرار دارد. با توجه به آرایش الکترونی نیتروژن مشخص می شود که این اتم، پنج الكترون در لایه ظرفیت خود دارد. سه تا از الكترون های لایه والانس در اوربیتال های P به صورت نیمه پر قرار گرفته اند. بنابراین از اتم نیتروژن انتظار داریم كه در تشكیل سه پیوند کووالانسی با اتم های دیگر شركت كند.
در مولكول آمونیاك، این انتظار برآورده می شود، اما در مولكول +NH۴، اتم نیتروژن با چهار اتم هیدروژن، درگیر پیوند کووالانسی می شود که کاملا برخلاف انتظارمون از اتم نیتروژن است. به منظور تفسیر و توجیه این امر غیر عادی، از بار قراردادی استفاده می شود.

نگاهی دقیق تر به بار اسمی
علاوه بر موارد گفته شده، یک اتم مشخص همچنین می تواند در ترکیبات متفاوت و یا حتی در یک ترکیب ظرفیت های مختلفی داشته باشد. به عنوان مثال، اتم نیتروژن را در نظر بگیرید. این اتم در یون آمید (–NH۲) دو ظرفیتی، در مولکول آمونیاک (NH۳) سه ظرفیتی و در کاتیون آمونیوم (+NH۴) چهار ظرفیتی است. همچنین، اتم نیتروژن در یون هیدرازونیم (+NH۲ NH۳) هر دو ظرفیت ۳ و ۴ را نشان می دهد. علت این اختلاف در حقیقت به بارهای اسمی متفاوت اتم نیتروژن مرتبط است.
بار اسمی نیتروژن در مولکول آمونیاک صفر می باشد (یعنی تعداد الکترون های لایه والانس اتم نیتروژن در این مولکول شبیه اتم نیتروژن آزاد، پنج است). در آنیون آمید، بار قراردادی اتم نیتروژن ۱- است. در واقع می توان این چنین تصور کرد که آرایش الکترونی نیتروژن در یون آمید شبیه اتم اکسیژن خنثی است. بنابراین از آنجاییکه از نظر تعداد الکترون های لایه والانس، در جدول تناوبی عناصر یک واحد به سمت جلو حرکت کرده ایم، پس یک واحد ظرفیت کاهش می یابد. در این صورت، ظرفیت –N همانند اتم اکسیژن دو است. به همین ترتیب، به خوبی می توان فهمید که چرا اتم نیتروژن با بار اسمی ۱+ در کاتیون آمونیم، همان ظرفیت اتم کربن با بار قراردادی صفر در متان را نشان داده است.
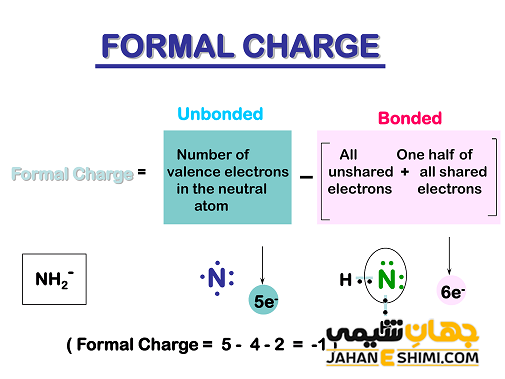
اتم کربن نیز عنصر بسیار مهمی برای شیمیدانان محسوب می شود. به طور معمول عنصر کربن، چهار پیوند کووالانسی تشکیل می دهد. در این صورت، کربن عنصری چهار ظرفیتی می باشد، اما استثناهایی نیز وجود دارند. به عنوان مثال، یک اتم کربن در کربوکاتیون و کربانیون، به ترتیب بار اسمی مثبت یا منفی را نشان می دهد. همچنین اتم کربن در رادیکال کربن و کاربن (Carbene) نیز بار قراردادی برابر با صفر دارد.
تفسیر بار قراردادی کاتیون آمونیم
همانطور که می دانید، در تشکیل پیوند های کووالانسی، دو الکترون پیوندی توسط دو اتم دو طرف پیوند به اشتراک گذاشته می شود. در حالیکه، در تعدادی از پیوند های کووالانسی، هر دو الکترون اشتراکی تنها به وسیله یکی از دو اتم درگیر در پیوند تامین می شوند. به عنوان نمونه، در واکنش میان مولکول آمونیاک با یک پروتون (+H)، جفت الکترون غیر پیوندی اتم نیتروژن در مولکول آمونیاک، به منظور تشکیل یک پیوند کووالانسی جدید استفاده می شوند.
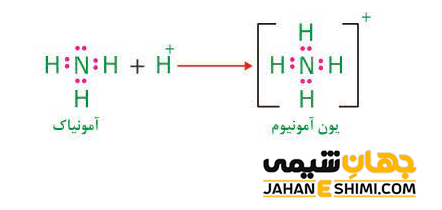
به پیوندی که از این طریق تشکیل شود، پیوند داتیو یا پیوند کووالانسی- کئوردینانسی گفته می شود. دقت داشته باشید که این نامگذاری زیاد درست نیست. زیرا با برچسب زدن پیوند کووالانسی– کئوردینانسی به یک پیوند خاص، این پیوند از سایر پیوند های کووالانسی متفاوت می دانید. در حالیکه، قائل شدن چنین تمایز و تفاوتی، توجیه پذیر نیست. تمامی الکترون ها از هر منبعی که تامین شده باشند، شبیه یکدیگر هستند. بنابراین، چهار پیوند نیتروژن- هیدروژن کانیون آمونیوم یکسان بوده و تشخیص آنها از یکدیگر ممکن نیست.
با توجه به موارد گفته شده در بالا، مشخص می گردد که تعداد پیوند های کووالانسی اتم نیتروژن در مولکول آمونیوم با تعدادی که از آن انتظار می رود، تفاوت دارد. از آنجاییکه اتم نیتروژن پنج الکترون در لایه والانس خود دارد، بنابراین پیش بینی می شود که با اشتراک گذاشتن سه جفت الکترون به ساختار اکتت یا هشت تایی برسد. در حالیکه در کاتیون آمونیوم در چهار پیوند کووالانسی شرکت کرده است. این مشاهده را به کمک بار اسمی می توان توضیح داد.
ساختار لوئیس و بار قراردادی
در مقالات پیشین نشریه جهان شیمی فیزیک، به چگونگی رسم ساختار لوئیس پرداخته شده است. جالب است بدانید که در هنگام رسم ساختار لوویس،گاهی اوقات مواردی پیش می آید که امکان رسم دو و یا چند ساختار به طور همزمان برای یک مولکول امکان پذیر است. در چنین حالتی، تعیین بار اسمی اتم ها، برای انتخاب بهترین ساختار لوییس (یا ساختار غالب) بسیار مفید است.
به عبارت ساده تر، بار قراردادی در حقیقت تفاوت میان تعداد الکترون های لایه آخر یک اتم در حالت آزاد خنثی و تعداد الکترون های نسبت داده شده به آن اتم در ساختار لوئیس است. اگر این دو از نظر تعداد الکترون مساوی باشند، اتم مورد نظر در ساختار لوئیس، بار رسمی صفر خواهد داشت. حال اگر تعداد الکترون های اطراف اتم مورد نظر در ساختار لوییس کمتر از تعداد الکترون های لایه والانس همان اتم در حالت آزاد باشند، در اینصورت، بار مثبت هسته به طور کامل خنثی نشده است، پس به تعداد کمبود الکترون ها، به اتم مورد نظر بار مثبت نسبت داده خواهد شد. زمانیکه تعداد الکترون های دور اتم مورد بررسی، بیشتر از الکترون های لایه ظرفیت اتم در حالت آزاد باشد، به تعداد الکترون های اضافی، به اتم مورد نظر بار منفی اختصاص داده می شود.
بنابراین جهت تعیین بهترین ساختار لوئیس و یا حتی رسم بهترین ساختار رزونانسی برای مولکول ها، بهتر است ساختاری انتخاب شود که بار قراردادی هر یک از اتم ها در ساختار مورد نظر تا جایی که امکان دارد نزدیک به صفر باشد.

تعیین بار اسمی
براي محاسبه بار قراردادی هر اتم در يك ساختار لوئیس می توان از رابطه زير استفاده نمود :
بار قراردادی اتم = تعداد الكترون های لايه ظرفيت اتم در حالت آزاد – (تعداد الكترون های غير مشترك + نصف تعداد الكترون های مشترك).
به عنوان مثال، با استفاده از فرمول بالا، بار اسمی اتم های مولکول POCl۳ را بدست آورید.
بار قراردادی اتم فسفر:
FC = 5 – (۰ + ½ (۸)) = +۱
بار قراردادی اتم اکسیژن
FC = 6 – (۶ + ½ (۲)) = –۱
بار قراردادی هر اتم کلر
FC = 7 – (۶ + ½ (۲)) = ۰
بنابراین ساختار نهایی لوویس مولکول POCl۳ به شکل زیر است.

قوانین تعیین بار قراردادی
دقت داشته باشید که به منظور تعیین بار قراردادی یک ترکیب، باید به چند نکته زیر دقت کرد.
- توجه داشته باشید که جمع ریاضی بارهای قراردادی اتم ها در يك تركيب خنثي برابر با صفر و در يك يون برابر با بار آن یون می باشد.
- توزيع بار رسمی مثبت و منفي بایستی با الكترونگاتيويته اتم ها هماهنگ باشد. در نتیجه بار اسمی مثبت به اتم با الكترونگاتيويته كمتر و بار اسمی منفي به اتم با الكترونگاتيویته بيشتر نسبت داده می شود.
- اتمی که تعداد پیوند های آن در یک ساختار لوئیس پیشنهادی، برابر تعدادی است که بر مبنای شماره گروه آن اتم پیش بینی شده است، بار قراردادی ندارد (مانند اتم کلر). به این دسته از اتم ها، اتم های بدون بار قراردادی گفته می شود. بهتر است که ساختار لوییس یک مولکول یا یون به نحوی رسم گردد که تعداد پیوند های کووالانسی هر اتم همان باشد که بر اساس شماره گروه از آن انتظار می رود. لازم به ذکر است که این کار همیشه امکان پذیر نیست.
- علامت بار اسمی اتم هایی که در یک ساختار لوویس با همدیگر پیوند دارند، نباید یکسان باشد. دافعه الکتریکی میان بار های همنام، باعث شکسته شدن پیوند شیمیایی بین دو اتم خواهد شد. در واقع، ساختار های لوئیسی که در آنها قاعده بار مجاور رعایت نشده است، ساختار صحیحی نمی باشند.
- بهترین ساختار لوویس ساختاری است که بار اسمی هر کدام از اتم ها در آن صفر و یا در صورت امکان کوچک باشد.
ساختار لوویس و FC یون آمونیوم
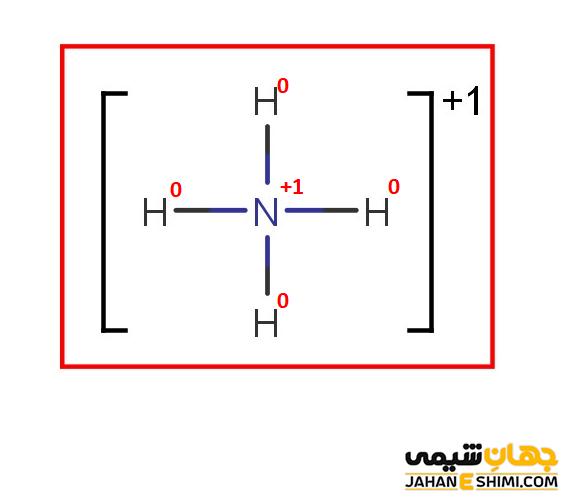
کاتیون +NH۴ را در نظر بگیرید. برای تعیین تعداد الکترون های پیوندی و غیر پیوندی هر اتم در مولکول مورد نظر، ساختار لوئیس مورد استفاده قرار می گیرد. ساختار لوییس برای یون آمونیوم به شکل زیر است.
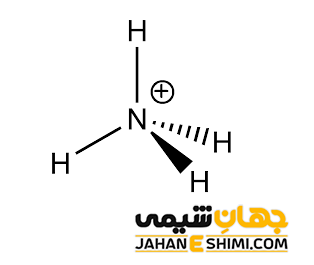
همانطور که می دانید تعداد الکترون های ظرفیتی اتم نیتروژن برابر با ۵ است. در اینجا اتم نیتروژن با چهار اتم هیدروژن پیوند کووالانسی برقرار کرده است و قاعده اکتت برای آن رعایت گردیده است. بنابراین اتم نیتروژن هشت الكترون به اشتراك دارد (یعنی تعداد الکترون های پیوندی ۴ تاست). در آمونیوم، اتم نیتروژن هیچ الكترون ناپیوندی (الكترونی كه در پیوند شركت نكرده است) ندارد. درنتیجه با استفاده از فرمول بار قراردادی داریم:
بار قراردادی اتم نیتروژن:
FC = 5 – (۰ + ½ (۸)) = +۱
هر اتم هیدروژن نیز در لایه ظرفیت خود تنها یک الکترون دارد. از طرفی، فقط یک پیوند با اتم نیتروژن می دهد و فاقد الکترون غیر پیوندی است. در اینصورت، بار قراردادی در هر اتم هیدروژن برابر است با:
FC = 1 – (۰ + ½ (۲)) = ۰
بنابراین، بار قراردادی هر اتم در یون آمونیوم و ساختار نهایی لوئیس آن به شکل زیر است: