
در مبانی باتری، اصطلاح باتری (battery) به مجموعه ای از یک یا چند سلول الکتروشیمیایی گفته می شود که با انجام واکنش های شیمیایی می تواند جریان الکتریکی را در درون مدار تولید کند. باتری ها به منظور تامین انرژی مورد نیاز دستگاه های الکتریکی همچون تلفن همراه، ماشین حساب، لپتاپ، رادیو، ساعت، سمعک، ضربان ساز قلب، چراغ قوه، اسباب بازی ها و سایر وسایل الکترونیکی کاربرد دارند. به عبارت دیگر، هیچ یک از این وسایل، بدون باتری قابل استفاده نیستند. در گذشته، واژه باتری فقط برای دستگاه هایی با چند سلول الکتروشیمیایی بکار برده می شد، اما امروزه، این کلمه همچنین برای دستگاه هایی که تنها از یک سلول ساخته شده اند نیز مورد استفاده قرار می گیرد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی باتری و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
باتری چیست
برای نخستین بار، اصطلاح باتری در سال ۱۷۴۹ میلادی توسط بنجامین فرانکلین (Benjamin Franklin)، جهت توصیف یک سری خازن که به منظور انجام آزمایشات الکتریکی به یکدیگر وصل کرده بود، بکار برده شد. این اصطلاح، سپس برای تمام سلول های الکتروشیمیایی که جهت تامین نیروی الکتریکی به یکدیگر متصل شده اند، مورد استفاده قرار گرفت. در سال ۱۷۸۹ میلادی، الساندرو ولتا (Alessandro Volta) دانشمند ايتاليايی برای اولین بار يک پيل به نام پيل ولتايی قابل حمل ساخت که باتری های امروزی در حقیقت همان پيل ولتايی در ظاهری جديد و پيشرفته تر هستند.

باتری ها مولد هایی هستند که با انجام واکنش های شیمیایی می توانند انرژی شیمیایی را به انرژی الکتریکی تبدیل نمایند. عمر باتری به مشخصات ساختاری و همچنین نوع استفاده از آن بستگی دارد و ممکن است بین چند ساعت تا حتی چند هفته باشد.
تمامی باتری ها از سه جز اصلی، یک آند (Anode)، یک کاتد (Cathode) و یک الکترولیت (Electrolyte) تشکیل شده اند. در باتری ها، سر مثبت کاتد و سر منفی آنها آند است. جهت جلوگیری از اتصال کاتد با آند، بیشتر از یک جدا کننده بهره می برند. در نهایت و برای نگه داشتن این سه جز در کنار هم، نوعی پوشش استفاده می شود.
کاتد و آند
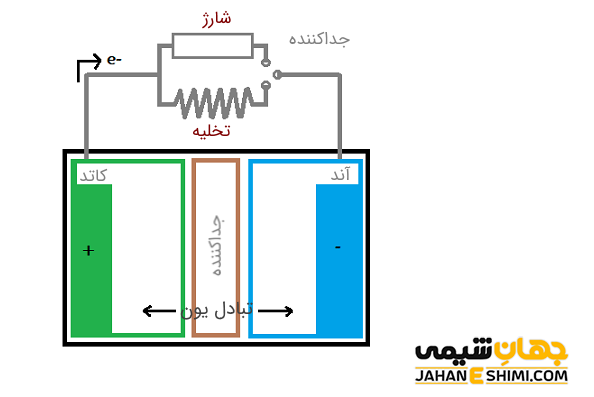
کاتد و آند به وسیله جریان الکتریکی تعریف می شوند و در حقیقت نوعی الکترود هستند. الکترود ها رسانا هایی محسوب می شوند که از طریق آنها، جریان الکتریسیته وارد یک مدار شده و همچنین از آن خارج می شود. قطبی از باتری که با علامت منفی مشخص می شود، منبع الکترون بوده که این الکترون ها از طریق یک مدار الکتریکی خارجی به سمت قطب مثبت آن جریان دارند. به بیان ساده تر، در مبانی باتری به الکترود منفی، آند و به الکترود مثبت کاتد گفته می شود. لازم به ذکر است که جهت حرکت الکترون ها، صرف نظر از نوع سلول و یا شیوه عملیاتی آن، همیشه از سمت آند به سمت کاتد است.
کاتد در یک مجموعه دو الکترودی در داخل یک محلول الکترولیت، الکترودی است که الکترون می گیرد. به عبارت دیگر، جریان الکتریکی از آن خارج می شود (جریان الکتریکی به طور قراردادی عکس جهت حرکت الکترون در نظر گرفته می شود). از این جهت، در باتری هایی که در حال شارژ شدن باشند، کاتد قطب منفی است، در حالیکه در باتری در حال دشارژ شدن (در حال مصرف شدن) قطب مثبت خواهد بود. از طرف دیگر، آند در یک مجموعه دو الکترودی در درون یک محلول الکترولیت، الکترودی است که الکترون از دست می دهد. به بیان دیگر، جریان الکتریکی به آن وارد می شود. از این رو، در باتری هایی که در حال شارژ شدن باشند، آند قطب مثبت است، در حالیکه در باتری در حال دشارژ شدن (در حال مصرف شدن) قطبی منف خواهد بود.
الکترولیت
در علم شیمی، الکترولیت به ماده حل شده یک محلول آبی گفته می شود که رسانایی الکتریکی آن از آب خالص بیشتر باشد. به بیان دیگر، این ماده باعث آزاد شدن یون های حل شده در حلال می گردد که می تواند به حالت ژل یا مایع باشد. در مبانی باتری ها، از الکترولیت ها به عنوان منبع شیمیایی جهت ایجاد جریان الکتریسیته بهره می برند. در عین حال، الکترولیت مانع از جریان الکترون بین قطب های آند و کاتد باتری ها می شوند. با این کار سبب جریان راحت تر الکترون ها در مدار خارجی خواهد شد. با توجه به نوع جریان الکتریکی مورد نیاز (ضعیف یا قوی)، باتری ها از الکترولیت های مختلفی استفاده می کنند. از رایج ترین الکترولیت ها می توان به سدیم کلراید، سدیم استات، اسید نیتریک، اسید سولفوریک، اسید هیدروکلریک و غیره اشاره کرد.
جداکننده ها
جدا کننده ها در حقیقت مواد متخلخلی محسوب می شوند که مانع از اتصال کوتاه در درون باتری (اتصال آند و کاتد به یکدیگر) خواهند شد. دقته داشته باشید که این مواد با هیچ یک از اجزای باتری مانند آند، کاتد و یا الکترولیت واکنش شیمیایی نمی دهند. جداکننده ها از مواد سازنده مختلفی همچون پنبه، پلی استر، نایلون، لایه های پلیمر مصنوعی و مقوا ساخته می شوند.
محفظه یا پوشش
همانطور که بیان شد، اغلب باتری ها نیاز به پوششی دارند تا اجزای مختلف آنها در کنار هم نگه داشته شوند. این محفظه در واقع، تنها یک ساختار مکانیکی است که با هدف نگه داشتن اجزای داخلی یک باتری، مورد استفاده قرار می گیرد. به بیان دیگر، به منظور ایزوله کردن سلول الکتروشیمیایی از محیط بیرون، فراهم کردن ایمنی و همچنین راحتی در استفاده، سلول الکتروشیمیایی را درون یک بسته یا کیس خارجی (case) قرار می دهند. در ساخت پوشش باتری ها می توان از فولاد، پلاستیک، کیسه های ورقه ای پلیمر نرم و سایر مواد استفاده کرد.
مبانی عملکرد باتری ها
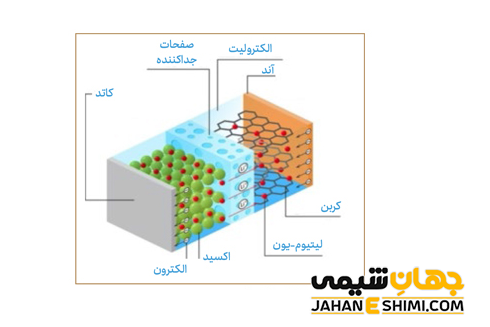
همانطور که بیان شد، باتری ها از یک یا چند سلول الکتروشیمیایی کوچک داخلی تشکیل شده اند. همچنین هر سلول دارای دو نیم سلول است. باتری ها برای کارکرد، به چندین واکنش شیمیایی نیاز دارند. در حقیقت، حداقل یک واکنش شیمیایی در درون یا نزدیکی آند و یک یا چند واکنش شیمیایی در درون یا نزدیکی کاتد اتفاق می افتد. انتقال یون ها میان واکنش های انجام شده در قطب های آند و کاتد بر عهده الکترولیت است. به بیان ساده تر، مبانی باتری ها بر اساس یک واکنش شیمیایی (واکنش اکسایش- کاهش) کار می کند. لازم به ذکر است که نیم واکنش اکسایش، در آند (الکترون های اضافی تولید می شود) و نیم واکنش کاهش، در کاتد (استفاده از الکترون های اضافی) رخ می دهد.
دو الکترود کاتد و آند در الکترولیت غوطه ور می باشند. در اینجا، یون ها در اثر واکنش شیمیایی اکسایش، میان الکترولیت و آند آزاد می شوند. الکترون ها در محلول الکترولیت حرکت می کنند. با حرکت الکترون ها، جریان الکتریکی ایجاد خواهد شد. در واقع با انباشته شدن الکترون ها در اطراف آند، آنها از طریق سیمی که میان آند و کاتد گذاشته شده است، به سمت کاتد حرکت می کنند. این حرکت الکترون ها سبب بوجود آمدن جریانی الکتریکی می گردد که در نهایت می تواند برق دستگاه های متصل به این سیم را تامین نماید.
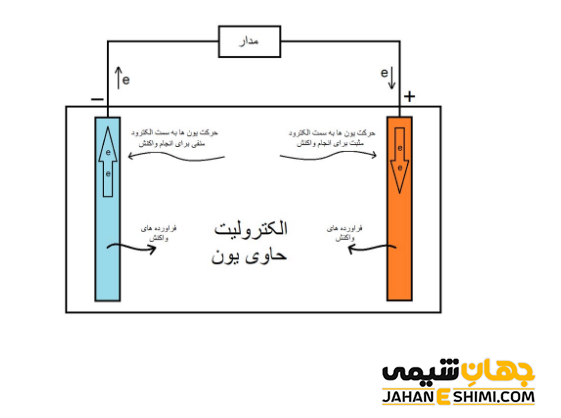
نگاهی دقیق تر به چگونگی عملکرد باتری ها
جالب است بدانید که دو الکترود باتری، از دو ماده مختلف ساخته می شوند. در واقع، رسانایی الکتریکی این دو ماده باید حتما با هم فرق داشته باشد. بدین شکل که یکی از دو الکترود، تمایل به جذب الکترون و دیگری تمایل به از دست دادن الکترون داشته باشند. واضح است که اگر الکترودها جنس یکسان و مشابه ای داشته باشند، هیچ جریانی شارش پیدا نخواهد کرد.
به بیان بهتر، الکترون های تشکیل شده به طرف الکترود منفی حرکت می کنند. در این حالت، یون های مثبت در درون الکترولیت جابهجا می شوند. پس الکترون ها از طریق الکترود منفی و همچنین سیم رسانا در مدار شارش پیدا خواهند کرد. این الکترون های جریان یافته در مدار الکتریکی، به الکترود مثبت وارد می شوند. در این صورت، جذب یون های مثبت موجود در الکترولیت می شوند. همانطور که مشخص است، الکترون و یون ها به وسیله واکنش های شیمیایی که در الکترولیت اتفاق می افتد در جریان اند.
انواع مختلف مبانی باتری ها
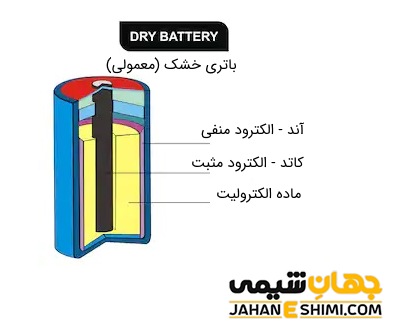
بر اساس نیاز مورد نظر، انواع مختلف باتری ها در شکل ها، ابعاد، ولتاژ و یا ظرفیت های متفاوت وجود دارند. باتری ها را از نظر حالت الکترولیت به دو دسته باتری خشک (سلول خشک) و باتری تر تقسیم می کنند. الکترولیت باتری خشک (dry) جامد است مثل باتری های قلمی. در حالیکه، باتری تر (wet) الکترولیت مایع دارد، مانند باتری خودروها. جالب است بدانید که امروزه نوعی باتری به بازار آمده که الکترولیت آن، نه کاملا جامد است و نه مایع. الکترولیت این دسته از باتری ها، ژل مانند است. این باتری ها با نام باتری با مراقبت کم نیز نامیده می شوند. احتمالا بتوان این دسته را در گروه باتری های خشک قرار داد.

به طور کلی، معمولا باتری ها را به دو نوع باتری اولیه و ثانویه تقسیم می کنند. در عین حال در مبانی باتری ها می توان آنها را به چهار دسته اصلی پیل اولیه، پیل ثانویه، پیل سوختی و پیل یدک نیز تقسیم بندی کرد.
مبانی باتری های غیر قابل شارژ (یکبار مصرف)
باتری های غیر قابل شارژ به عنوان باتری های شارژ نشدنی، باتری های اولیه، پیل اولیه و باتری خشک (سلول خشک) نیز شناخته می شوند. همانطور که از نامشان پیداست، این باتری ها قادر به شارژ الکتریکی نمی باشند، بنابراین یک بار استفاده و در نهایت دشارژ می شوند. به بیان ساده تر، زمانیکه انرژی ذخیره شده آنها، به طور کامل استفاده گردد، دوباره نمی توان از آنها بهره برد و دور انداخته می شوند. آنها به وسیله هیچ منبع خارجی نمی توانند برای بار دوم انرژی ذخیره کنند. به همین دلیل است که به آنها، یک بار مصرف می گویند. از جمله انواع باتری های شارژ نشدنی می توان به باتری قلیایی، روی- کربن، پیل های نقره اکسید، پیل های لیتیومی و پیل های روی- هوا اشاره کرد.
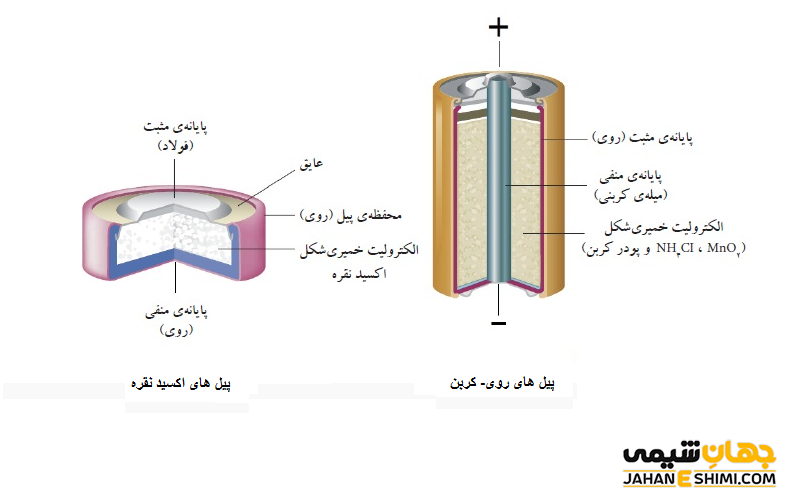
کاربرد های باتری های اولیه
این نوع از باتری ها در بسیاری از دستگاه های الکترونیکی قابل حمل کاربرد دارند. از جمله می توان به ساعت دیواری، ساعت الکتریکی، رایانه های شخصی، ضربان سازهای قلب، وسایل خانگی کوچک، پخش کننده های صوتی، رادیو، دستگاه هایIOT، چراغ های قابل حمل، چراغ قوه، وسایل پزشکی، اسباب بازی ها، ابزارهای دقیق و …. اشاره کرد.

مبانی باتری های قابل شارژ
باتری های قابل شارژ (Rechargeable battery) به عنوان باتری های شارژ شدنی، باتری شارژی، باتری های ثانویه و پیل ثانویه نیز شناخته می شوند. همانطور که از نامشان پیداست، این نوع از باتری ها را می توان با اتصال به شارژ، چندین بار مورد استفاده قرار داد. به بیان دیگر، بعد از اتمام ظرفیتشان، قابلیت شارژ دوباره را دارند. این کار با با معکوس کردن جریان الکتریکی در درون باتری انجام می شود.
باتری های ثانویه را می توان به دو دسته کلی اسیدی و بازی تقسیم کرد. از جمله انواع باتری های شارژ نشدنی می توان به باتری های سرب- اسید، لیتیوم- یون، نیکل- هیدرید فلز و نیکل- کادمیوم اشاره کرد. لازم به ذکر است که تعداد دفعات شارژ در این نوع باتری ها، محدود است. یعنی بعد از تعداد معینی عمل شارژ و دشارژ، باتری شارژ شدنی کارایی اولیه خود را از دست داده و در نتیجه دچار افت ولتاژ خواهد شد.

کاربرد های باتری های ثانویه
این نوع از باتری ها در ساعت هوشمند، گوشی هوشمند، باتری های نیروگاهی، باتری های منابع تغذیه، زیردریایی، اتومبیل، لیفتراک، موتورسیکلت، سامانه های ریلی و مترو، سامانه های حفاظتی، روشنایی و امنیتی، سامانه های کنترلی، دستبند سلامتی، دوربین، باتری خورشیدی، باتری مخابراتی، آنتن های مخابراتی، ضربان ساز مصنوعی و …. کاربرد دارند. علاوه بر آن، باتری های مورد استفاده در پروژه های نفت، گاز و پتروشیمی، باتری های مورد استفاده در upsو باتری های مورد استفاده در کاربرد های نظامی نیز از دسته باتری های قابل شارژ هستند.

اصطلاحات رایج مرتبط با مبانی باتری ها
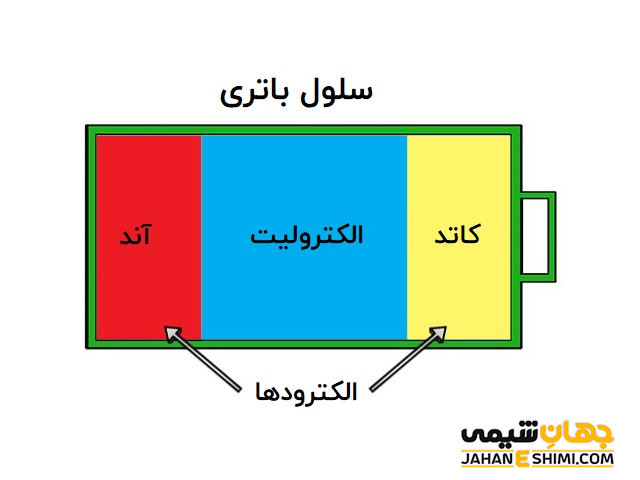
سلول باتری
کلمه سلول، به مجموعه یک آند و کاتد که به وسیله الکترولیت جدا شده اند، گفته می شود. این سلول برای تولید یک ولتاژ و جریان استفاده می شود.
ولتاژ اسمی
ولتاژی که توسط شرکت سازنده برای یک باتری معرفی شده است را ولتاژ اسمی می نامند. برای مثال، باتری های آلکالین AA و سلول های لیتیوم- یون (یا لیتیوم- پلیمر) به ترتیب دارای ولتاژ اسمی ۱/۵ و ۷/۳ ولت هستند.
ظرفیت باتری
ظرفیت باتری به میزان بار الکتریسیته قابل دریافت باتری در یک ولتاژ معین و مشخص گفته می شود. دقت داشته باشید که ظرفیت اغلب باتری ها را بر اساس واحد های آمپر- ساعت (Ah) یا میلی آمپر- ساعت (mAh) بیان می کنند.

نرخ شارژ- نرخ تخلیه شارژ
جهت نشان دادن بهتر ویژگی های بسیاری از باتری ها، به ویژه باتری های قدرتمندی همچون لیتیوم- یونی، جریان تخلیه بار الکتریکی را به شکل نرخ شارژ یا C-Rate نشان می دهند. لازم به ذکر است که نرخ شارژ- نرخ تخلیه شارژ باتری با حداکثر ظرفیت آن باتری، مرتبط است.
باتری مرده (تمام شده)
مواد شیمیایی موجود در کاتد یا آند باتری ها، در نهایت به حالت تعادل می رسند. در این وضعیت، مواد شیمیایی مصرف شده و دیگر تمایلی به انجام واکنش نشان نمی دهند. در این صورت، جریان الکتریسیته بیشتری به وسیله باتری ها تولید نخواهد شد و در این مرحله، باتری در اصطلاح مرده یا تمام شده است.



















