
در ترمودینامیک، انرژی آزاد گیبس یا انرژی گیبس (Gibbs free energy or Gibbs energy) به کمیت ترمودینامیکی گفته می شود که میزان خود به خود انجام گرفتن یک واکنش شیمیایی را نشان می دهد. در واقع، از آن می توان برای محاسبه حداکثر کار برگشت پذیری که ممکن است به وسیله یک سیستم ترمودینامیکی در دما و فشار ثابت انجام شود، بهره برد. به بیان دیگر، تابع گیبس کمیتی است که آنتالپی، آنتروپی و دما را به یکدیگر ربط می دهد. این کمیت را با نماد G نمایش می دهند. انرژی گیبس با نام تابع گیبس نیز شناخته می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی انرژی آزاد گیبس پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه
مقداری که انرژی آزاد نامیده می شود، در حقیقت جایگزینی پیشرفته تر و دقیق تر برای واژه منسوخ شده میل است. کلمه میل، توسط شیمیدانان در سال های اولیه ایجاد شیمی فیزیک جهت توصیف نیرویی که سبب انجام واکنش های شیمیایی شده بود مورد استفاده قرار می گرفت.
در سال ۱۸۷۳ میلادی، فیزیکدان آمریکایی جوزایا ویلارد گیبس (Josiah Willard Gibbs) روشی جهت نمایش هندسی خواص ترمودینامیکی مواد شیمیایی را با استفاده از سطوح منتشر کرد. در این روش، اصول معادله جدید خود را که قادر به پیش بینی یا تخمین تمایلات فرآیند های مختلف طبیعی در حالتیکه سیستم ها در تماس با هم هستند را مطرح کرد. گیبس با مطالعه برهمکنش مواد همگن در تماس با یکدیگر، یعنی اجسام متشکل از قسمتی جامد، قسمتی مایع و قسمتی از بخار و همچنین به کمک نمودار سه بعدی حجم- آنتروپی- انرژی داخلی، توانست سه حالت تعادل را تعیین کند. این سه حالت تعادل، یعنی ضرورا پایدار، خنثی و ناپایدار بودند. به علاوه مشخص کرد که آیا این حالت ها با گذر زمان تغییراتی در پی خواهند داشت یا خیر.

به عبارت دیگر، گیبس با تلفیق سه فاکتور آنتالپی، آنتروپی و دما، توانست کمیتی را به نام انرژی آزاد معرفی کند. همچنین برای این کمیت معادله ای ارائه داد که بعد ها به افتخار تلاش هایش، این انرژی را انرژی آزاد گیبس نامیدند. گیبس این انرژی را به صورت فوق بیان کرد: بزرگترین مقدار کار مکانیکی خواهد بود که می توان آن را از میزان معینی از یک ماده شیمیایی خاص با شرایط اولیه داده شده، بدست آورد. در واقع این مقدار کار، بدون افزایش حجم کل سیستم، بدون انتقال گرما به داخل سیستم و یا حتی ورود انرژی از خارج سیستم محاسبه کرد.
انرژی آزاد هلمولتز
پس از آن، در سال ۱۸۸۲ میلادی، فیزیکدان آلمانی یعنی هرمان فون هلمولتز (Hermann von Helmholtz) توانست میل ترکیبی را به عنوان بزرگترین مقدار کاری که می تواند در صورت انجام واکنش به روش برگشت پذیر (به عنوان مثال، کار الکتریکی در یک سلول برگشت پذیر) انجام شود را بدست آورد. این انرژی را به افتخار وی، انرژی آزاد هلمولتز با نماد F نامیدند.

از این رو، حداکثر کار با عنوان کاهش انرژی آزاد یا انرژی در دسترس سیستم در نظر گرفته شد (انرژی آزاد گیبس در دما و فشار ثابت، یا انرژی آزاد هلمهولتز در دما و حجم ثابت)، لازم به ذکر است که گرمای داده شده معمولا معیاری برای کاهش انرژی کل سیستم (انرژی داخلی) است. با این تعاریف مشخص شد که انرژی آزاد گیبس یا هلمهولتز، مقدار انرژی آزاد برای انجام کار، در شرایط داده شده است. جالب است بدانید که در بعضی مواقع از تابع گیبس به عنوان آنتالپی آزاد نیز یاد می شود (برای تشخیص آن از انرژی آزاد هلمولتز). البته توجه داشته باشید که استفاده از آنتالپی آزاد مورد تایید IUPAC نیست.
همانطور که بیان شد، تا این زمان، دیدگاه کلی به این صورت بود که تمامی واکنش های شیمیایی، سیستم را به حالت تعادل می رسانند که در آن میل واکنش ها از بین رفته باشد. در طی ۶۰ سال بعد، اصطلاح میل با اصطلاح انرژی آزاد جایگزین شد.
انرژی آزاد گیبس
انرژی آزاد گیبس در واقع مقدار انرژی در دسترس برای انجام یک فرآیند در دما و فشار ثابت است. این انرژی را نباید با انرژی های شیمیایی، فیزیکی و یا حتی انرژی هایی که در طبیعت هستند اشتباه گرفت. به عبارت دیگر، تابع گیبس یک پدیده ترمودینامیکی محسوب می شود که در اثر انجام یک واکنش شیمیایی ایجاد شده است. پس به صورت تصادفی یا خود به خود ایجاد نخواهد شد. در تابع گیبس، پدیده هایی مثل حرکت، جنبش، گرما و انفجار وجود ندارد. بنابراین در اثر ایجاد انرژی آزاد گیبس، هیچگونه تغییری از جمله تغییرات حرکتی و یا فیزیکی در ماده ایجاد نخواهد شد. انرژی آزاد گيبس كه با G نمايش داده می شود، به صورت زير تعريف مي گردد:
G = U + PV – TS
یا به طور معادل:
G = H – TS
که در آن، U انرژی درونی، P فشار، V حجم، T دما، S آنتروپی و H آنتالپی است. با توجه به معادله مشخص می شود که انرژی آزاد گیبس از کم کردن (حاصلضرب دما در آنتروپی) از مقدار آنتالپی محاسبه می شود. در این معادله، دما در مقیاس کلوین است. دقت داشته باشید که انرژی آزاد گیبس تابع حالت است، از این جهت فقط به حالت های اولیه و پایانی هر تغییر یا تحولی بستگی دارد.
از آنجائيكه آنتالپی و همچنین حاصلضرب دمای مطلق و آنتروپی (TS) از جنس انرژی می باشند، پس انرژی آزاد گيبس هم از جنس انرژی خواهد بود. اما توجه داشته باشید که در این رابطه، آنتالپی و آنتروپی باید واحد یکسانی داشته باشند. یعنی هر دو کمیت بر حسب ژول یا بر حسب کیلو ژول باشند. واحد SI انرژی گیبس کیلوژول می باشد.
تغییر انرژی آزاد گیبس (ΔG)
با توجه به رابطه تابع گیبس مشخص می شود که انرژی آزاد گيبس يك كميت مقداری است. این بدین معنا است که اگر سيستم مورد نظر در يك فرآيند يا تغيير حالت شركت كند، مقادير آنتالپی، دمای مطلق و یا آنتروپی می توانند تغییر کنند. بنابراین مقدار انرژي آزاد گيبس هم می تواند عوض شود. برای این منظور از تغييرات انرژی آزاد گيبس (G∆) بهره می برند. توجه داشته باشید که گاهی اوقات G∆ به صورت دلتا G یا dG نیز نوشته می شود. این تغييرات برابر با انرژي آزاد گيبس نهایی یا ثانویه منهای انرژی آزاد گيبس آغازی یا اولیه است. بنابراین، تغییرات انرژی آزاد گیبس با استفاده از تغییرات آنتالپی (ΔH) و تغییرات آنتروپی (ΔS) یک سیستم به صورت زیر محاسبه می شود.
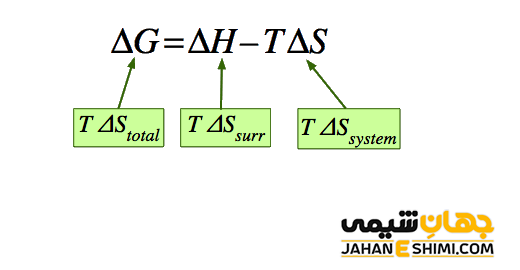
ΔG = ΔH – TΔS
به کمک معادله بالا می توان همزمان تاثیر سه عامل تغییر آنتالپی، تغییر آنتروپی و دما را در پیشرفت خود به خودی واکنش بررسی نمود. همانطور که می دانید، آنتالپی نشان دهنده تغییرات انرژی ضمن انجام واکنش است. این تغییرات انرژی، هم انرژی جنبشی و هم انرژی پتانسیل را شامل می شود، اما به شرطی که در طی انجام واکنش، فشار وارد بر سیستم ثابت باقی بماند.

توجه داشته باشید که در یک سیستم ترمودینامیکی، مواد شیمیایی در حال واکنش با هم می باشند. بنابراین با تغییر هر کدام از عوامل آنتالپی، آنتروپی و دما، انرژی آزاد کل سیستم نیز تغییر می کند. از طرفی دیگر، انجام یک واکنش از نظر ترمودینامیکی وقتی امکان پذیر است که تغییرات انرژی منفی باشد. به بیان ساده تر، یک واکنش از لحاظ انرژی، زمانی انجام پذیر تلقی می گردد که انرژی سیستم بر اثر انجام آن واکنش کمتر شود. یعنی سیستم پایدارتر گردد. در این صورت تغییرات آنتالپی سیستم مورد نظر منفی خواهد بود.
علامت G∆
تغيير انرژي آزاد گيبس، در واقع حداکثر کار غیر انبساطی است که در شرايط دما و فشار ثابت، در يک سيستم ترمودینامیکی بسته بدست مي آيد. سیستم ترمودینامیکی بسته به سیستمی گفته می شود که در آن، تبادل گرما و کار با محیط اطراف وجود دارد، اما تبادل ماده انجام نمی شود. از طرفی، حداکثر کار غیر انبساطی می تواند فقط در یک فرآیند کاملا برگشت پذیر محاسبه شود. به عبارت دیگر، زمانیکه یک سیستم برگشت پذیر از حالت اولیه به حالت ثانویه تبدیل شود، کاهش انرژی آزاد گیبس برابر با مقدار کاری است که سیستم بر روی محیط اطراف خود انجام می دهد. این میزان برابر با منفی کاری است که نیرو های فشار از محیط اطراف به سیستم وارد می کنند. در نهایت می توان گفت که انجام یک واکنش از لحاظ ترمودینامیکی هنگامی امکان پذیر است که تغییرات انرژی آزاد گیبس منفی باشد.
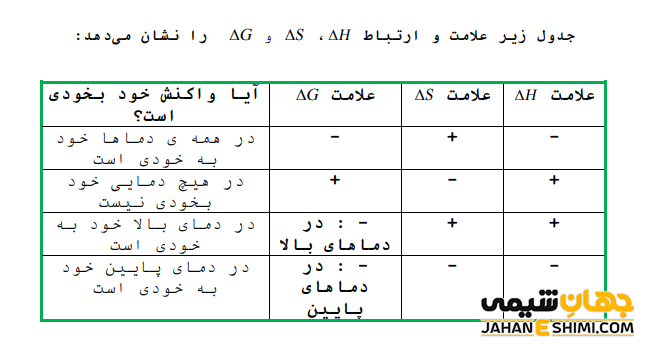
با توجه به علامت G∆ سه حالت مختلف می تواند پیش آید که این سه حالت عبارتند از:
- اگر علامت G∆ منفی باشد، تغییر به صورت خود به خودی است.
- علامت G∆ مثبت باشد، در این صورت تغییر غیر خود به خودی خواهد بود.
- اگر مقدار G∆ برای واکنشی برابر صفر شود، بنابراین واکنش هم در مسیر رفت و هم برگشت به شکل خود به خود بوده و گفته می شود که واکنش فوق در حال تعادل است. به عبارت دیگر می توان نتیجه گرفت که این پتانسیل ترمودینامیکی زمانی به حداقل میزان خود می رسد (تغییرات آن در نقطه تعادل صفر می شود) که سیستم در فشار ثابت و دمای ثابت به تعادل شیمیایی رسیده باشد.
انرژی آزاد گیبس استاندارد
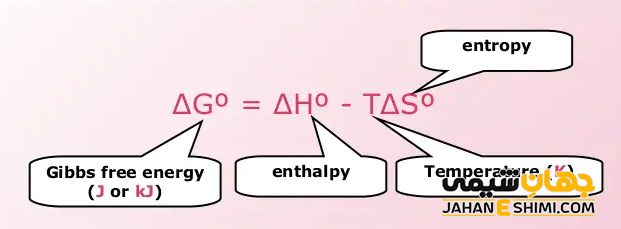
توجه داشته باشید که حالت استاندارد برای یک واکنش زمانیست که غلظت تمام محلول های موجود در آن واکنش برابر با ۱ مول (۱M) است. همچنین، فشار جزئی هر گاز موجود در آن واکنش برابر با ۰.۱ MPa باشد. علاوه بر آن، تمام اندازهگیری ها در دمای ۲۵ درجه سانتی گراد انجام شده باشد. در این صورت، انرژی آزاد یک واکنش در حالت استاندارد برابر است با:
ΔG∘ = ΔH∘ – TΔS∘
انرژی آزاد گیبس تشکیل (ΔGof)
انرژی آزاد گیبس استاندارد تشکیل (Gfo) یک ترکیب، تغییر انرژی آزاد گیبس است که همراه با تشکیل ۱ مول از یک ماده در حالت استاندارد از عناصر تشکیل دهنده آن در حالت استانداردشان است (پایدار ترین شکل عنصر در فشار ۱ بار و دمای ۲۹۸/۱۵ کلوین یا ۲۵ درجه سانتیگراد). تمام عناصر در حالت استاندارد خود (مثلا گاز اکسیژن دو اتمی، گرافیت، و غیره) دارای تغییر شکل گیری انرژی آزاد گیبس استاندارد برابر با صفر هستند. لازم به ذکر است که انرژی آزاد استاندارد مربوط به یک واکنش را میتوان با استفاده از انرژی آزاد استاندارد تشکیل و به کمک معاذله زیر بدست آورد.
ΔG∘ = ∑ΔGf products∘ − ∑ΔGf reactants∘
اگر علامت ΔGo مثبت باشد، واکنش غیر خودبخودی است. در حالیکه اگر ΔGo کوچکتر از صفر باشد (علامت منفی)، واکنش خودبخودی خواهد بود. دقت داشته باشید که در علم شیمی به واکنشی خود به خودی می گویند که بدون نیاز به گرفتن انرژی از بیرون قابل انجام است. جالب است بدانید که یک واکنش خود به خودی می تواند با سرعتی بسیار بالا انجام شود یا با سرعتی کم.
رابطه ثابت تعادل و انرژی آزاد گیبس
ثابت تعادل یک کمیت ترمودینامیکی محسوب می شود، بنابراین می توان آن را بر حسب سایر کمیت های ترمودینامیکی بیان کرد. به عنوان مثال، برای واکنش تعادلی که در دما و فشار ثابت به تعادل رسیده است، رابطه زیر، میان تغییر انرژی آزاد گیبس استاندارد واکنش (∘ΔG) و ثابت تعادل (K) وجود دارد:
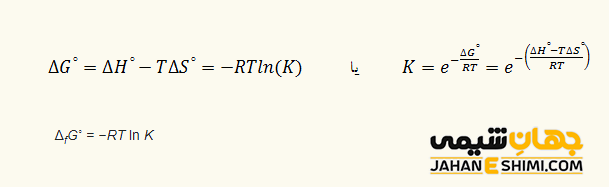
لازم به ذکر است که ثابت تعادل معادله بالا، ثابت تعادل ترمودینامیکی نامیده می شود که در حقیقت بر اساس فعالیت ها تعریف می گردد. با توجه به معادله، می توان نتیجه گرفت که K برحسب ∘ΔG یک تابع صعودی است. به عبارت دیگر، با منفی تر شدن ∘ΔG، مقدار K که بیشتر می شود و بالعکس. در واقع، واکنش های خودبخودی مقدار K بزرگتری دارند. توجه داشته باشید که علامت K، همواره بزرگتر از صفر (مثبت) است. همچنین، با توجه به معادله مشخص می شود که در واکنش های گرماگیر، با افزایش دما، ثابت تعادل نیز افزایش پیدا می کند، در حالیکه با کاهش دما، ثابت تعادل هم کاهش خواهد یافت. عکس روند فوق برای واکنش های گرمازا مشاهده می شود.
رقابت میان آنتالپی و آنتروپی
با توجه به معادله انرژی آزاد گیبس می توان درباره رقابت میان آنتالپی و آنتروپی بحث کرد. همان طور که می دانید، منفی بودن آنتالپی (گرما زا بودن واکنش) عامل مساعدی در پیشرفت خودبخودی واکنش محسوب می شود. زیرا در نهایت به منفی شدن ΔG کمک می کند. اما در محیط اطراف ما، واکنش هایی اتفاق می افتند که در آنها سیستم گرما می گیرد، اما انرژی آنها افزایش یافته است. یعنی با وجود تغییرات آنتالپی مثبت، خودبخودی انجام شده اند. در این نوع واکنش ها، میزان بی نظمی سیستم (آنتروپی) نقش مهمی دارد. این عامل زمانی مساعد خواهد بود که انجام واکنش، باعث زیاد شدن بی نظمی در سیستم شود.
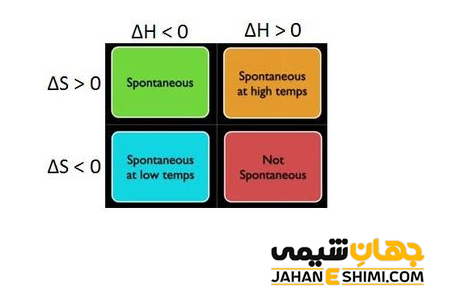
در دما های بالا، مقدار عبارت T∆S، افزایش می یابد. در واقع اگر تغییرات آنتروپی نیز مثبت باشد، عبارت حاصلضرب (T∆S-) منفی شده و در نتیجه به منفی شدن ΔG کمک می کند. حال اگر علامت آنتالپی و آنتروپی همزمان مثبت باشد، در دماهای بالا واکنش به صورت خودبخودی است. زیرا در نهایت عبارت (T∆S-) از H∆ بزرگتر می شود و مقدار ΔG کوچک تر از صفر خواهد شد. از طرفی دیگر، در دماهای پایین، مقدار عبارت T∆S کاهش می یابد. حال اگر S∆ نیز منفی باشد، علامت عبارت حاصلضرب (T∆S-) مثبت می شود. در این صورت، G∆ در شرایطی منفی می شود که علامت H∆ حتما منفی باشد. به بیان ساده تر، در بحث پیرامون اثر دما در پیشرفت خودبخودی واکنش می توان این طور گفت که در دماهای پایین، تغییر آنتروپی و در دماهای بالا تغییر آنتالپی عامل تعیین کننده در محاسبات G∆ است.
واکنش خود به خودی
واکنش ها زمانی مطلوب هستند که منجر به کاهش آنتالپی و افزایش آنتروپی سیستم شوند. هنگامی که هر دوی این شرایط برآورده شوند، واکنش به طور طبیعی رخ می دهد. واکنش خود به خودی واکنشی است که به شکل گیری محصولات در شرایطی که واکنش در آن انجام می شود، کمک می کند. آتش خروشان نمونه ای از یک واکنش خود به خودی است، زیرا گرمازا است (در انرژی سیستم کاهش می یابد زیرا انرژی به عنوان گرما به محیط اطراف آزاد می شود). محصولات آتش سوزی تا حدی از گازهایی مانند دی اکسید کربن و بخار آب تشکیل شده است. آنتروپی سیستم در طی یک واکنش احتراق افزایش می یابد. ترکیب کاهش انرژی و افزایش آنتروپی نشان می دهد که واکنش های احتراق واکنش های خود به خودی هستند.
یک واکنش غیر خود به خودی واکنشی است که در مجموعه شرایط داده شده به نفع تشکیل محصولات نیست. برای اینکه یک واکنش غیر خود به خودی باشد، باید گرماگیر باشد و با کاهش آنتروپی یا هر دو همراه باشد. جو ما عمدتاً از مخلوطی از گازهای نیتروژن و اکسیژن تشکیل شده است. می توان معادله ای نوشت که نشان می دهد این گازها تحت یک واکنش شیمیایی برای تشکیل مونوکسید نیتروژن قرار می گیرند. خوشبختانه این واکنش در دما و فشار معمولی غیر خود به خودی است زیرا ا یک واکنش بسیار گرماگیر با تغییر آنتروپی اندکی مثبت است. باید مراقب بود که اصطلاح خود به خود را با این تصور که یک واکنش به سرعت رخ می دهد اشتباه نگیرید. واکنش خود به خودی واکنشی است که در آن تشکیل محصول مطلوب است، حتی اگر واکنش بسیار کند باشد. یک تکه کاغذ به طور ناگهانی آتش نمی گیرد، اگرچه احتراق آن یک واکنش خود به خودی است. چیزی که وجود ندارد انرژی فعال سازی مورد نیاز برای شروع واکنش است.



















