
ترکیبات آلکیل هالید (alkyl halide) به آلکیل هایی گفته می شود که اتم های هالوژن (فلوئور، کلر، برم یا ید) دارند. این دسته از ترکیبات را می توان جز ساده ترین ترکیبات هالوژن دار در نظر گرفت. آلکیل هالید ها دارای فرمول عمومی به صورت R-X می باشند که در آن، R نشان دهنده یک گروه آلکیل (یا گروه آلکیل استخلاف شده) و X نشان دهنده اتم هالوژن است. به عبارت دیگر می توان گفت که آلکیل هالید ها در واقع زیر مجموعه ای از ترکیبات هالوکربن ها (Halocarbons) می باشند. لازم به ذکر است که آلکیل هالید ها با نام هالوآلکان ها (Haloalkane) یا آلکان های هالوژنه (Halogenoalkane) نیز شناخته می شوند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی آلکیل هالید ها و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
ساختار مولکولی آلکیل هالید ها
همانطور که بیان شد، آلکیل هالید دسته ای از ترکیبات آلی محسوب می شوند که از اتصال یک یا چند اتم هالوژن به یک آلکان (یا گروه آلکیل) ساخته شده است. این مولکول ها دارای اتم های کربن، هیدروژن و هالوژن می باشند. به بیان دیگر، آلکیل هالید ها به آلکان هایی گفته می شود که یک یا چند اتم از اتم های هیدروژن آنها در ساختار مولکول با اتم های هالوژن عوض شده است. در این ترکیبات، هالوژن به طور مستقيم به كربن Sp۳ متصل شده است. لازم به ذکر است که در هالو آلکان ها، فراوانی هالوژن های کلر و برم نسبت به اتم های فلوئور و ید بیشتر است. فرمول مولکولی عمومی هالو آلکان ها را می توان به صورت Cn H(۲n+2-m) Xm در نظر گرفت. در این فرمول، X نشان دهنده اتم های هالوژن و m نشان دهنده تعداد هالوژن هاست.

خواص آلکیل هالید ها
خواص شیمیایی
آلکیل هالید ها واکنش های آلکان ها همانند سوختن، هالوژن دار شدن، واکنش های جانشینی، واکنش های حذفی و غیره را می توانند انجام دهند. توجه داشته باشید که در واکنش های سوختن، آلکیل هالید ها به دلیل جایگزینی اتم های هیدروژن با اتم های هالوژن، واکنش پذیری کمتری نسبت به آلکان ها نشان می دهند (به میزان کمتری قابل اشتعال می باشند). به طور کلی در واکنش های جانشینی، اتم های هالوژن مولکول با اتم یا گروه دیگری جایگزین می گردد. در حالیکه در واکنش های حذفی، با حذف اتم هالوژن و یک اتم یا گروه دیگر (مثل یک اتم هالوژن دیگر، یک اتم هیدروژن و…) از مولکول، پیوند دوگانه (پیوند پای) تشکیل می شود. بنابراین می توان واکنش های حذفی را بر عکس واکنش های افزایشی دانست.
خواص فیزیکی
تعدادی از هالو آلکان ها همچون متیل کلرید، اتیل کلرید، متیل برمید و برخی از کلرو فلورو متان ها، در دمای اتاق گازی شکل اند. در حالیکه سایر ترکیبات به شکل مایع یا جامد وجود دارند. در ادامه به بررسی برخی خواص فیزیکی آلکیل هالید ها می پردازیم.
انحلال پذیری
جالب است بدانید که آلکیل هالید ها آبگریز هستند، یعنی در آب نا محلول اند. ابه احتمال زیاد، به دلیل ناتوانی در تشکیل پیوند هیدروژنی، انحلال پذیری کمی در آب دارند. در حالیکه در حلال های آلی همچون بنزن، اتر، کلروفرم و… محلول می باشند.
چگالی
مشتقات پلی کلر، برم و ید آلکیل هالید ها، چگالی خیلی بیشتری نسبت به آب دارند. در حالیکه، ترکیبات کلرو آلکان چگالی کمتری نسبت به آب نشان می دهند. به طور کلی، هر چقدر تعداد اتم های کربن و هالوژن یک هالو آلکان افزایش پیدا کند، دانسیته آن نیز افزایش خواهد یافت.
قطبیت و نیرو های بین مولکولی
هالو آلکان ها نسبت به الکان ها، نیرو های بین مولکولی قوی تری دارند (تعامل دو قطبی– دو قطبی). در واقع پیوند C-X یک پیوند کووالانسی قطبی محسوب می شود. در گروه هالوژن ها، از بالا به پایین، با کاهش الکترونگاتیویته اتم هالوژن، میزان قطبیت پیوند C-X نیز کاهش پیدا می کند. از طرفی دیگر، با بزرگ شدن اندازه قسمت آلکیل، قسمت غیر قطبی مولکول نیز بزرگتر خواهد شد. بنابراین می توان آلکیل هالید ها را بسته به نوع اتم هالوژن و اندازه گروه آلکیل، مولکول هایی قطبی تا کاملا غیر قطبی دانست.
نقطه ذوب و نقطه جوش
آلکیل هالید ها نسبت به آلکیل اولیه ای که از آن بوجود آمده اند (یا آلکان هم کربن)، به دلیل وزن مولکولی بالاتر، دمای جوش بیشتری نیز دارند. در واقع با افزایش اندازه مولکول و شدت گرفتن نیرو های لاندن، نقطه ذوب و نقطه جوش آلکیل هالید ها افزایش می یابد. اگر گروه های آلکیل، یکسان باشند، با بزرگ شدن و در نتیجه سنگین شدن اتم هالوژن، نقطه جوش نیز بیشتر می شود. بنابراین، نقطه جوش هالوآلکان ها به صورت RI > RBr > RCl > RF تغییر می کند.
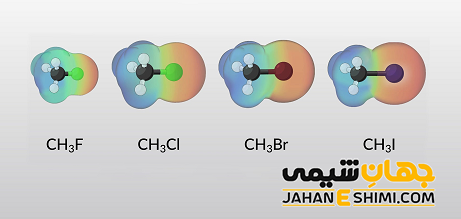
همچنین اگر تعداد اتم های هالوژن نیز در یک مولکول بیشتر شود، منجر به افزایش نقطه ذوب و نقطه جوش می گردد. علاوه بر آن، شاخه دار شدن در گروه های آلکیل یا در کربن حامل اتم هالوژن، باعث پایین آمدن دمای جوش در مقایسه با آلکیل هالید های راست زنجیر با همان تعداد کربن خواهد شد.
طبقهبندی آلکیل هالید ها
آلکیل هالید ها را با توجه به اینکه کربن دارای اتم هالوژن، به چند گروه آلکیل متصل شده است، طبقه بندی می کنند. بنابراین هالوآلکان ها، به دسته های آلکیل هالید نوع اول، دوم و سوم تقسیم می شوند.
- آلکیل هالید نوع اول، کربن حامل اتم هالوژن، تنها به یک گروه آلکیل وصل شده است. لازم به ذکر است که متيل هاليد ها (CH۳X) که فقط يك اتم كربن دارند، را به عنوان آلکیل هالید نوع ۱ در نظر می گیرند. در این ترکیبات هیچ گروه آلکیلی به اتم کربن حامل هالوژن، متصل نیست.
- الکیل هالید نوع دوم، کربن حامل هالوژن به طور مستقیم به دو گروه آلکیل دیگر متصل شده است. این دو گروه آلکیل می توانند یکسان و یا متفاوت باشند.
- آلکیل هالید نوع سوم، در این دسته، اتم کربن حامل هالوژن، به طور مستقیم با سه گروه آلکیل پیوند داده است. این سه گروه آلکیل نیز می توانند گروه های یکسان و یا متفاوت باشند.

انواع هالوآلکان ها
علاوه بر آن، هالوآلکان ها را می توان بر اساس نوع اتم هالوژن موجود در ساختار مولکول به دسته های فلوئورو آلکان ها، کلرو آلکان ها، برومو آلکان ها، یدو آلکان ها و یا ترکیبی از آنها دسته بندی نمود. همچنین می توان آنها را بر اساس تعداد اتم های هالوژن موجود در ساختار، طبقه بندی بندی کرد. در این صورت، به منظور نامگذاری هر دسته، باید تعداد اتم های هالوژن مربوطه به شکل پیشوند قبل از نام هالو آلکان گفته شود.
دقت داشته باشید که اگر دو اتم هالوژن در ساختار وجود داشته باشد، ترکیب یک دی آلکیل هالید، سه اتم هالوژن، ترکیب یک تری آلکیل هالید و … در نظر گرفته می شود. لازم به ذکر است که دى هاليد ها به دو شکل وجود دارند. دى هاليد های دو قلو که در آن، دو اتم هالوژن به يك اتم كربن متصل شده اند. در حالیکه در دى هاليد مجاور، دو اتم هالوژن به دو اتم كربن مجاور وصل شده اند.

ایزومری هالوآلکان ها
ایزومری ساختاری در آلکیل هالید ها هم می تواند از تغییر در اسکلت کربنی ساختار بوجود آید و هم از تغییر در موقعیت اتم های هالوژن بر روی اسکلت کربنی مشخص. از این جهت، برای رسم ایزومر های ساختاری مختلف یک هالو آلکان، ابتدا اسکلت های کربنی مختلف برای آلکان هم کربن با آلکیل هالید مورد نظر را در نظر بگیرید. حالا حالت های ممکن و غیر تکراری را در هر اسکلت کربنی برای جایگاه های مختلف اتم های هالوژن مشخص کنید.
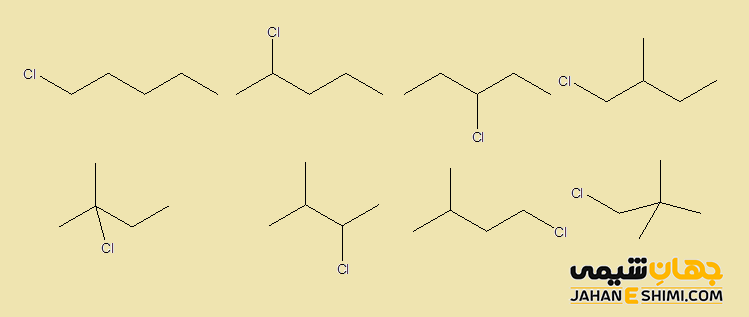
توجه داشته باشید که بر روی یک اتم کربن که به چهار اتم کربن دیگر متصل است، نمی توان حتی یک هالوژن قرار داد. به علاوه، بر روی اتم کربنی که به سه اتم کربن دیگر پیوند داده است، می توان فقط یک اتم هالوژن گذاشت. به عنوان نمونه ایزمرهای ساختاری ترکیب C۵H۱۱Cl را در شکل زیر مشاهده می کنید.
سنتز آلکیل هالید ها
آلکیل هالید ها را تقریبا می توان به کمک تمامی پیش ماده های آلی (مانند آلکان ها، آلکن ها، الکل ها و کربوکسیلیک اسید ها) تولید کرد. این ترکیبات را اغلب از الکل ها که بیشتر در دسترس هستند سنتز می کنند. دقت داشته باشید که برخی از آلکن ها در جریان جایگزینی گروه عاملی –OH با –X میل به نو آرایی دارند. اما می تون با استفاده از ماده شیمیایی فسفر هالید ها، مانع از نوآرایی شد.
جالب است بدانید که در تولید صنعتی، هالوآلکان ها را اغلب به کمک آلکان ها و آلکن ها تولید می کنند. از جمله روش های دیگر تهیه هالوآلکان ها می توان به موارد افزایش هیدروژن هالید ها به آلکن ها، افزایش هیدروژن به آلکن ها (ایجاد هالید) و همچنین آلکین ها (ایجاد تترا هالید) و هالوژن دار کردن برخی از هیدروکربن ها در مجاورت نور و یا گرما اشاره کرد.
نام گذاری هالوآلکان ها
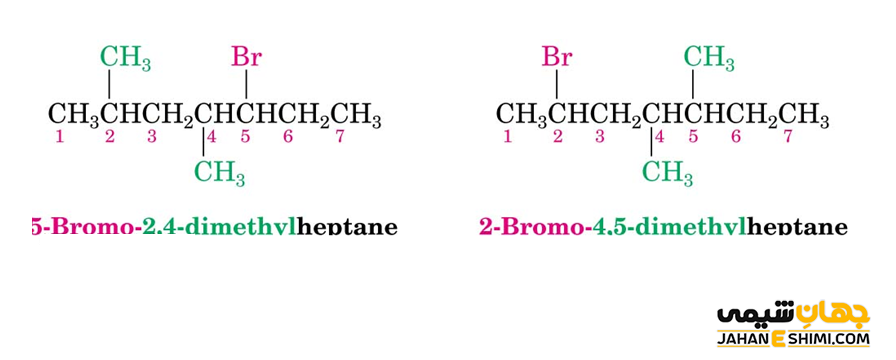
نامگذاری هالوآلکان ها کاملا شبیه نامگذاری آلکان ها انجام می شود. در اینجا فقط اتم های هالوژن را هالو نامیده و با آنها مانند گروه های استخلافی یا شاخه های جانبی مشابه گروه های آلکیل برخورد می شود. در واقع، هالوژن ها در این ترکیبات اولویتی نسبت به اتم های کربن نخواهند داشت. به بیان دیگر، ابتدا طولانى ترين زنجير را انتخاب نمایید، حتى اگر اتم هالوژنی به هيچ يك از كربن های زنجیر طولانی پيوند نداشته باشد. حالا از پايين ترين اعداد ممكن براى شاخه ها استفاده نمایید.
دقت داشته باشیدکه موقع ذکر نام هالوژن ها، به انتهای آنها، حرف «و» اضافه نمایید. مثلا به صورت برومو، کلرو، فلوئورو و یدو ذکر می شوند. همچنین، آنها را باید به ترتیب حروف الفبایی ذکر کنید. به طور کلی، برای نام گذاری آلکیل هالید ها، از پیشوند هالو پیش از نام آلکان استفاده می کنند. همچنین شماره کربن دارای اتم هالوژن را هم در ابتدای نام می آورند.
واکنش آلکیل هالید ها
واکنش جانشینی نوکلئوفیلی
در واکنش های شیمیایی جانشینی نوکلئوفیلی (هسته دوستی)، یک نوکلئوفیل (معمولا یک باز است) با آلکیل هالیدی واکنش می دهد که در آن، اتم کربن متصل به هالوژن دارای بار جزئی مثبت باشد. در این حالت، اتم هالوژن به صورت آنیون هالید، مولکول را ترک کرده و گروه هسته دوست، جایگزین هالوژن در ساختار مولکول می شود. از آن جهت که واکنش جانشینی به کمک یک هسته دوست آغاز شده است، به واکنش جانشینی هسته دوستی مشهور می باشد. تبدیل هالوآلکان به الکل، در دسته واکنش های جانشینی نوکلئوفیلی آلیفاتیک قرار می گیرد. در طی آن، گروه هیدروکسیل (OH-) جای هالوژن در مولکول را می گیرد.

واکنش حذفی
در واکنش های شیمیایی حذفی، هالوآلکان ها در محیط قلیایی و در اثر حرارت ملایم، در اثر فرآیند هیدرو هالوژن زدایی می توانند یک هیدروکربن غیر اشباع (آلکن) ایجاد کنند. به عبارت دیگر، واکنشی است که در آن، بر اثر حذف اتم های هیدروژن و هالوژن مولکول (حذف یک مولکول هیدروژن هالید (HX))، پیوند دوگانه تشکیل می شود. از آنجاییکه در این واکنش، اتم هیدروژن معمولا در موقعیت بتا قرار گرفته است، به آن، واکنش حذفی بتا نیز می گویند. به عبارت دیگر، در این نوع واکنش ها، علاوه بر اتم هالوژن، یک اتم هیدروژن نیز از کربن مجاور کربنی که به اتم هالوژن متصل است، جدا می شود. در این صورت، بین دو اتم کربن مجاور، یک پیوند دوگانه تشکیل می گردد.

واکنش با فلزات
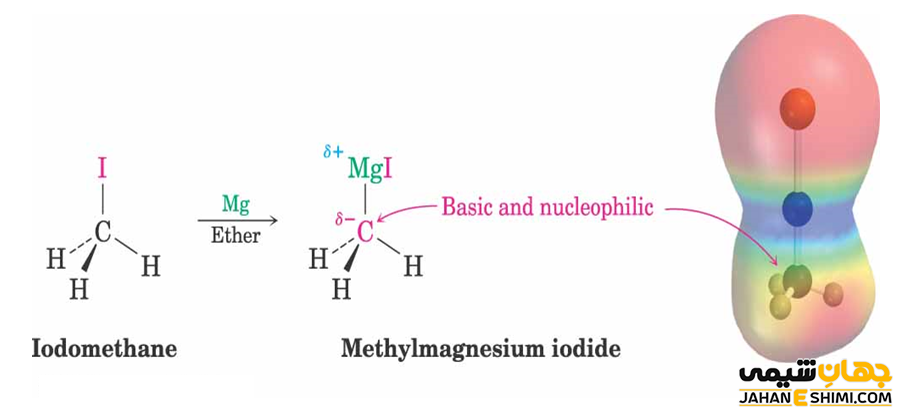
هالوآلکان ها با پودر منیزیم در حضور اتر خشک، واکنش داده و واکنش گرینیارد (RMgX) را ایجاد می کنند. در طی این واکنش، پیوند های کربن- فلز ایجاد می شود. به چنین ترکیباتی، ترکیبات آلی فلزی (Orgonaometallic Compounds) گفته می شود. لازم به ذکر است که ترکیبات ایجاد شده، در حضور فلز و اسید می توانند دوباره به آلکیل اولیه احیا شوند.
شناسایی هالوآلکان ها
مهمترین روش شناسایی آلکیل هالید ها به این صورت است که با محلول الکلی نیترات نقره به مدت چند دقیقه حرارت داده شوند. در واقع، با تشکیل رسوبی که در اسید نیتریک رقیق حل نمی شود، هالوژن شناسایی می گردد.
کاربرد های آلکیل هالید ها
آلکیل هالید ها مصارف متعددی دارند. به عنوان مثال، در آزمایشگاه به عنوان یک ترکیب واسطه کاربرد دارند. از آنها به عنوان پاک کننده جهت تمیز کردن (اغلب به عنوان پاک کننده رنگ و یا لاک) استفاده می کنند. هالوآلکان های نا محلول در آب، به عنوان حلال های آبگریز در فرآیند های شیمیایی مصرف می شوند. آلکیل هالید ها همچنین به عنوان سوخت مورد استفاده قرار می گیرند. از جمله مصارف تجاری آنها می توان به خاموش کردن آتش اشاره کرد.
از جمله کاربرد مشتقات هالوآلکان ها می توان به مواردی مثل تتراکلرید کربن جهت تشخیص نوترینو ها، اتیل کلرید به عنوان عامل خنک کننده پوست در مناطق گرمسیری، کلرو فلورو کربن به عنوان سردکن در فریزر ها، دی کلرو متان در جوشکاری پلاستیک های اسفنجی به عنوان یک عامل پف کننده، کلرو اتن (CH۲=CHCl) به منظور تولید پلی کلرو اتان (PVC)، هیدرو فلوئورو کربن در یخچال ها و پلاستیک های فومی و تترا فلوئورو اتن (CF۲=CF۲) به منظور تولید پلی تترا فلوئورو اتن (PTFE) اشاره کرد.
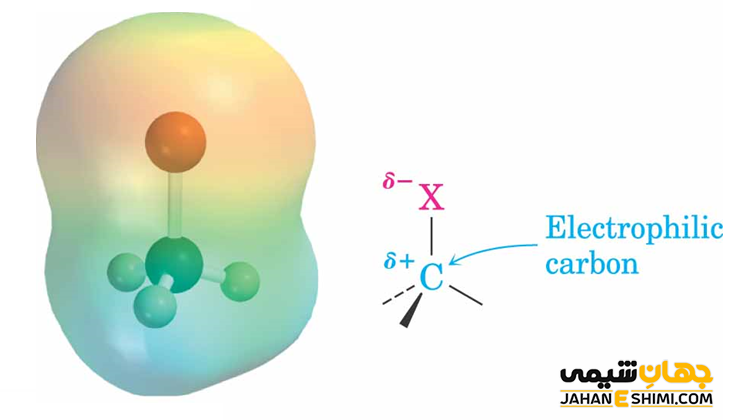
خطرات آلکیل هالید ها
با وجود کاربرد های فراوانی که هالوآلکان ها دارند، اما متاسفانه این ترکیبات پیامد های بسیار جدی بر سلامت انسان و محیط زیست می گذارند. از این پیامد ها نمی توان چشم پوشی کرد. به عنوان مثال، ترکیبات کلرو فلوئور کربن ها (CFCs)، عامل اصلی در تخریب لایه اوزون محسوب می شوند. تتراکلرید کربن (پاک کننده پارچه)، باعث آسیب جدی به کبد می گردد. همچنین، کلروفرم (یک داروی بیهوشی و بی حس کننده) عامل سرطان به شمار می رود. بنابراین استفاده از آلکیل هالید ها حساب شده و محدود می باشد.



















