
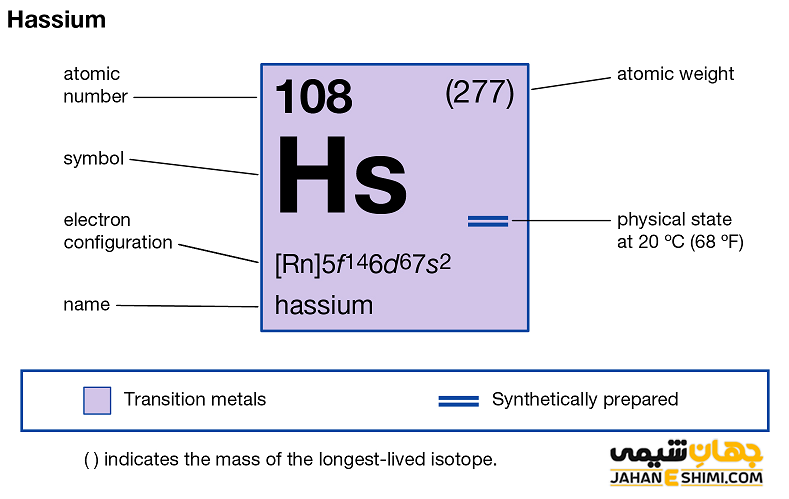
عنصر هاسیم (Hassium) با نماد شیمیایی Hs، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۱۰۸ می باشد. این عنصر در حقیقت صد و هشتمین عنصر جدول تناوبی عناصر بوده که در گروه VIIIB و تناوب هفتم جدول تناوبی عناصر قرار دارد. در واقع عنصر هاسیوم یک فلز واسطه (Transition Metals) فوق سنگین، مصنوعی و از عناصر با خاصيت راديواكتيو بالای جدول تناوبی است. این فلز با عناصر آهن (Fe)، روتنیم (Ru) و اوسمیوم (Os) در گروه هشت واسطه جدول تناوبی قرار گرفته است. توجه داشته باشید که عنصر هاسیوم سنگین ترین عضو گروه ۸ می باشد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر هاسیم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر هاسیم
کشف عنصر هاسیم بحث برانگیز و جالب است. زیرا کشف این عنصر توسط دو گروه مختلف از آلمان و اتحاد جماهیر شوروی سابق ادعا شده بود. سنتز عنصر هاسیم برای اولین بار در سال ۱۹۷۸ میلادی، به صورت مصنوعی در موسسه تحقیقات هسته ای دوبنا (Dunba) شوروی سابق گزارش شده است. در این سنتز، دانشمندان روسی به سرپرستي یوری اوگانسیان (Yuri Tsolakovich Oganessian)، اهداف رادون (ایزوتوپ ۲۲۶Ra) را با هسته های کلسیم (ایزوتوپ ۴۸Ca) بمباران کردند. بدین شکل ایزوتوپ ۲۷۰ را بدست آوردند. در همان سال، تیم دیگری در دوبنا امکان سنتز عنصر ۱۰۸ را در واکنش های میان عنصر سرب (۲۰۸Pb) با آهن (۵۸Fe) بررسی کردند. هر دو گروه محققان در تفسیر داده های خود نا مطمئن بودند. در واقع مقاله آنها به طور واضح ادعا نمی کرد که عنصر ۱۰۸ را کشف کرده اند.
در سال ۱۹۸۳ میلادی، آزمایش های جدیدی در دوبنا برای سنتز ایزوتوپ های دیگر عنصر ۱۰۸ انجام شد. ایزوتوپ ۲۶۳ از بمباران بیسموت (ایزوتوپ ۲۰۹Bi) با منگنز (ایزوتوپ ۵۵Mn)، ایزوتوپ ۲۷۰ از بمباران کالیفرنیم (ایزوتوپ ۲۴۹Cf) با نئون (ایزوتوپ ۲۲Ne) و ایزوتوپ ۲۶۴ از بمباران سرب (ایزوتوپ های ۲۰۸Pb و ۲۰۷Pb) با آهن (ایزوتوپ ۵۸Fe) بدست آمد. هیچ کدام از این آزمایشات به عنوان یک کشف ادعا نشد. اوگانسیان آنها را در یک کنفرانس به جای گزارش مکتوب اعلام کرد.
در سال ۱۹۸۴ میلادی، يك گروه آلماني به سرپرستی پیتر آرمبروستر (Peter Armbruster) و گاتفرید مونسنبرگ (Gottfried Münzenberg) در موسسه تحقیقات هسته ای یون های سنگین (GSI) واقع در دارمستات، ایالت هسن آلمان غربی، عنصر هاسیم را تهیه کردند. این محققان عنصر سرب (۲۰۸Pb) را با یون های آهن (۵۸Fe) بمباران کردند و موفق به تولید ایزوتوپ ۲۶۵ از عنصر ۱۰۸ شدند.

نامگذاری عنصر هاسیم
همانطور که بیان شد، ادعا های مبنی بر سنتز عنصر هاسیوم از آزمایشگاه های اتحاد جماهیر شوروی و آلمان غربی مطرح شده بود. بنابراین اولویت اکتشاف و نامگذاری این عنصر در میان دانشمندان شوروی و آلمانی مورد بحث بود. در نهایت انجمن بين المللي شيمي محض و كاربردی یا همان آیوپاک (IUPAC)، با بررسی نتایج دو آزمایشگاه روسی و آلمانی، تیم آلمانی را به عنوان کاشفان رسمی هاسیوم به رسمیت شناخت. زیرا نتایج آنها معتبر تر و قطعی بود. در حالیکه احتمالا گروه روسی زودتر این عنصر را ساخته بودند. گروه آلمانی نام هاسیوم را پیشنهاد دادند. این کلمه از نام لاتین ایالت هسن آلمان (Hassia) که موسسه در آن واقع شده است، گرفته شده بود.
برای مدت زمان زیادی، بحث و جدل نامگذاری عناصر ۱۰۱ تا ۱۰۹ جدول تناوبی عناصر وجود داشت. بنابراین، انجمن آیوپاک در ابتدا نام موقت انیلکتیم (unniloctium) و نماد Uno را برای این عنصر تا زمانیکه یک تصمیم نهایی برای نامگذاری آن گرفته شود، انتخاب کرد. در سال ۱۹۹۴ میلادی، انجمن آیوپاک نام عنصر شماره ۱۰۸ جدول تناوبی را هاهنیم پیشنهاد نمود. اما در نهایت و در سال ۱۹۹۷ میلادی، آیوپاک به این مباحث نامگذاری و اختلافات خاتمه داد و واژه هاسیم را به عنوان نام رسمی این عنصر تایید کرد.
پیدایش و منابع عنصر شماره ۱۰۸ جدول تناوبی
عنصر هاسیم به دلیل ناپایداری بسیار بالا در طبیعت وجود ندارد. از این رو، این عنصر در پوسته زمین یافت نمی شود. در واقع هسیم به دست بشر و در آزمایشگاه تهیه شده است. به طور کلی می توان گفت که این عنصر از طریق بمباران اهداف سرب با اتم های آهن تهیه شده است. لازم به ذکر است که تاکنون تنها تعداد کمی از اتم های هاسیم ساخته شده است. به احتمال زیاد در آینده نیز هرگز نمی تواند به مقداری ساخته شود که با چشم قابل مشاهده باشد.
به عبارت دیگر، برای تولید اتم های هاسیوم، عنصر سرب طی فرآیند هم جوشی سرد با اتم های آهن بمباران می شود. این کار با شتاب دادن یون های آهن در دستگاه های شتاب دهنده ها انجام شده است. در نهایت و بعد از چند روز، ذرات شتاب دار آهن به سوی هدف سربی، جهت سنتز عنصر هاسیوم، بمباران شده اند. هسته های آهن (با عدد اتمی ۲۶) و سرب (با عدد اتمی ۸۲) در یک واکنش هم جوشی هسته ای با یکدیگر ادغام می گردند. بدین شکل، هسته های عنصر جدید را تشکیل دادند که عدد اتمی آن (۱۰۸) حاصل جمع عدد اتمی دو عنصر آهن و سرب خواهد بود.

سنتز هسته های سنگین
هسته های اتم های سنگین در واکنش های هسته ای تولید می شوند که در طی آن، دو هسته با اندازه غیر یکسان در یک هسته ادغام می گردند. هرچقدر دو هسته از لحاظ جرم، نا برابرتر باشند، احتمال واکنش میان آن دو نیز بیشتر خواهد بود. ترکیب شیمیایی ساخته شده از هسته های سنگین تر به هدفی تبدیل می شود که می تواند به وسیله پرتو های هسته های سبک تر بمباران گردد. دو هسته تنها وقتی می توانند با یکدیگر ادغام شوند که به اندازه کافی به هم نزدیک شده باشند. می دانید که هسته ها دارای بار مثبت اند، پس به خاطر دافعه الکترواستاتیکی، یکدیگر را دفع می کنند. در حالیکه بر همکنش های قوی می تواند بر این دافعه غلبه کند.
وقتیکه دو هسته به هم نزدیک می شوند، معمولا به مدت ۱۰ تا ۲۰ ثانیه در کنار هم باقی می مانند، سپس از هم جدا می شوند. اگر همجوشی میان آنها اتفاق افتد، ادغام موقت (که هسته مرکب نام دارد) یک حالت برانگیخته خواهد بود. برای از دست دادن انرژی برانگیختگی و رسیدن به حالت پایدار تر، یک هسته مرکب می شکافد و یا یک یا چند نوترون را بیرون می اندازد. حال اگر انرژی ترکیبی دو هسته نا برابر زیاد نباشد، نیرو های دافعه بین هسته ها بر آن غلبه کرده و واکنش شکست خواهد خورد.
جهت تولید یک هسته منفرد، هدف بایستی در مدت زمان نسبتا زیادی بمباران شود. هسته تازه تولید شده به یک آشکار ساز منتقل می شود که هسته را متوقف می کند. محل دقیق ضربه آتی بر روی آشکار ساز، انرژی آن و زمان ورود ثبت می گردد. مشخصات هسته پس از ثبت فروپاشی، مجددا ثبت می شود و مکان، انرژی و زمان فروپاشی اندازه گیری می گردد.
ویژگی های فیزیکی و شیمیایی عنصر هاسیم
همانطور که بیان شد، عنصر هاسیم تاکنون تنها به مقدار بسیار کمی تهیه شده است. بنابراین اطلاعات کمی درباره شكل ظاهری و یا حتی خواص شیمیایی آن وجود دارد. با این وجود، تعدادی پیش بینی و نتایج تجربی اولیه در مورد خواص فیزیکی و شیمیایی آن وجود دارد. به عنوان مثال، انتظار می رود که هاسیم یک فلز نقره ای یا خاکستری در دمای اتاق باشد. علاوه بر آن، پیش بینی می شود که به راحتی با اکسیژن هوا درگیر واکنش شده و یک تترو اکسید فرار را تشکیل خواهد داد.
فلز هاسیوم در چهارمین و در واقع آخرین دوره بلوک- d جدول تناوبی عناصر قرار گرفته است. توجه داشته باشید که در این بلوک، ششمین عنصر است. از طرفی دیگر پنجمین عنصر سری فرا اکتینیدی (Transactinide) نیز محسوب می شود. آزمایشات شیمی تاکید کرده اند که عنصر هاسیوم مانند همولوگ سنگین تر عنصر اسمیم در گروه هشتم رفتار می کند. عنصر اسمیم در خانه بالای هاسیم در جدول تناوبی واقع شده است.
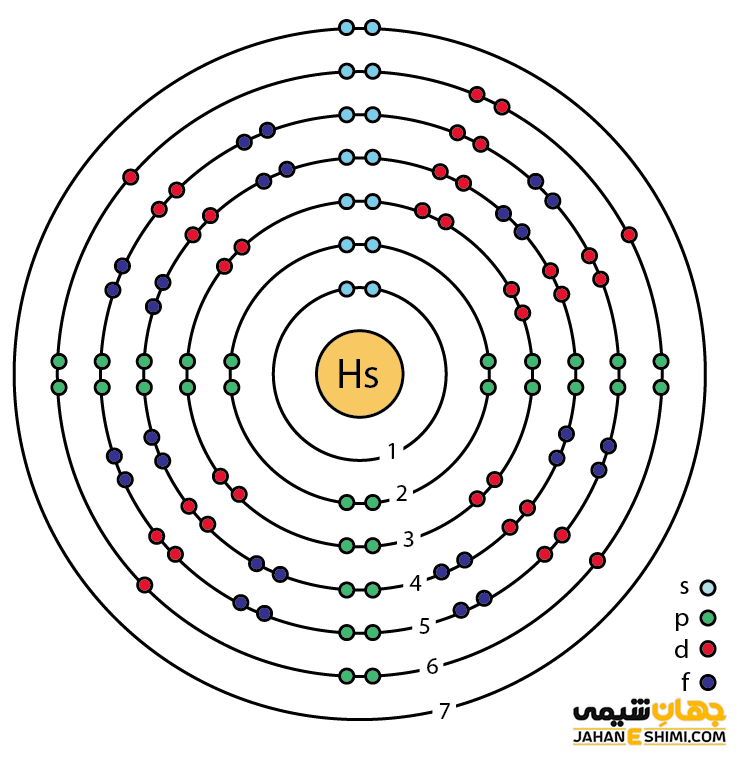
خصوصیات ویژه هاسیم از ساختار اتمی ([۸۶Rn] 5f۱۴۶d۶۷s۲) آن ناشی می شود. همانطور که از آرایش الکترونی هاسیم مشخص است، اوربیتال d لایه ماقبل آخر آن در حال پر شدن است. این عنصر به واسطه آرایش الکترونی که دارد، در دسته عناصر واسطه قرار می گیرد. فلزات واسطه در میان عناصر قلیایی خاکی و عناصر گروه بور در جدول تناوبی قرار گرفته اند. عناصر واسطه، عناصر گروه B نیز نامیده می شوند. با توجه به آرایش الکترونی مشخص است که هشت الکترون در دورترین لایه الکترونی آن وجود دارد. پس احتمالا در بیشتر ترکیبات شیمیایی به صورت کاتیون هشت بار مثبت (+Hs۸) ظاهر مي شود. از این رو می تواند در هشت پیوند کووالانسی شرکت کند.
خواص ویژه هاسیم
لازم به ذکر است که انتظار می رود هاسیوم نیز همانند سایر هم گروهان خود، بتواند حالت اکسیداسیون پایدار پایین تری مثل ۲+، ۳+، ۴+ و ۶+ را نیز تشکیل دهد. انتظار می رود که هاسیم ۴+ نسبت به هاسیم ۸+ در محلول آبی پایدار تر باشد. علاوه بر آن، هاسیم باید یک فلز نسبتا نجیب باشد. از دیگر ویژگی های عنصر هاسیوم می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر احتمالا به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر تعیین نشده است.
- خاصت مغناطیسی عنصر هاسیم نیز نا مشخص است.
- انتظار می رود که ساختار بلوری آن به شکل شش ضلعی یا هگزاگونال (hcp) باشد.
- این عنصر احتمالا آلوتروپ ندارد. در واقع ناشناخته هستند.
- جرم اتمی هاسیم برابر با ۲۶۹ g/mol است.
- چگالی آن نیز برابر با ۲۷–۲۹ g/cm۳ پیش بینی می شود.
- شعاع اتمی آن نیز ۱۲۶ pm تخمین زده شده است.
- یون های هاسیم معمولا عدد اکسایش برابر با اعداد ۰، +۲، +۳، +۴، +۶ و +۸ را دارند. اعداد اکسایش ۰، +۳، +۴ و +۸ متداول تر می باشند.
- انرژی یونیزاسیون آن برابر با ۷۳۰ kJ/mol است.
ایزوتوپ های عنصر هاسیم
همانطور که در مقالات پیشین نشریه جهان شیمی فیزیک بیان شده است، ایزوتوپ های یک عنصر تنها در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر هاسیم ایزوتوپ های فراوانی دارد. نخستین ایزوتوپ شناسایی شده آن، رادیو ایزوتوپ ۲۶۵Hs است که در سال ۱۹۸۴ میلادی کشف شد. از آنجاییکه عنصر هاسیوم، عنصری مصنوعی است، بنابراین ایزوتوپ پایدار ندارد. این عنصر در حقیقت به صورت سنتزی و در رآکتور های هسته ای تهیه شده است. در نتیجه نمی توان برای آن جرم اتمی استاندارد تعریف کرد. تاکنون ۱۲ ایزوتوپ پرتوزا از عنصر هاسیم شناسایی شده است.
لازم به ذکر است که ایزوتوپ های سبک تر معمولا از همجوشی مستقیم بین دو هسته سبک تر تشکیل می شوند. در حالیکه ایزوتوپ های سنگین تر اغلب به عنوان محصولات فرو پاشی هسته هایی با اعداد اتمی بزرگ تر تولید می شوند. رادیو ایزوتوپ ۲۶۹Hs پایدار ترین ایزوتوپ هاسیم با نیمه عمر ۹/۶ ثانیه است. بقیه ایزوتوپ های پرتوزای آن، نیمه عمری کمتر از چند میلی ثانیه دارند. علاوه بر آن، هاسیوم دارای ۴ حالت متا (m) یا ایزومر هسته ای نیز می باشد (۲۶۵H، ۲۶۶H، ۲۶۷H و ۲۷۷H). ایزوتوپ های رادیواکتیو این عنصر دارای جرم های اتمی در محدوده ۲۶۳ تا ۲۷۷ amu می باشند (به استثنای اعداد اتمی ۲۷۲، ۲۷۴ و ۲۷۴).
کاربرد های عنصر هاسیم
از آنجاییکه عنصر شماره ۱۰۸ جدول تناوبی به میزان بسیار ناچیز (فقط تعداد کمی از اتم های آن) تولید شده است، بنابراین کاربرد خاصی خارج از پژوهش های علمی، هسته ای و یا تحقیقاتی ندارد. به بیان دیگر، به دلیل نیمه عمر پایین هاسیم، این عنصر کاربرد تجاری ندارد.

ترکیبات عنصر هاسیوم
پیش بینی می شود که عنصر هاسیوم بتواند به راحتی با عناصر اکسیژن و هالوژن ها واکنش دهد. در نتیجه اکسید، هالید ها و یا حتی اکسی هالید را تولید نماید. از جمله ترکیبات مهم آن می توان به تتروکسید هاسیم (HsO۴)، سدیم هاسات (VIII) (Na۲[HsO۴(OH)۲]) و هاسیوم (II) هاسوسن (Hs(C۵H۵)۲) اشاره کرد.
خطرات هاسیم بر روی سلامتی انسان
همانطور که بیان شد، عنصر هاسیم در طبیعت وجود ندارد. بنابراین در پوسته زمین نیز یافت نمی شود. به علاوه، هاسیم آن قدر ناپایدار است و نیمه عمری کوتاهی دارد، که هر مقداری از آن تشکیل شود، به سرعت به سایر عناصر تبدیل می گردد. بنابراین می توان گفت که دلیلی برای در نظر گرفتن اثرات و خطرات سلامتی آن وجود ندارد. به بیان دیگر، عنصر شماره ۱۰۸ جدول تناوبی نقش زیست شناختی مشخصی ندارد، اما با توجه به پرتوزا بودن، سمی محسوب می شود. بنابراین در هنگام کار با آن، باید حتما مراقب بود.




















