
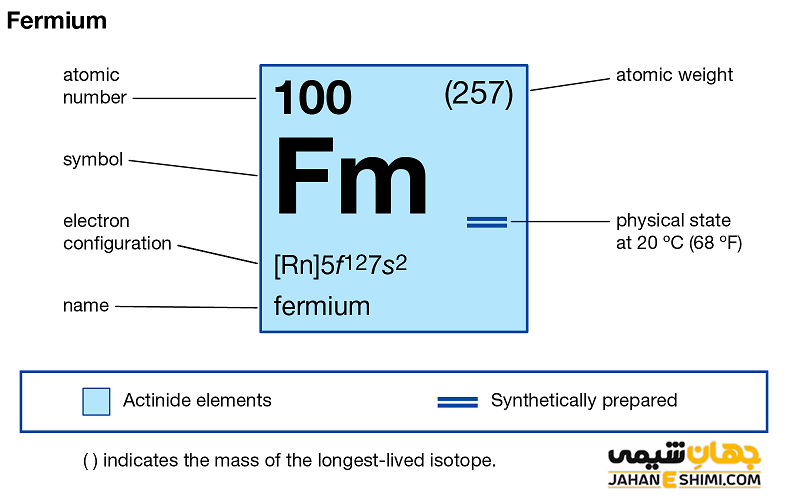
عنصر فرمیم (Fermium) با نماد شیمیایی Fm، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۱۰۰ می باشد. این عنصر در حقیقت صدمین عنصر از جدول تناوبی عناصر بوده که در گروه IIIB و تناوب هفتم جدول تناوبی قرار گرفته است. عنصر فرمیم یک فلز واسطه (Transition Metals) رادیواکتیو، احتمالا به رنگ سفید، نقره اي و یا خاکستری (رنگ آن ناشناخته است) و از عناصر مصنوعی گروه اکتینید ها است. این فلز با عناصر اسکاندیم (Sc)، ایتریم (Y) و لانتان (La)، در گروه سه واسطه جدول تناوبی عناصر قرار دارد. فرمیم در واقع عنصری ترانزورانیک (عدد اتمی بیشتری نسبت به اورانیوم دارد) است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر فرمیوم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر فرمیم
عنصر فرمیم نیز مانند عنصر اینشتینیم برای نخستین بار در سال ۱۹۵۲ میلادی، توسط آلبرت غیورسو (Albert Ghiorso) و همکارانش در دانشگاه کالیفرنیا برکلی و با همکاری آزمایشگاه های ملی آرگون (Argonne National Laboratory) و لوس آلاموس (Los Alamos National Laboratory)، در نتیجه آزمایش هسته ای آیوی مایک (Ivy Mike) در ایالات متحده آمریکا شناسايي و کشف شد. این عنصر به عنوان جزئی از بقایای رادیواکتیو (محصول فروپاشي اورانيوم در زباله های هسته ای) اولین بمب هیدروژنی در اقیانوس آرام کشف شده است. رادیوایزوتوپ تولید شده در حقیقت فرمیم ۲۵۵ با نیمه عمر ۲۰ ساعت بود. نام این عنصر به افتخار دانشمند برجسته فیزیک هسته ای یعنی انریکو فرمی (Enrico Fermi) روی آن گذاشته شده است. این اکتشاف به دلیل تنش های ناشی از جنگ سرد و به دستور ارتش ایالات متحده آمریکا، تا سال ۱۹۵۵ میلادی مخفی نگه داشته شد.
با این وجود، تیم دانشگاه کالیفرنیا برکلی توانست عناصر ۹۹ و ۱۰۰ جدول تناوبی را از طریق بمباران نوترونی پلوتونیوم-۲۳۹ و به کمک وسایل غیر نظامی سنتز کند. آنها این کشف را در سال ۱۹۵۴ میلادی و با این ادعا منتشر کردند که این اولین مطالعاتی نیست که بر روی این عناصر انجام شده است. بدین جهت، مطالعات آیوی مایک از طبقه بندی خارج و در سال ۱۹۵۵ میلادی منتشر شد. گروهی دیگر نیز از موسسه فیزیکی نوبل در استکهلم، توانستند اورانیم ۲۳۸ را با یون های اکسیژن ۱۶ بمباران نموده و در نهایت ایزوتوپ فرمیم ۲۵۰ را کشف کنند. با این وجود، اولویت تیم برکلی به رسمیت شناخته شد.

پیدایش و منابع عنصر شماره ۱۰۰ جدول تناوبی
عنصر فرمیم به طور طبیعی وجود ندارد، بنابراین در پوسته زمین یافت نشده است. در واقع، به دلیل نیمه عمر بسیار کوتاه تمام ایزوتوپ های آن، هر فرمیم اولیه، یعنی فرمیومی که می تواند در طول شکل گیری آن بر روی زمین وجود داشته باشد، تا به امروز از بین رفته است. تشکیل فرمیم از اکتینید های طبیعی همچون اورانیوم و توریم در پوسته زمین نیز نیاز به جذب نوترون های متعدد دارد که این اتفاق بسیار بعید است. بنابراین، این عنصر از طریق بمباران سنگین نوترونی عناصر سبک تر سری اکتینید ها (به ویژه عناصر اورانیوم و پلوتونیوم) در یک رآکتور هسته ای تولید می شود. به عنوان مثال، ایزوتوپ فرمیوم- ۲۵۷ که سنگین ترین ایزوتوپی است که از این طریق بدست می آید، تنها در مقادیر پیکوگرام قابل تولید است.

ویژگی های فیزیکی و شیمیایی عنصر فرمیم
همانطور که بیان شد، عنصر فرمیم تاکنون تنها به مقدار جزئي توليد شده است. از این جهت، اطلاعات اندكي درباره شكل ظاهری و یا خواص شیمیایی آن وجود دارد. این عنصر، فلزی پرتوزا و رادیواکتیوی قوی است. عنصر فرمیوم دوازدهمین عضو از عناصر سری اکتینید ها (بلوک- f) محسوب می شود كه به صورت مصنوعي سنتز شده است.
خصوصیات فرمیم از ساختار اتمی ([۸۶Rn] 5f۱۲۷s۲) آن ناشی می شود. همان طور که مشخص است، زیر لایه f در این عنصر در حال پر شدن است. این عنصر نیز مثل عناصر لانتانید ها و یا اکتینید ها و به واسطه آرایش الکترونی که دارد، در دسته فلزات واسطه داخلی (Inner Transition Metals) قرار می گیرد. در این دسته از عناصر، الکترون های متمایز کننده در زیر لایه های F(n-2) لایه والانس که در حقیقت تراز هایی درونی تر اند قرار می گیرند. از همین رو، به عناصر واسطه داخلی معروف هستند. این عناصر جز عناصر واسطه قرار می گیرند. فلزات واسطه در حقیقت بین فلزات قلیایی خاکی و عناصر گروه بور در جدول تناوبی قرار گرفته اند. به عناصر واسطه، عناصر گروه B نیز گفته می شود.
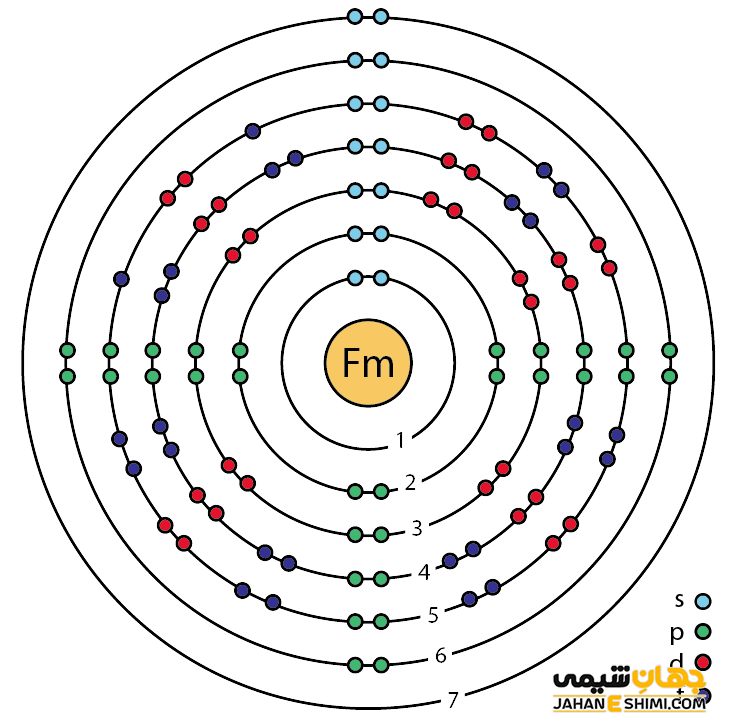
با توجه به آرایش الکترونی مشخص است که تعداد زیادی الکترون در دورترین لایه الکترونی فرمیم وجود دارد. پس می تواند در ترکیبات به صورت کاتیون های مختلف ظاهر شود. لازم به ذکر است که حالت اکسیداسیون آن ۳+ در محلول آبی است. از این رو می تواند در سه پیوند کووالانسی شرکت کند. به عبارت دیگر، بیشتر ترکیبات فرمیم سه ظرفیتی می باشند. دقت داشته باشید که هیچ ترکیب جامدی از فرمیم تهیه نشده است.
خواص ویژه فرمیوم
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر احتمالا به صورت جامد است.
- دمای ذوب این عنصر، ۱۵۲۷ درجه سانتی گراد پیش بینی می شود. در حالیکه دمای جوش آن نا شناخته است.
- خاصت مغناطیسی عنصر فرمیم نیز نا مشخص است.
- ساختار بلوری آن به شکل مکعبی وجوه پر یا ساختار مکعبی مرکز سطحی (FCC) تخمین زده شده است.
- این عنصر احتمالا آلوتروپ ندارد.
- جرم اتمی فرمیم برابر با ۲۵۷.۰۹۵۱ g/mol است.
- چگالی آن نیز برابر با ۹.۷ g/cm۳ پیش بینی می شود.
- شعاع اتمی آن نیز برابر با ۲۰۰ pm تخمین زده می شود.
- یون های فرمیم معمولا اعدد اکسایش برابر با اعداد ۰، +۲ و +۳ دارند. اعداد اکسایش ۰ و +۳ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۶۲۹ kJ/mol است.
اکتینید ها
کلمه اکتینید (Actinide) به معنای شبیه اکتینیوم است که با نماد شیمیایی An نمایش داده می شود. همانطور که واضح است، نام این سری از عناصر، از عنصر آکتینیوم گرفته شده است. این گروه شامل ۱۵ عنصر شيميايی (عدد های اتمی ۸۹ تا ۱۰۳) است که خواص شيميايي مشابه ای (شبیه به عنصر اکتینیوم) دارند. این گروه از عناصر با فلز اکتینیوم آغاز و به فلز لارنسیوم ختم می شود. به دلیل کمبود جا در جدول تناوبی عناصر و از آن جهت که نظم و ترتیب جدول بهم نخورد، این گروه از عناصر در یک ردیف ۱۴ تایی در پایین جدول و زیر سری لانتانید ها قرار گرفته است.
در این دسته از عناصر، زیر لایه ۵ اف آنها در حال پر شدن است. تراز های انرژی ۵f و ۶d بسیار به هم نزدیک می باشند. پس نمی توان با قطعیت گفت که در هنگام وارد شدن الکترون های والانس در عناصر مختلف این سری، اول کدامیک از این تراز ها پر می شود. اما به طور کلی، پر شدن تراز ها در این ردیف از عناصر به ترتیب ۵f و بعد ۶d می باشد. لازم به ذکر است که تمامی اکتینید ها به جز فلز اکتینیم جز بلوک f جدول تناوبی هستند. عنصر اکتینیم جز عناصر بلوک d جدول تناوبی محسوب می شود، اما خواص آن شبیه به چهارده اکتینید دیگر است.
خواص ویژه اکتینید ها
از عنصر چهارم این سری به بعد که به عناصر ترانس یا ترا اورانیوم مشهورند، اغلب در طبیعت وجود ندارند. تمامی اکتینید ها هسته ناپایدار دارند، بنابراین جز عناصر پرتوزا محسوب می شوند. این عناصر، معمولا فلزاتی متراکم، نرم، انعطاف پذیر، چگالی بالا و الکتروپوزیتیو هستند. برخی از آنها با چاقو به راحتی برش می خورند. معمولا خاصیت پارامغناطیسی نشان می دهند و ممکن است که آلوتروپ های زیادی تشکیل دهند. این فلزات در دمای اتاق جامد هستند و در هوا، خود به خودی آتش می گیرند. با عناصر گروه هالوژن ها، کالکوژن ها و یا کربن (تشکیل ترکیبات اورگانو اکتینید) درگیر واکنش می شوند. به علاوه، با آب جوش و اسید های رقیق، گاز هیدروژن آزاد می کنند. توجه داشته باشید که به منظور مطالعه اکتینید ها، ساختار هسته عناصر نسبت به آرایش الکترونی آنها، اهمیت بیشتری دارد.
لازم به ذکر است که آکتنيد ها نسبت به عناصر سری لانتانيد ها، شباهت رفتاري کمتري را نشان می دهند. اما شیمی آنها در مقایسه با شیمی لانتانید ها بسیار پیچیده تر است. زیرا عناصر سری اکتینید ها اغلب چندین حالت اکسایش مختلف نشان می دهند. بعد از عنصر امرسیوم در این ردیف از عناصر، حالت اکسایش عمده برای آنها، حالت اکسایش سه است. از این رو، این دسته از عناصر رفتاری شبیه عناصر گروه لانتانید ها نشان می دهند.

ایزوتوپ های عنصر فرمیم
همانطور که می دانید ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر متفاوت اند. عنصر فرمیوم ایزوتوپ های زیادی دارد. نخستین ایزوتوپ شناسایی شده آن، رادیو ایزوتوپ ۲۵۵Fm است که در سال ۱۹۵۲ میلادی کشف و ردیابی شد. بعد از آن، ایزوتوپ رادیواکتیو ۲۵۰Fm به صورت مستقل سنتز شد. شناسایی شیمیایی این ایزوتوپ رادیواکتیو، منجر به سنتز عنصر ۱۰۲ جدول تناوبی (عنصر نوبلیم) شده است. از آنجاییکه فرمیوم، عنصری مصنوعی می باشد، بنابراین ایزوتوپ پایدار ندارد. همانطور که گفته شد، این عنصر به صورت سنتزی و در رآکتور های هسته ای تولید شده است. در نتیجه نمی توان برای آن جرم اتمی استاندارد تعریف کرد. ۲۰ ایزوتوپ پرتوزا از عنصر فرمیم شناسایی شده است. رادیوایزوتوپ ۲۵۷Fm پایدار ترین ایزوتوپ فرمیوم با نیمه عمر ۱۰۰.۵ روز است.
بعد از رادیوایزوتوپ ۲۵۷Fm، رادیو ایزوتوپ ۲۵۳Fm با نیمه عمر ۳ روز و رادیو ایزوتوپ ۲۵۲Fm با نیمه عمر ۲۵.۴ ساعت از جمله ایزوتوپ های پایدار فرمیوم می باشند. بقیه ایزوتوپ های رادیو اکتیو آن، نیمه عمری کمتر از ۳۰ ساعت دارند. لازم به ذکر است که بیشتر آنها حتی نیمه عمری کمتر از ۳ دقیقه دارند. علاوه بر آن، فرمیوم دارای دو حالت متا (m) نیز می باشد. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های اتمی در محدوده ۲۴۱ تا ۲۶۰ amu می باشند.

کاربرد های عنصر فرمیم
از آنجاییکه عنصر فرمیم به میزان بسیار ناچیز سنتز شده است، بنابراین خیلی کم کاربردی خارج از پژوهش های علمی و تحقیقاتی دارد. اما ممکن است روزی این عنصر در پزشکی کاربرد داشته باشد.
ترکیبات عنصر فرمیم
پیش بینی می شود که عنصر فرمیم بتواند به راحتی با عناصر اکسیژن، گوگرد و هالوژن ها واکنش دهد. در نتیجه اکسید، سولفید و هالید ها را تولید نماید. از جمله ترکیبات پیش بینی شده عنصر شماره ۱۰۰ جدول تناوبی می توان به موارد زیر اشاره کرد.
- تری اکسید دی فرمیم (Fm۲O۳)
- سولفید فرمیم (Fm۲S۳)
- تری فلوئورید فرمیم (FmF۳)
- سولفات فرمیم (Fm۲(SO۴)۳)
- تری کلرید فرمیم (FmCl۳)
- فسفات فرمیم (FmPO۴)
- تری برمید فرمیم (FmBr۳)
- نیترات فرمیم (Fm(NO۳))
- تری یدید فرمیم (FmI۳)
- کربنات فرمیم (Fm۲(CO۳)۳)

خطرات فرمیوم بر روی سلامتی انسان
از آنجاییکه عنصر فرمیوم به طور طبیعی وجود ندارد، بنابراین در پوسته زمین یافت نشده است. از این جهت، می توان گفت که دلیلی برای در نظر گرفتن خطرات سلامتی آن وجود نداشته است. به بیان دیگر، عنصر فرمیوم نقش زیست شناختی مشخصی ندارد، اما به دلیل پرتوزا بودن، سمی محسوب می شود. بنابراین در هنگام کار با آن، باید مراقب بود.



















