
عنصر امریسیم (Americium) با نماد شیمیایی Am، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۹۵ می باشد. این عنصر در حقیقت نود و پنجمین عنصر از جدول تناوبی بوده که در گروه IIIB و دوره هفتم جدول تناوبی قرار گرفته است. در واقع عنصر امریسیم یک فلز واسطه (Transition Metals) به رنگ نقره ای براق و از عناصر رادیواکتیو گروه اکتینید ها می باشد. این فلز با عناصر اسکاندیم (Sc)، ایتریم (Y) و لانتان (La)، در گروه سوم واسطه جدول تناوبی، هم گروه است. لازم به ذکر است که این عنصر با نام های آمریسیم، آمریسیوم، آمریکیم و آمریکیوم نیز شناخته می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر امریسیوم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر امریسیم
عنصر امریسیم برای اولین بار در سال ۱۹۴۴ میلادی، توسط گروه دانشمندان آمریکایی یعنی گلن سیبورگ (GlennT.Seaborg)، رالف جیمز (Ralph James)، لئون مورگان (Leon O. Morgan) و آلبرت غیورسو (Albert Ghiorso)، به وسیله سیکلوترون ۶۰ اینچی و در دانشگاه کالیفرنیا برکلی تولید شد. در واقع این عنصر، به عنوان بخشی از پروژه منهتن سنتز و شناسایی شد. به بیان دیگر، عنصر امریسیوم با به دام انداختن نوترون ها به کمک ايزوتوپ هاي پلوتونيم در يك شتاب دهنده ذرات سنتز شده است. لازم به ذکر است که این کشف تا نوامبر سال ۱۹۴۵ میلادی برای عموم مردم منتشر نشد. نام عنصر امریسیم، از نام ایالات متحده آمریکا که در آن کشف شده است، گرفته شد.

پیدایش و منابع عنصر شماره ۹۵ جدول تناوبی
همانطور که بیان شد، عنصر امریسیم در گروه عناصر کمیاب زمین قرار دارد. امریسیوم در طبيعت به مقادير بسيار اندك و ناچیز در سنگ های معدنی اورانیوم (مانند پیچبلند) یافت می شود. اما منبع اصلی این عنصر را می توان رآکتورهای اتمی در نظر گرفت. در حقیقت، نیروگاه های هسته ای به صورت طبیعی، امریسیوم را به شکل بخشی از توالی پوسیدگی و انفجار ناشی از بمباران نوترونی پلوتونیوم، تولید می کنند. با استفاده از این روش، هر ساله چند گرم از عنصر امریسیوم تولید می شود. به بیان دیگر، از واپاشی عنصر پلوتونیوم بمباران شده با نوترون می توان امریسیم بدست آورد. علاوه بر آن، امریسیوم هنگام انفجار سلاح های هسته ای نیز تشکیل می شود.
ویژگی های فیزیکی و شیمیایی عنصر امریسیم
عنصر امریسیم، فلزی پرتوزا و رادیواکتیو (نشر ذرات آلفا و پرتو هاي گاما) است. توجه داشته باشید که فعالیت اشعه آلفای این عنصر حدود سه بار بیشتر از عنصر رادیم می باشد. این عنصر از عناصر سری اکتینید ها (بلوک- f) محسوب می شود. این عنصر، سومین عنصر از سری عناصر ترانس اورانیم است. عنصر امریسیوم تازه بريده شده، بسیار درخشان و به رنگ سفید- نقره ای است. اما در مجاورت با هوا اکسید شده و سطح آن تیره می گردد. دقت داشته باشید که اين عنصر خیلی فعال نيست، پس به آهستگی از جلا مي افتد و كدر می شود.
خواص فیزیکی و شیمیایی عنصر امریسیم شبیه عناصر پلوتونیوم (عنصر سمت چپ آن در جدول تناوبی) و یوروپیوم (عنصر بالای آن در گروه لانتانید ها جدول تناوبی) است. عنصر امریسیوم بسیار چکش خوارتر از عناصر اورانیم و نپتونیم است. این فلز در اسید ها حل می گردد و می تواند با اکسیژن واکنش دهد.
خصوصیات قابل توجه امریسیم از ساختار اتمی آن ([۸۶Rn] 5f۷۷s۲) ناشی می شود. همان طور که مشخص است، زیر لایه f این عنصر در حال پر شدن است. این عنصر نیز همانند لانتانید ها و اکتینید ها و به واسطه آرایش الکترونی که دارد، در دسته فلزات واسطه داخلی قرار می گیرد. در واقع در این دسته از عناصر، الکترون های متمایز کننده در تراز های F(n-2) لایه ظرفیت که در واقع تراز های درونی اند قرار می گیرند. به همین دلیل، به عناصر واسطه داخلی معروف می باشند. این عناصر جزء عنصر های فلزات واسطه قرار می گیرند. فلزات واسطه در حقیقت بین فلزات قلیایی خاکی (گروه دوم) و عناصر گروه بور در جدول تناوبی قرار گرفته اند. به عناصر واسطه، عناصر گروه B نیز گفته می شود.
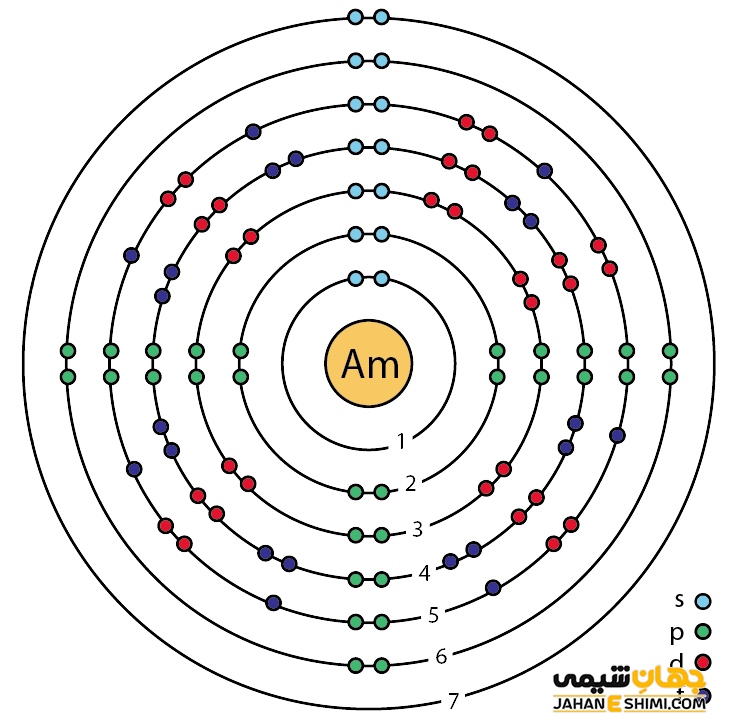
خواص ویژه امریسیوم
با توجه به آرایش الکترونی امریسیم مشخص می شود که نه الکترون در دورترین لایه الکترونی آن وجود دارد. بنابراین این عنصر می تواند در ترکیبات به صورت کاتیون های مختلف ظاهر شود. حالت اکسیداسیون آن بیشتر ۳+ می باشد. بنابراین می تواند در سه پیوند کووالانسی شرکت کند. لازم به ذکر است که هر حالت اکسیداسیون آن، یک طیف جذب متمایز دارد. عنصر امریسیم همچنین یون های رنگی در حالت محلول دارد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۱۱۷۶ و ۲۶۰۷ درجه سانتی گراد است.
- ساختار بلوری آن به شکل شش گوشه یا هگزاگونال (Hexagonal)است. لازم به ذکر است که ساختار بلوری امریسیوم وابسته به دما و فشار می باشد. در شرایط عادی، فلز امریسیم در شکل آلفای پایدار مشاهده می شود. در این حالت، تقارن کریستالی شش ضلعی دارد. اگر فلز فشرده شود، به شکل بتا تغییر می یابد. در این صورت، دارای تقارن مکعبی است. با افزایش فشار تا ۲۳ GPa تبدیل به شکل گاما می گردد، که ارتورومبیک است. ساختار بلوری مونوکلینیک نیز مشاهده شده است. اما دقیقا مشخص نیست که چه شرایطی باعث ایجاد ساختار مونوکلینیک شده است.
- این عنصر آلوتروپ ندارد.
- عنصر امریسیم پارامغناطیس است.
- چگالی آن نیز برابر با ۱۲ g/cm۳ می باشد. این عنصر پر چگال می باشد. بنابراین سنگین ترین عنصر طبیعی کشف شده است.
- شعاع اتمی آن نیز برابر با ۱۷۳ pm تخمین زده شده است.
- یون های امریسیم معمولا اعدد اکسایش برابر با اعداد ۰، +۲، +۳، +۴، +۵، +۶ و +۷ دارند. در حقیقت یک اکسید آمفوتری محسوب می شود. اعداد اکسایش ۰ و +۳ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۵۷۸ kJ/mol است.

اکتینید ها
کلمه اکتینید (Actinide) به معنای شبیه اکتینیوم است که به طور کلی با نماد شیمیایی An نمایش داده می شود. همانطور که معلوم است، نام این سری از عناصر، از عنصر اکتینیوم گرفته شده است. بنابراین خواص شیمیایی این عناصر مشابه عنصر اکتینیوم خواهد بود. سری اکتینید ها در واقع از ۱۵ عنصر با عدد های اتمی ۸۹ تا ۱۰۳ تشکیل شده است. این سری در واقع با فلز آکتینیوم آغاز و به فلز لارنسیوم ختم می شود. در این دسته از عناصر، زیر لایه f۵ آنها در حال پر شدن است. به دلیل کمبود جا در جدول تناوبی عناصر و به منظور اینکه نظم و ترتیب جدول بهم نخورد، این گروه از عناصر در یک ردیف ۱۴ تایی در پایین جدول (زير لانتانيد ها) قرار گرفته اند.
تمامی اکتینید ها به جز عنصر اکتینیم جز بلوک f جدول تناوبی هستند. عنصر اکتینیم جز بلوک d جدول تناوبی محسوب می شود، اما توجه داشته باشید که خواص آن شبیه به چهارده اکتینید دیگر است. لازم به ذکر است که با کشف عنصر نپتونيوم مشخص شد که عناصر توریوم، اورانیوم و پلوتونیم می توانند سری جدیدی از عناصر خاک های کمیاب را تشکیل دهند. از این رو و به منظور متمایز شدن آنها از عناصر سری خاک های کمیاب قبلی که با نام عناصر لانتانید شناخته شده بودند، این سری جدید را عناصر اکتینید نامیدند. لازم به ذکر است که اکتنيد ها نسبت به سری لانتانيد ها، شباهت رفتاري کمتري دارند.
خواص ویژه اکتینید ها
از عنصر چهارم به بعد این سری، که به عناصر ترانس اورانیوم مشهورند، در طبیعت به ندرت و مقدار بسیار ناچیز یافت می شوند. تمامی آنها هسته ناپایدار دارند، بنابراین جز عناصر پرتوزا حساب می شوند. این عناصر، معمولا فلزاتی متراکم، نرم، انعطاف پذیر، پر چگالی و الکتروپوزیتیو هستند. برخی از آنها با چاقو به راحتی برش می خورند. ممکن است آلوتروپ های زیادی تشکیل دهند. معمولا خاصیت پارامغناطیسی نشان می دهند. این فلزات در دمای اتاق جامد بوده و در هوا، خود به خودی آتش می گیرند. با هالوژن ها، کالکوژن ها و یا کربن (تشکیل ترکیبات اورگانو اکتینید) واکنش می دهند. به علاوه با آب جوش و اسید های رقیق، گاز هیدروژن آزاد می نمایند. توجه کنید که برای مطالعه اکتینید ها، ساختار هسته عناصر نسبت به آرایش الکترونی آنها از اهمیت بیشتری برخوردار است.
ایزوتوپ های عنصر امریسیم
همانطور که می دانید، ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر امریسیم ایزوتوپ طبیعی پایدار ندارند، پس همچون سایر عناصر مصنوعی، جرم اتمی استاندارد برایش تعریف نمی شود. این عنصر، ایزوتوپ های فراوانی دارد. تمام ایزوتوپ های آن رادیواکتیو هستند. در واقع ۱۹ ایزوتوپ پرتوزا از عنصر امریسیوم شناسایی شده است. ایزوتوپ های رادیواکتیو این عنصر دارای جرم های اتمی در محدوده ۲۳۲ تا ۲۴۷ amu می باشند. نخستین رادیوایزوتوپ شناخته شده آن، ۲۴۱Am با نیمه عمر ۴۳۲.۲ سال است. همچنین رادیوایزوتوپ ۲۴۳Am با نیمه عمر ۷۳۷۰ سال، پایدارترین ایزوتوپ معروف امریسیم می باشد. بقیه ایزوتوپ های رادیو اکتیو آن، نیمه عمری کمتر از از ۵۱ ساعت دارند. لازم به ذکر است که بیشتر آنها نیمه عمری کمتر از ۱۰۰ دقیقه دارند. علاوه بر آن، امریسیوم دارای هشت حالت متا (m) نیز می باشد.

کاربرد های عنصر امریسیم
امریسیم اغلب در آژیر های تشخیص دود (زنگ خطر دود) بکار می رود. ذرات آلفا ساطع شده به وسیله امریسیم، هوا را یونیزه می کند و سبب هدایت دود در هوا می گردد. هر ذره دودی که وارد واحد مسکونی شود جریان را کاهش می دهد، بنابراین زنگ هشدار روشن می شود. عنصر آمريسيم همچنین به عنوان منبع پرتو هاي گاما کاربرد دارد. علاوه بر آن، امریسیم برای کاربرد در باتری فضاپیما های آینده نیز پتانسیل دارد. هم اکنون از پولونیوم برای این باتری ها استفاده می شود. اما به دلیل کمبود منابع عنصر پولونیوم، به دنبال جایگزین هایی برای آن می باشند. عنصر امریسیوم همچنین می تواند همراه با سولفید روی فلورسنت، استفاده شود. در این صورت، اسپنتناریسوپ خانگی تولید می شود. در واقع، فروپاشی رادیواکتیو امریسیم، انرژی لازم برای فسفر را فراهم می کند و سبب انتشار نور می گردد.

ترکیبات عنصر امریسیم
عنصر امریسیم می تواند به راحتی با عناصر اکسیژن و هالوژن ها واکنش دهد. از جمله ترکیبات آن می توان به موارد زیر اشاره کرد.
- اکسید امریسیم (AmO)
- دی اکسید امریسیم (AmO۲)
- اکسید امریسیم (III) (Am۲O۳)
- تری فلوئورید امریسیم (AmF۳)
- تترا فلوئورید امریسیم (AmF۴)
- دی کلرید امریسیم (AmCl۲)
- تری کلرید امریسیم (AmCl۳)
- دی برمید امریسیم (AmBr۲)
- تری برمید امریسیم (AmBr۳)
- دی یدید امریسیم (AmI۲)
- تری یدید امریسیم (AmI۳)
- اگزالات امریسیم (III) (Am۲(C۲O۴)۳)

خطرات امریسیوم بر روی سلامتی انسان
امریسیوم نقش زیست شناختی مشخصی ندارد، اما به دلیل پرتوزا بودن، سمّی می باشد. انسان ها از راه طریق غذا، تنفس و یا تماس پوستی و به دلیل انتشار عنصر امریسیوم در طی فرآیند های تولیدات اتمی در معرض غلظت بالایی از آن قرار می گیرند. به بیان دیگر، افرادی که در نیروگاه های اتمی کار می کنند و همچنین افرادی که در نزدیکی این مراکز زندگی می کنند، بیشتر با عنصر امریسیم تماس دارند. تابش های ناشی از امریسیوم جذب شده، اولین عامل ایجاد عوارض و بیماری است. این عنصر بعد از جذب به سرعت در بدن انسان حرکت می کند و می تواند مدت زمان طولانی در استخوان ها تجمع یابد. در این حالت، امریسیم به آرامی تجزیه می شود، پس ذرات رادیواکتیو و اشعه منتشر می کند. این اشعه ها سبب تغییر ماده ژنتیکی و باعث سرطان استخوان می شوند.



















