
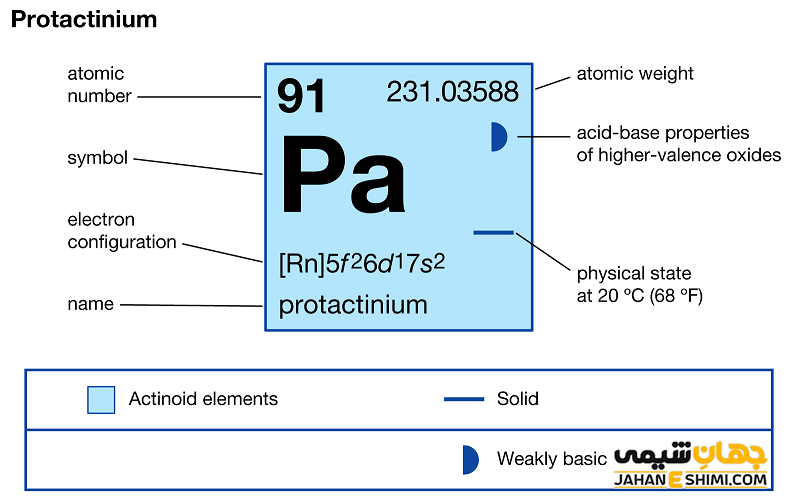
عنصر پروتاکتینیم (Protactinium) با نماد شیمیایی Pa، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۹۱ می باشد. این عنصر در حقیقت نود و یکمین عنصر از جدول تناوبی بوده که در گروه IIIB و تناوب هفتم جدول تناوبی عناصر قرار گرفته است. در واقع عنصر پروتاکتینیم یک فلز واسطه (Transition Metals) بلوری با جلای نقره ای و از عناصر رادیواکتیو گروه اکتینید ها است. این فلز با عناصر اسکاندیم (Sc)، ایتریم (Y) و لانتان (La)، در گروه سوم واسطه جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر پروتاکتینیوم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر پروتاکتینیم
عنصر پروتاکتینیم برای اولین بار در سال ۱۹۱۳ میلادی، زمانیکه اسوالد هلموت گوهرینگ (Oswald Helmuth Göhring) و کاسیمیر فاجانس (Kasimir Fajans) در هنگام انجام تحقیقات خود بر روی تجزیه اورانیوم ۲۳۸ به ایزوتوپ ۲۳۴Pa که نیمه عمری بسیار پایین (۱/۱۷ دقیقه) داشت مواجه شده بودند، شناخته شد. آنها این عنصر جدید را برویوم نامیدند. نام این عنصر در سال ۱۹۱۸ میلادی، زمانیکه دو گروه از دانشمندان به صورت جداگانه کشف شد، به پروتواتیکینیم تبدیل شد. این دو گروه از دانشمندان شامل گروه اتو هان (Otto Hahn) و لیز متنر (Lise Meitner) از آلمان و گروه فردریک سودی (Fredrick Soddy) و جان کرانستون (John Cranston) از بریتانیای کبیر بود. در نهایت و در سال ۱۹۴۹ میلادی به پروتاکتینیوم تغییر پیدا کرد. این عنصر در حقیقت در کانی اورانیتی که از زئیر آمده بود کشف شده است.

فلز خالص آن تا سال ۱۹۳۴ میلادی تهیه نشد. در این سال، شیمیدان هسته ای اهل آلمان یعنی گروس (Aristid V. Grosse)، برای اولین بار توانست فلز پروتاکتینیوم را از ۰/۱ میلی گرم Pa۲O۵ جدا کند. وی این عمل را ابتدا از تبدیل اکسید به ید و سپس شکافتن آن در خلا به وسیله عمل گرمادهی الکترونیکی انجام داد. در نهایت و در سال ۱۹۶۱ میلادی، سازمان انرژی اتمی بریتانیای کبیر توانست ۱۲۵ گرم عنصر پروتاکتینوم خالص تولید نماید. سالیان سال این میزان، تنها منبع پروتاکتینیوم جهان به شمار می رفت.
نام این عنصر از کلمه یونانی پروتوس (protos) به معنی اولین یا نخستین گرفته شده است. این عنصر را در حقیقت، سرچشمه اکتینیم می دانند که به وسیله نشر ذره آلفا تولید می گردد. بنابراین پروتاکتینیم یعنی نخستین اکتینیم. لازم به ذکر است که به پیشنهاد اسفتن مایر و به افتخار مایتنر قرار بود نام آن لیزونیوم یا لیزوتونیوم گذاشته شود.
پیدایش و منابع عنصر شماره ۹۱ جدول تناوبی
پروتاکتینیوم در تمام سنگ های معدنی اورانیوم (پیچبلند) یافت می شود. این عنصر چیزی در حدود ۳۴۰ میلی گرم از یک تن کانی اورانیوم استخراج می گردد. عنصر پروتاکتینیم در حقیقت نادرترین و گران ترین عنصری است که در طبیعت وجود دارد. این عنصر همچنین به صورت مصنوعی و از طریق شکافت هسته ای عناصر اورانیم، توریم و پلوتونیم نیز بدست می آید.
ویژگی های فیزیکی و شیمیایی عنصر پروتاکتینیم
عنصر پروتاکتینیم، جامدی بلوری با جلای نقره ای و در عین حال رادیواکتیو است. این عنصر از عناصر سری اکتینید ها (بلوک- f) محسوب می شود. این عنصر می تواند درخشش و براقی را در هوا از خود به جا بگذارد. عنصر پروتاکتینیم، عنصری سخت و سفید است که در دمای زیر ۱/۴ کلوین به شدت رسانای جریان الکتریسیته (فوق رسانا) می باشد.
خصوصیات قابل توجه پروتاکتینیم از ساختار اتمی آن ([۸۶Rn] 5f۲۶d۱۷s۲) ناشی می شود. همانطور که مشخص است، زیر لایه f در این عنصر در حال پر شدن است. این عنصر (لانتانید ها و اکتینید ها) به واسطه آرایش الکترونی که دارند، در دسته فلزات واسطه داخلی قرار می گیرد. در واقع در این دسته از عناصر، الکترون های متمایز کننده در تراز های F(n-2) لایه ظرفیت که در واقع تراز های درونی اند قرار می گیرند. به همین دلیل، به عناصر واسطه داخلی معروف می باشند. این عناصر جزء عنصر های فلزات واسطه جدول تناوبی می باشند. فلزات واسطه در حقیقت بین فلزات قلیایی خاکی و عناصر گروه بور در جدول تناوبی قرار می گیرند. به عناصر واسطه، عناصر گروه B نیز گفته می شود.
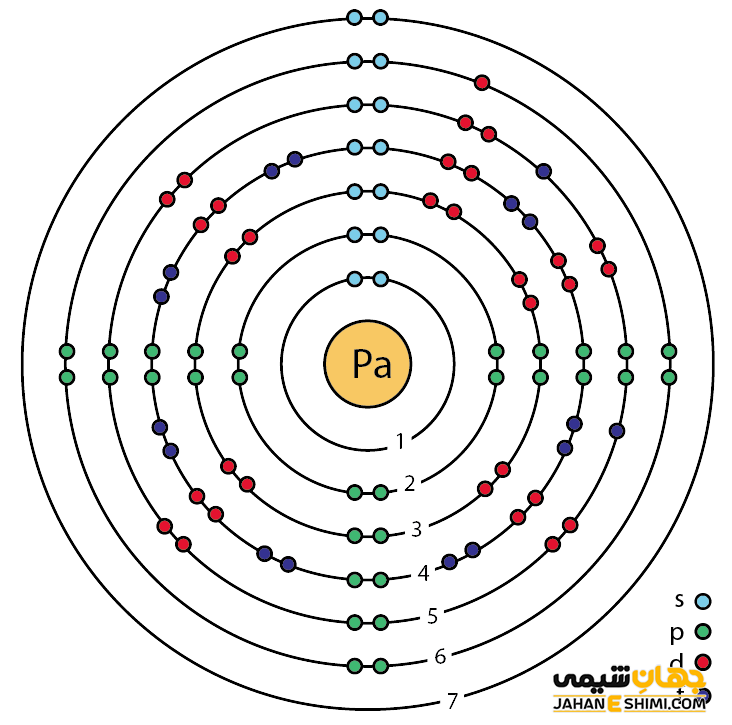
با توجه به آرایش الکترونی پروتاکتینیوم مشخص است که پنج الکترون در دورترین لایه الکترونی پروتاکتینیوم وجود دارد. پس در بیشتر ترکیبات به صورت کاتیون پنج بار مثبت (Pa۵+) ظاهر مي شود. در واقع، حالت اکسیداسیون آن بیشتر ۵+ است. از این رو می تواند در پنج پیوند کووالانسی شرکت کند.
خواص ویژه پروتاکتینیوم
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۱۵۶۸ و ۴۰۲۷ درجه سانتی گراد است.
- عنصر پروتاکتینیوم پارامغناطیس است.
- ساختار بلوری آن به شکل چهار گوشه (Centered Tetragonal)است.
- این عنصر آلوتروپ ندارد.
- جرم اتمی پروتاکتینیم برابر با ۲۳۱.۰۳۵۸۸ g/mol است.
- چگالی آن نیز برابر با ۱۵.۳۷ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با pm 163 می باشد.
- یون های پروتاکتینیم معمولا عدد اکسایش برابر با اعداد ۰، +۲، +۳، +۴ و +۵ دارند. در حقیقت یک اکسید بازی ضعیف محسوب می شود. اعداد اکسایش ۰ و +۵ متداول تر می باشد.
- اولین انرژی یونیزاسیون آن برابر با ۵۶۸ kJ/mol است.
اکتینید ها
واژه اکتینید (Actinide) به معنای شبیه اکتینیوم است که به طور کلی با نماد شیمیایی An نمایش داده می شود. همانطور که مشخص است، نام این دسته از عناصر، از فلز آکتینیوم گرفته شده است. اکتینید ها در واقع شامل ۱۵ عنصر با عدد های اتمی ۸۹ تا ۱۰۳ است. در این دسته از عناصر، زیر لایه ۵f در حال پر شدن است. به دلیل کمبود جا در جدول و به منظور اینکه نظم و ترتیب جدول تناوبی عناصر حفظ شود، این گروه از عناصر در یک ردیف ۱۴ تایی در پایین جدول قرار گرفته اند. تمامی اکتینید ها به جز فلز اکتینیم جز بلوک f هستند. عنصر اکتینیم جز بلوک d جدول تناوبی محسوب می شود، اما خواص آن شبیه به چهارده اکتینید دیگر است. دقت کنید که جهت مطالعه اکتینید ها، ساختار هسته عناصر نسبت به آرایش الکترونی آنها از اهمیت بیشتری برخوردار است.
گروه اکتینید ها با فلز اکتینیوم (۴f۰۶d۱۷s۲) آغاز و به فلز لارنسیوم (۵f۱۴۷s۲۷p۱) ختم می شود. تمامی اکتینید ها دارای هسته ناپایدار اند، بنابراین جز عناصر رادیواکتیو و پرتوزا حساب می شوند. این عناصر، فلزاتی متراکم، نرم، انعطاف پذیر، چگالی بالا و الکتروپوزیتیو هستند. برخی از آنها با چاقو به راحتی برش می خورند. همچنین ممکن است آلوتروپ های زیادی تشکیل دهند. علاوه بر آن، معمولا خاصیت پارامغناطیسی نشان می دهند. این فلزات در دمای اتاق جامد بوده و در هوا، خود به خودی آتش می گیرند. با هالوژن ها، کالکوژن ها و کربن (اورگانو اکتینید ها) واکنش می دهند. همچنین با آب جوش و اسید های رقیق، گاز هیدروژن آزاد می کنند.
ایزوتوپ های عنصر پروتاکتینیم
همانطور که می دانید، ایزوتوپ های یک عنصر تنها در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر پروتاکتینیم ایزوتوپ های فراوانی دارد. ۲۹ ایزوتوپ رادیواکتیو و پرتوزا برای پروتاکتینیم شناخته شده است. رادیوایزوتوپ ۲۳۱Pa پایدارترین ایزوتوپ آن با نیمه عمر ۳۲۷۶۰ سال است. بعد از ایزوتوپ ۲۳۱Pa، رادیو ایزوتوپ های ۲۳۳Pa با نیمه عمر ۲۶/۹۶۷ روز و ۲۳۰Pa با نیمه عمر ۱۷/۴ روز هستند. سایر ایزوتوپ های رادیواکتیو آن، نیمه عمری کمتر از ۱/۶ روز دارند. لازم به ذکر است که بیشتر آنها نیمه عمری کمتر از ۱/۸ ثانیه دارند.

کاربرد های عنصر پروتاکتینیم
به دلیل خاصیت رادیواکتیوی، کمیابی و سمی بودن آن، در حقیقت به غیر از تحقیقات علمی استفاده چندانی از این عنصر نمی شود.
ترکیبات عنصر پروتاکتینیم
پروتاکتینیوم می تواند به راحتی با اکسیژن و هالوژن ها واکنش دهد. در نتیجه اکسید و هالید ها را تولید نماید. از جمله ترکیبات آن می توان به موارد زیر اشاره کرد.
- اکسید پروتاکتینیم (PaO)
- دی اکسید پروتاکتینیم (PaO۲)
- اکسید پروتاکتینیم (V)(Pa۲O۵)
- هیدرید پروتاکتینیم (PaH۳)
- کلرید پروتاکتینیم (IV) (PaCl۴)
- کلرید پروتاکتینیم (V) (PaCl۵)
- فلوئورید پروتاکتینیم (IV) (PaF۴)
- فلوئورید پروتاکتینیم (V) (PaF۵)
- تری یدید پروتاکتینیم (PaI۳)
- یدید پروتاکتینیم (IV) (PaI۴)
- یدید پروتاکتینیم (V) (PaI۵)
- برمید پروتاکتینیم (IV) (PaBr۴)
- برمید پروتاکتینیم (V) (PaBr۵)

خطرات پروتاکتینیمیم بر روی سلامتی انسان
عنصر پروتاکتینیوم به شدت سمی و رادیواکتیو است. کار کردن با پروتاکتینیوم درست مانند کار کردن با پلوتونیوم مراقبت های زیادی نیاز دارد. این عنصر از طریق غذا خوردن، آشامیدن آب و یا هوا وارد بدن انسان می شود. در واقع با تنفس پروتاکتینیم، مقدار زیادی از آن از ریه حرکت نموده و بسته به میزان انحلال پذیری پروتاکتینیوم، از راه خون به اندام های دیگر می رسد. بنابراین می تواند در اسکلت، کبد و کلیه ته نشین شود. مهمترین عارضه ناشی از تابش های یونیزه پروتاکتینیم، سرطان است.




















