کاربرد عنصر استاتین چیست؟ خواص و ویژگی استاتین را می شناسید؟

عنصر استاتین از عناصر شیمیایی جدول تناوبی مندلیف بوده و با نشان شیمیایی At شناخته می شود. عدد اتمی عنصر استاتین ۸۵ و عدد جرمی آن ۲۱۰ است. خواص عنصر استاتین موجب شده است تا در گروه ۱۷ و تناوب ۶ جدول تناوبی عناصر جای بگیرد. از دیگر خواص عنصر استاتین می توان به کمیاب بودن آن اشاره کرد. عنصر استاتین به قدری کمیاب است که تنها ۳۰ گرم از آن بر زمین موجود است. عنصر استاتین در دسته هالوژن ها قرار داشته و نقطه ذوب و انجماد آن از سایر هالوژن ها بیشتر است. دیگر ویژگی عنصر استاتین پرتوزا بودن آن است. ترکیبات عنصر استاتین نیز شناسایی شده اند و در آزمایشات مختلف بررسی می گردند. طولانی ترین عمر ایزوتوپی عنصر استاتین نیمه عمری برابر با ۸.۱ ساعت است.
در نشریه علمی جهان شیمی فیزیک عناصر جدول تناوبی مندلیف بررسی شده و به خواص و کاربرد این عناصر پرداخته شده است. عناصری مانند: کلر، برم، ید، فلوئور و… . در ادامه با بررسی کاربرد عنصر استاتین عنصر شماره ۸۵ جدول تناوبی با ما همراه باشید.
تاریخچه عنصر استاتین
جای عنصر شماره ۸۵ در جدول تناوبی مدت ها خالی بود و کسی نتوانسته بود موفق به کشف آن شود. اما از جدول تناوبی مشخص بود که این عنصر از اعضای خانواده کلر و ید خواهد بود. مندلیف نیز این عنصر را پیش بینی کرده بود و حتی آن را اکاید نامیده بود که با عدد اتمی ۸۵ وجود دارد. سرانجام در سال ۱۹۴۰ عنصر استاتین توسط شیمیدان های آمریکایی امیلیو گینو سگر، کنت روس مکنزی و دیل ریموند کارسون موفق به کشف استاتین شدند. آن ها دریافتند که استاتین عنصری پرتوزا است که به صورت منفرد وجود ندارد. این عنصر همراه با ایزوتوپ های اورانیوم و توریم در طبیعت وجود دارد.
جالب است بدانید با وجود خواص پرتوزایی این عنصر کاربرد آن در راکتور های هسته ای صورت نمی گیرد. ۲۱۷At با اورانیوم ۲۳۳ و نپتونیم ۲۳۹ در تعادل است. این عنصر از اجتماع توریم و اورانیوم با نوترون های طبیعی حاصل می شود.
تولید عنصر استاتین
بار ها اعلام شد که عنصر ۸۵ کشف شده است و نام های متفاوتی نیز بر آن نهاده شد. اما همه آن اکتشافات دور از واقعیت بود و ثابت نشد. در نهایت تحقیقات گسترده دانشمندان برای تولید عنصر رادیواکتیو استاتین ثمربخش شد. آن ها دریافتند تنها ماده ای که میتواند برای تولید استاتین به عنوان هدف انتخاب شود، عنصر ۸۳ جدول تناوبی یعنی بیسموت است.
محققان آمریکایی کارسون و مکنزی و فیزیکدانی به نام سگر با بمباران ایزوتوپ ۲۰۹ بیسموت توانستند عنصر ۸۵ را تولید کنند. آن ها این کار را توسط ذرات آلفای شتاب دار در یک شتابدهنده انجام دادند. آزمایشات نشان داد که این عنصر از لحاظ خواص نظیر ید است.
تولید آزمایشگاهی
تولید عنصر استاتین توسط بمباران بیسموت با ذرات آلفا صورت می گیرد. از تقطیر هوا توسط گرما نیز می توان این ماده را به دست آورد. بمباران ایزوتوپ بیسموت با ذره آلفا حاصل زندگی کوتاه استاتین و نوترون هاست. جلوگیری از بخار و ناپدید شدن استاتین با استفاده از پرتو افکنی سرد بیسموت امکان پذیر خواهد بود.
ایزوتوپ At 211 نیمه عمر ۶ ساعت و ۴۹دقیقهای دارد. بنابراین استفاده از آن باید با سرعت انجام شود.
روش شناسایی و اندازهگیری مواد پرتوزا با استفاده از پرتوهای مولکولی توسط آزمایشگاه بین المللی بروک هیون (Brookhaven) ارائه شده و برای اندازهگیری آزمایشگاهی استاتین کاربرد دارد.
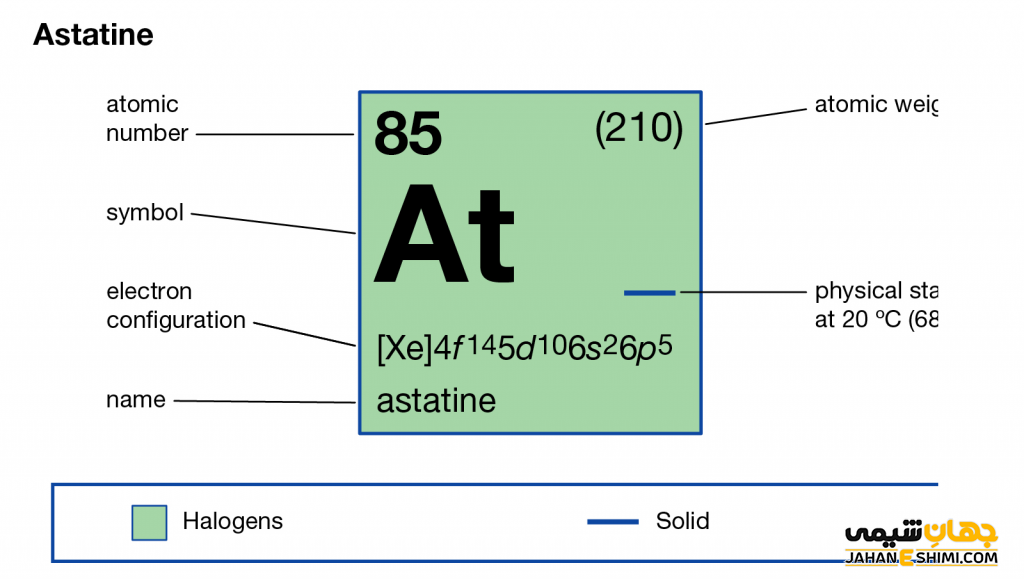
ویژگی عنصر استاتین عنصر شماره ۸۵ جدول تناوبی
- نشان شیمیایی: At
- عدد اتمی: ۸۵
- جرم اتمی (عدد جرمی): ۲۱۰
- نقطه ذوب: ۳۰۲ درجه سانتی گراد
- نقطه جوش: ۳۳۷ درجه سانتی گراد
- رنگ: متالیک
- حالت استاندارد (شرایط STP): جامد
- شماره گروه: ۱۷
- تناوب: ۶
- انرژی یونیزاسیون: ۸۹۰ کیلو ژول برمول
- آرایش الکترونی: [Xe] 4f۱۴ ۵d۱۰ ۶s۲ ۶p۵
- الکترونگاتیویته: ۲٫۲ مقیاس پائولینگ
- آنتالپی تبخیر: ۴۰ کیلوژول بر مول
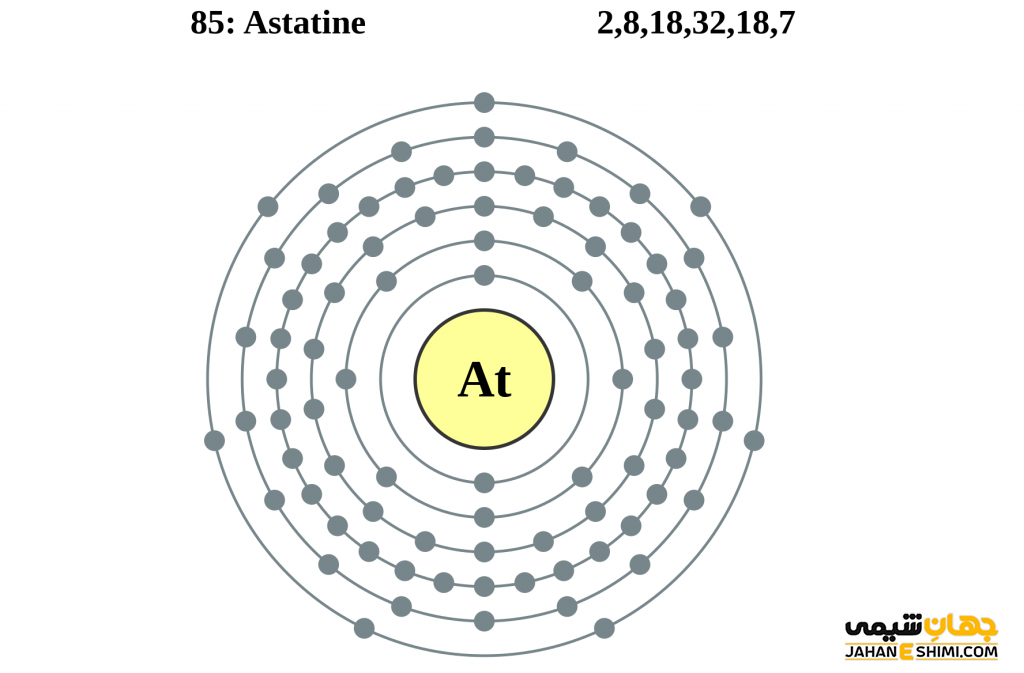
- لایه الکترونی: ۲، ۸، ۱۸، ۳۲، ۱۸، ۷
- دسته: هالوژن ها
درباره هالوژن ها
هالوژن ها عناصر گروه ۱۷ جدول تناوبی را شامل می شوند. نام هالوژن ها از واژه ای یونانی به نام نمک ساز گرفته شده است. هالوژن ها توسط شیمیدانی سوئدی به نام بارون جانز نامگذاری شده اند. در گروه عناصر گروه ۱۷، فلوئور زرد رنگ، کلر زرد مایل به سبز، برم به رنگ متمایل به قرمز، ید به شکل جامدی سیاه-بنفش رنگ و عنصر استاتین جامدی تیره و براق است. این عناصر به استثنای استاتین بهصورت هالید نمک ها بطور فراوان در طبیعت وجود دارند. این ماده احتمالا در مقادیر بسیار کم بهصورت ماده ای حد واسط با طول عمر کوتاه یافت میشود. این ماده از فرایند های تجزیه مواد رادیو اکتیو طبیعی حاصل می شود. درواقع بیشتر اطلاعات موجود درباره شیمی استاتین حاصل از مطالعه مقادیر جزئی ایزوتوپ رادیواکتیو این ماده است و از طریق واکنش های هسته ای تهیه می گردد.
واکنش پذیری هالوژن ها
واكنشپذیری هالوژن ها در جدول تناوبی از بالا به پایین كم میشود. واكنشپذیرترین هالوژن، فلوئور است و در صدر گروه هالوژن ها قرار دارد. وقتی در گروه هالوژن ها به تدریج به سمت استاتین حركت میكنیم، واكنش پذیری به طور قابل توجهی كاهش مییابد. دلیل این امر به دلیل كاهش الكترونگاتیوی است.
فلوئور بالاترین میزان الكترونگاتیوی را در میان عناصر جدول دارا است. این تمایل به جذب الكترون است سبب افزایش واكنش پذیری آن میشود. كلر هم كه بعد از فلوئور قرار گرفته دارای واكنش پذیری زیادی است. به تدریج كه به سمت پایین گروه حركت میكنیم، چون الكترونگاتیوی و تمایل به جذب الكترون در این عناصر كاهش مییابد، تمایل كمتری به شركت در واكنش ها نیز از خود نشان میدهند.
واكنش مهم هالوژن ها، واكنش با فلزات است تا بدین ترتیب الكترون مورد نیاز را از فلزات دریافت کرده و به پایداری برسند. فلوئور و كلر كه الكترونگاتیوی بالا و درنتیجه تمایل زیادی به جذب الكترون دارند، به سرعت و با شدت با فلزات واكنش میدهند. ید كه الكترونگاتیوی كمی دارد، با سرعت و شدت كمتری با فلزات واكنش می دهد.
خواص عنصر استاتین
عنصر استاتین عنصر شماره ۸۵ جدول تناوبی است. این ماده در گروه هالوژن ها جای دارد و بعد از ید قرار می گیرد. از خواص عنصر استاتین می توان به عنصری جامد با رنگ سیاه و خواص پرتوزایی و رادیواکتیو اشاره نمود. طولانی ترین عمر ایزوتوپی مربوط به At 210 با نیمه عمر ۸٫۳ ساعت است. برای آشنایی بیشتر با خواص عنصر استاتین می توان به مدل اتمی بور برای عنصر استاتین مراجعه نمود. عنصر استاتین در تناوب ۶ بعد از پولونیم و قبل از گاز نجیب رادون-۸۶ قرار دارد.
ایزوتوپ عنصر استاتین
به طور طبیعی هالوژن استاتین فاقد ایزوتوپ پایدار است. بنابراین جرم اتمی استاندارد برای این ماده وجود ندارد. تاکنون ۳۷ ایزوتوپ پرتوزا (با عدد اتمی ۱۹۱ تا ۲۲۹) از استاتین کشف شده است.
| نیمه عمر | ایزوتوپ |
| ۲۹.۴ دقیقه | At-206 |
| ۱.۶ ساعت | At-208 |
| ۷.۲ ساعت | At-211 |
| ۰.۱ میلی ثانیه | At-215 |
| ۳۲ میلی ثانیه | At-217 |
| ۱.۶ ثانیه | At-218 |
| ۵۰ ثانیه | At-219 |
ترکیبات عنصر استاتین
هالوژن ها ترکیبات مختلفی مانند هیدروژن هالید ها (Hydrogen Halides)، متال هالید ها (Metal Halides)، ترکیبات بین هالوژنی (Interhalogen Compunds) و ترکیبات اورگانو هالوژن (Organohalogen Compounds) تشکیل میدهند.
تمامی هالوژنها در واکنش با هیدروژن ها تشکیل هیدروژن هالید میدهند. واکنش پذیری در فرآیند های هیدروژن-هالوژن با افزایش جرم هالوژن ها کاهش می یابد.
کاربرد عنصر استاتین
کاربرد عنصر استاتین ممکن است مشابه ید، به عنوان رادیو ایزوتوپ در پزشکی هسته ای برای درمان سرطان استفاده شود.
استاتین-۲۱۱ اگرچه نیمه عمری تنها برابر با ۷.۲ ساعت دارد، اما ممکن است برای درمان ذرات آلفا هدفمند استفاده شود.
تاثیر کاربرد عنصر استاتین بر سلامتی
مقدار عنصر استاتین موجود در پوسته زمین کمتر از ۳۰ گرم است. چند میکروگرم از این ماده نیز به طور مصنوعی تولید می شود. در آزمایشگاه های هسته ای استاتین بررسی شده است. به خاطر رادیواکتیو بودن این ماده روش های خاصی مورد استفاده قرار می گیرد. در هنگام استفاده و کاربرد این ماده باید بسیار مراقب بود. استاتین از دسته هالوژن بوده و مانند ید در غده تیروئید تجمع می یابد. از لحاظ شیمیایی میزان سمیت استاتین مانند ید است. میزان سمی بودن هالوژن ها با افزایش جرم اتمی آن ها کاهش مییابد.
اثرات زیست محیطی استاتین
مقدار عنصر استاتین در بیوسفر زیاد نبوده و بنابراین خطری برای محیط زیست محسوب نمی شود.

درباره عناصر شیمیایی
جهان هستی از عناصر مختلفی تشکیل یافته است. درواقع بدون عناصر شیمیایی جهان هرگز شکل نمی گرفت. بنابراین شناخت عناصر شیمیایی از ملزومات گسترش علم و دانش است. برای شناخت و درک کامل تر، این عناصر شیمیایی در جدولی به نام جدول تناوبی مندلیف مرتب شده اند. درواقع عناصر شیمیایی جدول تناوبی مندلیف شامل عناصر گوناگونی می شود. عناصر این جدول از لحاظ خواص فیزیکی و شیمیایی با یکدیگر تفاوت هایی دارند. برای پی بردن به کاربرد و همینطور خطرات این عناصر باید به شناخت درست آن ها پی برد. لازم به ذکر است که علاوه بر خواص مختلف، این عناصر حالات مختلفی را در شرایط استاندارد خواهند داشت. جامد، مایع، گاز، حالت های مختلف این عناصر است. برخی از عناصر جدول تناوبی فلز و برخی نافلز و برخی دیگر از عناصر هم شبه فلز هستند.
اغلب عناصری که در یک گروه جدول مندلیف قرار گرفته اند، ویژگی های فیزیکی و شیمیایی نزدیک به هم دارند. برای شناخت جایگاه این عناصر می توان به جدول تناوبی مندلیف مراجعه نمود. کاربرد عناصر در صنایع و کارخانه ها، سلامت و پزشکی و کشاورزی و… با شناخت کامل عناصر و خطرات ناشی از آن ها امکان پذیر است. شناخت این عناصر به گسترش علم و کشف روش های نوین در تولید انرژی می انجامد.
سخن آخر
اهمیت عناصر و شناخت بیشتر آن ها در پیشرفت علم و صنعت و همینطور زندگی بشر منجر شده است تا نشریه علمی جهان شیمی فیزیک به بررسی عناصر جدول تناوبی مندلیف بپردازد. شما هم می توانید جهت آشنایی با خواص و کاربرد و تاریخچه عناصر شیمیایی به سایت نشریه علمی جهان شیمی فیزیک مراجعه و اطلاعات علمی خود در زمینه عناصر شیمیایی را افزایش دهید.



















